- 319.50 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
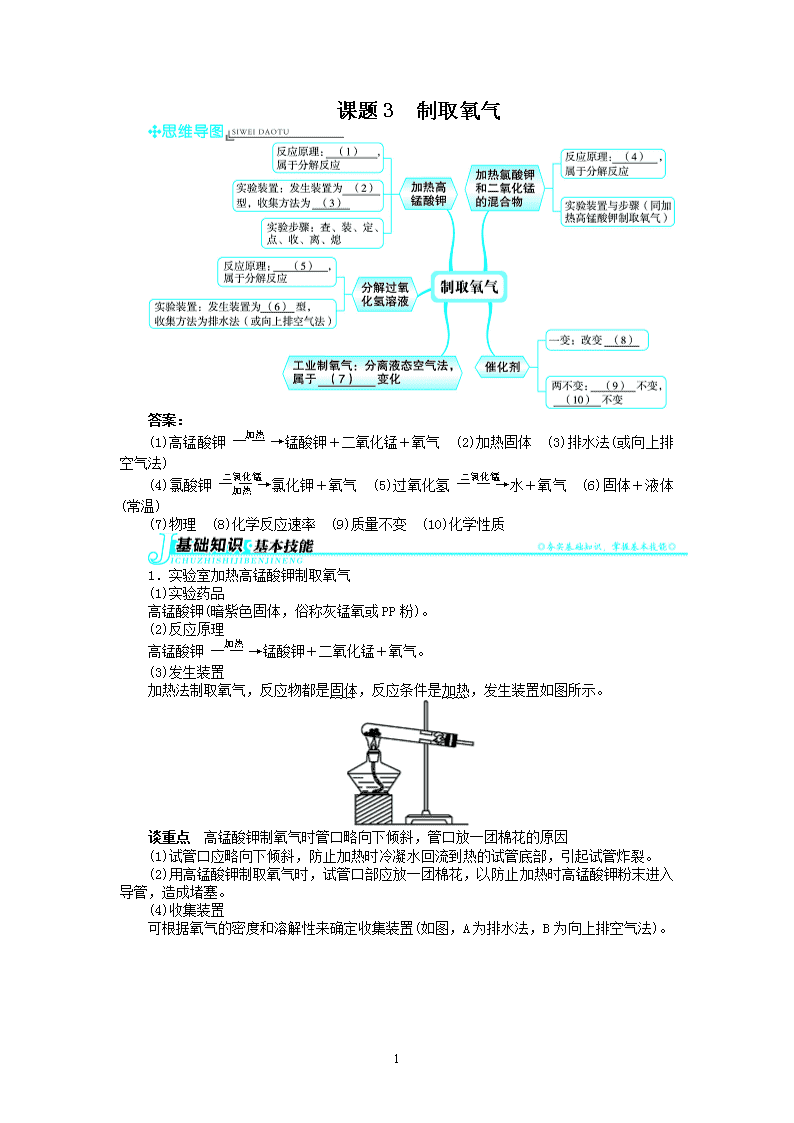
课题 3 制取氧气
答案:
(1)高锰酸钾――→加热 锰酸钾+二氧化锰+氧气 (2)加热固体 (3)排水法(或向上排空
气法)
(4)氯酸钾――→二氧化锰
加热 氯化钾+氧气 (5)过氧化氢――→二氧化锰水+氧气 (6)固体+液体(常温)
(7)物理 (8)化学反应速率 (9)质量不变 (10)化学性质
1.实验室加热高锰酸钾制取氧气
(1)实验药品
高锰酸钾(暗紫色固体,俗称灰锰氧或 PP 粉)。
(2)反应原理
高锰酸钾――→加热 锰酸钾+二氧化锰+氧气。
(3)发生装置
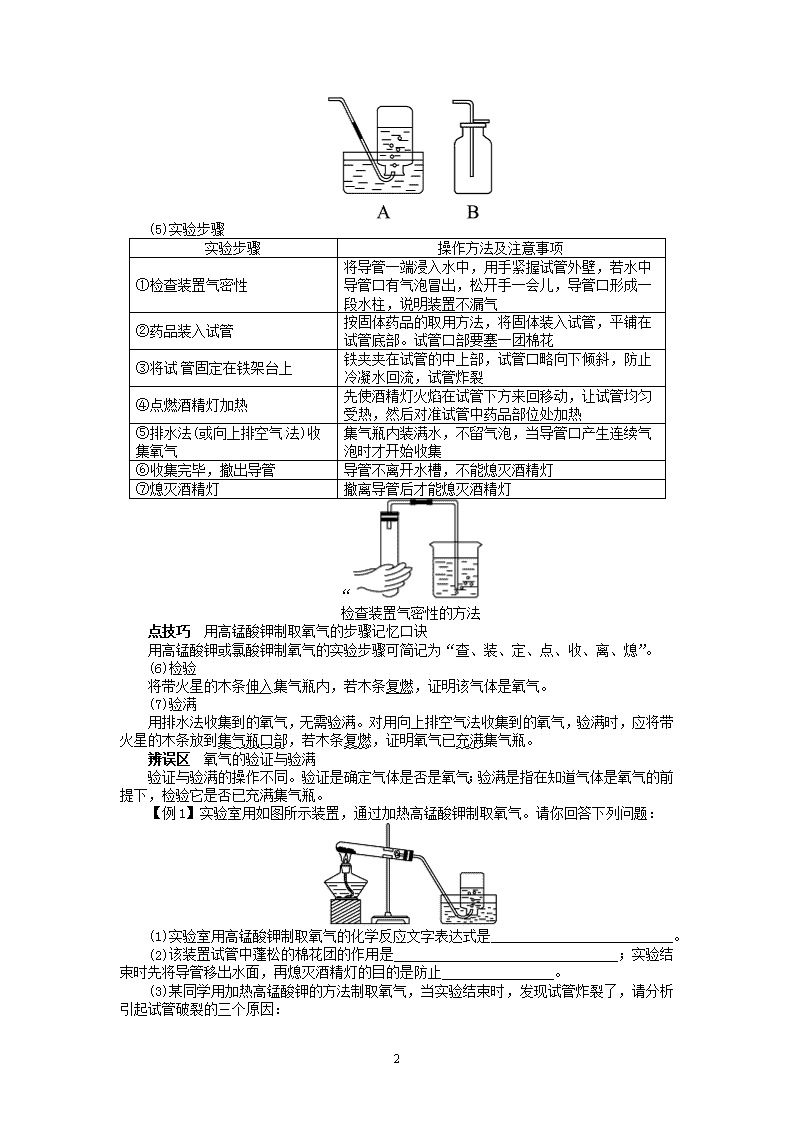
加热法制取氧气,反应物都是固体,反应条件是加热,发生装置如图所示。
谈重点 高锰酸钾制氧气时管口略向下倾斜,管口放一团棉花的原因
(1)试管口应略向下倾斜,防止加热时冷凝水回流到热的试管底部,引起试管炸裂。
(2)用高锰酸钾制取氧气时,试管口部应放一团棉花,以防止加热时高锰酸钾粉末进入
导管,造成堵塞。
(4)收集装置
可根据氧气的密度和溶解性来确定收集装置(如图,A 为排水法,B 为向上排空气法)。
2
(5)实验步骤
实验步骤 操作方法及注意事项
①检查装置气密性
将导管一端浸入水中,用手紧握试管外壁,若水中
导管口有气泡冒出,松开手一会儿,导管口形成一
段水柱,说明装置不漏气
②药品装入试管 按固体药品的取用方法,将固体装入试管,平铺在
试管底部。试管口部要塞一团棉花
③将试 管固定在铁架台上 铁夹夹在试管的中上部,试管口略向下倾斜,防止
冷凝水回流,试管炸裂
④点燃酒精灯加热 先使酒精灯火焰在试管下方来回移动,让试管均匀
受热,然后对准试管中药品部位处加热
⑤排水法(或向上排空气 法)收
集氧气
集气瓶内装满水,不留气泡,当导管口产生连续气
泡时才开始收集
⑥收集完毕,撤出导管 导管不离开水槽,不能熄灭酒精灯
⑦熄灭酒精灯 撤离导管后才能熄灭酒精灯
“
检查装置气密性的方法
点技巧 用高锰酸钾制取氧气的步骤记忆口诀
用高锰酸钾或氯酸钾制氧气的实验步骤可简记为“查、装、定、点、收、离、熄”。
(6)检验
将带火星的木条伸入集气瓶内,若木条复燃,证明该气体是氧气。
(7)验满
用排水法收集到的氧气,无需验满。对用向上排空气法收集到的氧气,验满时,应将带
火星的木条放到集气瓶口部,若木条复燃,证明氧气已充满集气瓶。
辨误区 氧气的验证与验满
验证与验满的操作不同。验证是确定气体是否是氧气;验满是指在知道气体是氧气的前
提下,检验它是否已充满集气瓶。
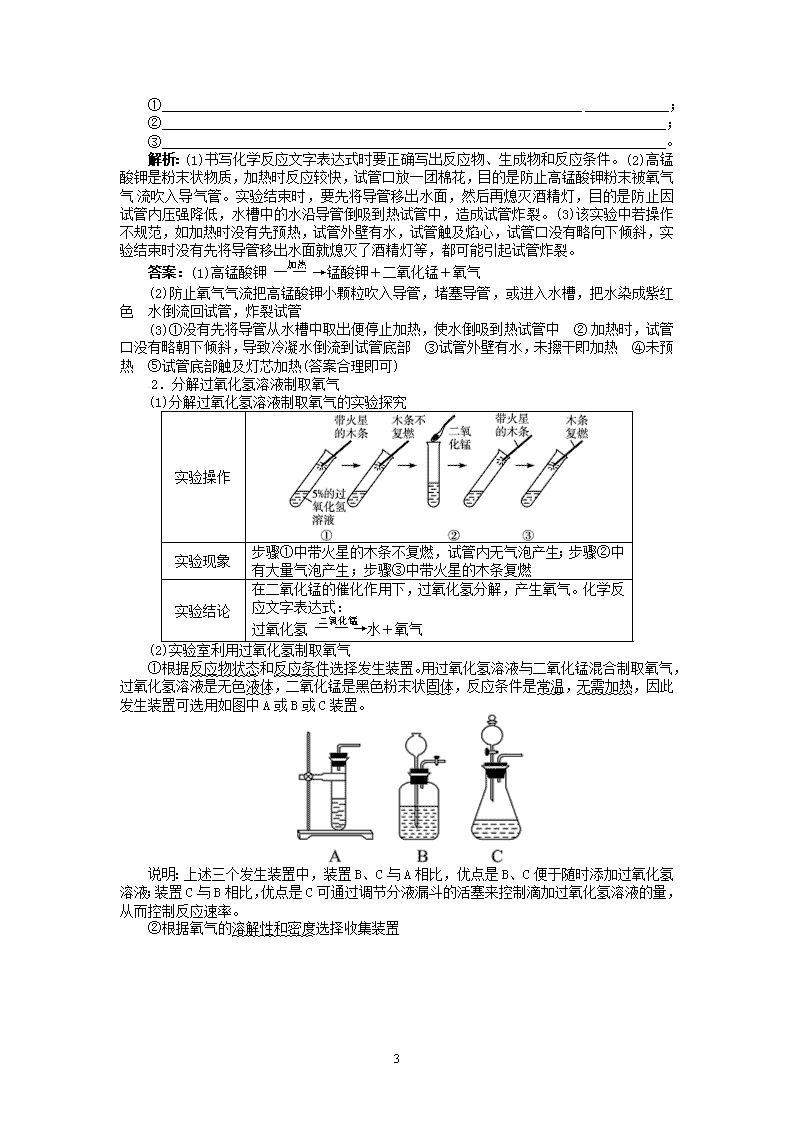
【例 1】实验室用如图所示装置,通过加热高锰酸钾制取氧气。请你回答下列问题:
(1) 实 验 室 用 高 锰 酸 钾 制 取 氧 气 的 化 学 反 应 文 字 表 达 式 是
__________________________。
(2)该装置试管中蓬松的棉花团的作用是________________________________;实验结
束时先将导管移出水面,再熄灭酒精灯的目的是防止________________。
(3)某同学用加热高锰酸钾的方法制取氧气,当实验结束时,发现试管炸裂了,请分析
3
引起试管破裂的三个原因:
①____________________________________________________________ ____________
;
②________________________________________________________________________;
③________________________________________________________________________。
解析:(1)书写化学反应文字表达式时要正确写出反应物、生成物和反应条件。(2)高锰
酸钾是粉末状物质,加热时反应较快,试管口放一团棉花,目的是防止高锰酸钾粉末被氧气
气 流吹入导气管。实验结束时,要先将导管移出水面,然后再熄灭酒精灯,目的是防止因
试管内压强降低,水槽中的水沿导管倒吸到热试管中,造成试管炸裂。(3)该实验中若操作
不规范,如加热时没有先预热,试管外壁有水,试管触及焰心,试管口没有略向下倾斜,实
验结束时没有先将导管移出水面就熄灭了酒精灯等,都可能引起试管炸裂。
答案:(1)高锰酸钾――→加热 锰酸钾+二氧化锰+氧气
(2)防止氧气气流把高锰酸钾小颗粒吹入导管,堵塞导管,或进入水槽,把水染成紫红
色 水倒流回试管,炸裂试管
(3)①没有先将导管从水槽中取出便停止加热,使水倒吸到热试管中 ② 加热时,试管
口没有略朝下倾斜,导致冷凝水倒流到试管底部 ③试管外壁有水,未擦干即加热 ④未预
热 ⑤试管底部触及灯芯加热(答案合理即可)
2.分解过氧化氢溶液制取氧气
(1)分解过氧化氢溶液制取氧气的实验探究
实验操作
实验现象 步骤①中带火星的木条不复燃,试管内无气泡产生;步骤②中
有大量气泡产生;步骤③中带火星的木条复燃
实验结论
在二氧化锰的催化作用下,过氧化氢分解,产生氧气。化学反
应文字表达式:
过氧化氢――→二氧化锰水+氧气
(2)实验室利用过氧化氢制取氧气
①根据反应物状态和反应条件选择发生装置。用过氧化氢溶液与二氧化锰混合制取氧
气,过氧化氢溶液是无色液体,二氧化锰是黑色粉末状固体,反应条件是常温,无需加热,
因此发生装置可选用如图中 A 或 B 或 C 装置。
说明:上述三个发生装置中,装置 B、C 与 A 相比,优点是 B、C 便于随时添加过氧化氢
溶液;装置 C 与 B 相比,优点是 C 可通过调节分液漏斗的活塞来控制滴加过氧化氢溶液的量,
从而控制反应速率。
②根据氧气的溶解性和密度选择收集装置
4
a.由于氧气不易溶于水且不与水发生反应,故欲制取较纯净的氧气时,需采用排水法
收集,如图 A;
b.由于氧气的密度比空气的密度大,故欲制取较干燥的氧气时,需采用向上排空气法
收集,如图 B。
谈重点 向上排空气法收集氧气时应注意什么
用向上排空气法收集氧气时,导气管应伸入集气瓶底部,以便于排尽集气瓶中的空气。
③实验步骤
a.检查装置的气密性。
如图,先在分液漏斗中注入水,盖紧塞子,将导管的末端放入水中,用热毛巾捂住锥形
瓶,看导管口是否有气泡逸出。若有气泡逸出,说明气密性好。
b.向锥形瓶中加入二氧化锰固体。
c.塞好带有长颈漏斗(或分液漏斗)和导管的双孔塞。
d.向分液漏斗中加入过氧化氢溶液。
e.用排水法收集气体。
如果选择长颈漏斗,应注意什么问题?
长颈漏斗的下端管口一定要伸到液面以下,以防产生的气体从长颈漏斗口逸出。
析规律 排水法、向上排空气法的优缺点
用排水法收集到的氧气较纯净,但不干燥;用向上排空气法收集到的氧气较干燥,但不
纯净。
(3)实验室利用氯酸钾制取氧气
在实验室里还可以通过加热混有二氧化锰的氯酸钾固体制取氧气,除生成氧气外,同时
还有一种叫氯化钾的物质生成。二氧化锰在这一个反应中也是催化剂。
氯酸钾――→二氧化锰
加热 氯化钾+氧气
【例 2】过氧化氢溶液在二氧化锰的催化下能迅速分解成氧气和水。分液漏斗可以通过
调节活塞控制液体滴加速度。甲、乙两位同学要选用下图所示装置,用过氧化氢溶液和二氧
化锰制取氧气,试回答下列问题:
(1)分液漏斗中应放入的物质是________,锥形瓶中应放入的物质是________。反应文
字表达式是____________________________。
(2)甲、乙两位同学在制取氧气时,都选择 A 装置作为气体的发生装置,但他们收集气
5
体的装置不同,实验后对比知道,甲收集的气体纯度比乙高,则甲选择________装置收集氧
气,乙选择________装置收集氧气。(填字母)
(3)甲同学选择该装置收集氧气的依据是
________________________________________________________________________。
(4)乙同学选择该装置收集氧气的 依据是
________________________________________________________________________。
(5)装置 A 中反应剧烈,据此提出实验安全注意事项是________(填序号)。
A.控制液体的滴加速度
B.用体积小的锥形瓶
C.加热反应物
解析:液体由分液漏斗加入,固体由锥形瓶口部加入。由于氧气不易溶于水,可用排水
法收集,且用排水法收集到的氧气不含空气,较纯净;由于氧气的密度比空气大,可用向上
排空气法收集氧气,但用排空气法收集的氧气不如排水法收集到的氧气纯净。A 中通过调节
分液漏斗的活塞,可控制过氧化氢溶液的滴加速度,从而控制反应速率,得 到平稳的氧气
流。
答案:(1)过氧化氢溶液 二氧化锰
过氧化氢――→二氧化锰水+氧气
(2)D B
(3)氧气不易溶于水
(4)氧气的密度比空气的密度大
(5)A
3.催化剂及催化作用
(1)概念
概念 描述
催化剂
在化学反应里能改变其他物质的化学反应速率,而本身的质
量和化学性质在化学反应前后都没有发生变化的物质叫做催
化剂(又叫触媒)
催化作用 催化剂在化学反应中所起的作用
(2)特点
催化剂概念的要点可概括为“一变”“两不变”。
①“一变”是指催化剂能改变其他物质的化学反应速率。这里的“改变”包括加快和减
慢,也就是说,有时用催化剂是为了加快反应速率,有时是为了减慢反应速率。
②“两不变”是指催化剂的质量和化学性质在化学反应前后没有改变。
辨误区 正确理解催化剂概念应注意什么
①催化剂不一定都加快反应速率。有些加快反应速率,有些减慢反应速率。
②催化剂的化学性质不变,并不意味着物理性质不变。
③催化剂是针对某具体反应而言,有选择性。
④没有催化剂,并不意味着反应不能发生。
⑤同一反应的催化剂可能有多种。如硫酸铜溶液、二氧化锰都是过氧化氢分解的催化剂。
【例 3】下列有关催化剂的叙述不正确的是( )
A.催化剂在化学变化中起催化作用
B.催化剂只能加快化学反应速率
C.催化剂在化学反应前后质量和化学性质不变
D.用过氧化氢制氧气可用二氧化锰作催化剂
解析:
A √ 催化剂对化学变化起催化作用
B × 催化剂可能加快也可能减慢化学反应速率,但质量和
化学性质不变C √
D √ 二氧化锰能加快过氧化氢的分解
答案:B
6
4.氧气的工业制法
(1)原料:空气(空气中约含有 21%的氧气,是制取氧气廉价易得的原料)。
(2)原理:液态空气中的氮气与氧气的沸点不同。氮气的沸点低于氧气,加热时先汽化
出氮气。
(3)过程:分离液态空气,其过程简单表示如下:
空气――→多次压缩
降温 液态空气――→低温蒸发
-196 ℃
(4)贮存:贮存在蓝色钢瓶中。
分离液态空气制氧气是分解反应吗?
不是。因为操作前后,没有新物质生成,属于物理变化,不属于分解反应。
析规律 工业生产气体需考虑的因素
工业生产需考虑原料是否易得、价格是否便宜、成本是否低廉、能否用于大量生产及对
环境的影响等因素。
【例 4】下列变化中不属于化学变化的是( )
A.加热高锰酸钾制氧气
B.氧气使带火星的木条复燃
C.工业上用分离空气法制氧气
D.过氧化氢和二氧化锰混合
解析:化学变化产生了新物质。高锰酸钾不含氧气,加热后产生氧气;氧气使带火星的
木条复燃时产生二氧化碳等;过氧化氢和二氧化锰混合产生氧气,故 A、B、D 都发生了化学
变化。工业上因分离空气法制氧气,没产生新物质,不属于化学变化。
答案:C
5.分解反应
(1)概念:由一种反应物生成两种或两种以上其他物质的反应,叫做分解反应。
(2)特点:“一变多”,表达式为 X―→A+B+……
(3)判断:判断分解反应的依据是看反应物、生成物的种数。反应物是一种的一般是分
解反应;反应物不是一种的,一定不是分解反应。
【例 5】下列反应中,属于分解反应的是( )
A.酒精+氧气――→点燃 二氧化碳+水
B.红磷+氧气――→点燃 五氧化二磷
C.氧化汞――→加热 汞+氧气
D.乙炔+氧气――→点燃 二氧化碳+水
解析:分解反应的特征是“一变多”,反应物只有一种。A、B、D 的反应物都是两种;
C 的反应物是一种,符合“一变多”特征。
答案:C
6.化合反应与分解反应的比较
类型 分解 反应 化合反应
定义 由一种反应物生成两种或两种以
上物质的反应
由两种或两种以上物质生成一种
物质的反应
表达式 X―→A+B+… A+B+…―→X
反应物 一种 两种或两种以上
生成物 两种或两种以上 一种
特点 一变多 多变一
举例
过氧化氢
――→二氧化锰水+氧气 镁+氧气――→点燃 氧化镁
谈重点 化合反应与分解反应
①化合反应、分解反应都属于化学反应的基本类型。②判断化合反应、分解反应的依据
7
是反应物、生成物种数。生成物是一种的一般属于化合反应;反应物是一种的反应一般属于
分解反应。
7.加热高锰酸钾制取氧气实验的操作要点
操作要点 原因
固定试管时试管口应略向下倾斜 防止加热时冷凝水倒流,试管炸裂
试管内的导管不宜太长 过长不利于排净空气,且不利于气体导出
试管口部放一团棉花 防止加热时高锰酸钾粉末吹入导管
当导管口连续均匀地冒出气泡时再收集 反应刚开始,冒出的气泡是空气
收集氧气时,导管应伸入集气瓶底部 便于排净空气,收集到较纯净的氧气
实验结束后,先从水槽中移走导管,后熄灭酒
精灯
防止水槽中的水倒吸到热的试管中,导致试
管炸裂
【例 6—1】下列反应有一种与其他三种反应类型不同,它是( )
A.铜+氧气+二氧化碳+水―→碱式碳酸铜
B.二氧化碳+水―→碳酸
C.高锰酸钾加热――→加热 锰酸钾+二氧化锰+氧气
D.碳+氧气――→点燃 二氧化碳
解析:根据反应物、生成物的种数可迅速作出判断。反应物是 一种,生成物是多种的
一定属于分解反应;反应物是多种,生成物是一种的一定属于化合反应。A 由四种物质生成
一种物质,属于化合反应;B 由两种物质生成一种物质,属于化合反应;C 由一种物质生成
三种物质,属于分解反应;D 由两种物质生成一种物质,属于化合反应。显然 A、B、D 的反
应类型相同,选 C。
答案:C
【例 6—2】下列反应中,既不属于分解反应,又不属于化合反应的是( )
A.氯酸钾――→二氧化锰
加热 氯化钾+氧气
B.铁+氧气――→点燃 四氧化三铁
C.碳酸钙――→高温 氧化钙+二氧化碳
D.乙炔+氧气――→点燃 二氧化碳+水
解析:化合反应的特点是“多变一”,分解反应的特点是“一变多”。A、C 为“一变
多”,属于分解反应;B 为“多变一”,属于化合反应;D 既不是“多变一”又不是“一变
多”,故 D 既不是化合反应,又不是分解反应。
答案:D
【例 7—1】下列实验室制取氧气的操作不正确的是( )
A.装药品前检查装置的气密性
B.导管口开始有气泡冒出时,不宜立即收集气体
C.停止加热时,应先把导管移出水面,然后再熄灭酒精灯
D.收集满氧气的集气瓶从水槽中取出后倒放在桌面上
解析:
A √ 在有气体产生或参与反应的实验装置中,通常先检查装置的气密性,
防止漏气
B √ 反应开始时冒出的气体是空气,气泡均匀冒出后才能收集到较纯净的
氧气
C √ 先熄灭酒精灯会使水倒流引起试管炸裂
D × 氧气的密度大于空气,故收集满氧气后,集气瓶应该正放在桌面上
答案:D
【例 7—2】小倩用加热高锰酸钾制取氧气并用 排水法收集氧气时,发现水槽内的水变
成了 红色,请你帮她分析,产生这一现象的原因是( )
A.试管口略向下倾斜续表
B.用酒精灯的外焰加热
8
C.试管口未放一团棉花
D.没有进行均匀加热
解析:高锰酸钾是粉末状固体,若试管口不放棉花,很容易被吹入导管,从而进入水槽,
使水槽内的水变红。
答案:C
8.实验室制取气体时对实验装置的选择
实验装置分为发生装置和收集装置,选择实验装置应综合考虑多种因素。
(1)发生装置的选择决定于反应物的状态和反应的条件。
例如,用高锰酸钾或氯酸钾制氧气时反应物都是固体,都需要加热,故应用相同装置
——“固(或固+固)加热型”。用过氧化氢制氧气时,过氧化氢是液体且不需加热,发生装
置与上述装置不同,应用“固+液常温型”。
(2)收集装置的选择决定于被收集气体的密度和溶解性。
不易溶于水(或难溶于水)且不与水发生反应的气体,可用排水法收集;气体的密度跟空
气的密度接近且难溶于水的气体,一般采用排水法收集。
不与空气发生反应且密度比空气大的气体,可用向上排空气法收集;
不与空气发生反应且密度比空气小的气体,可用向下排空气法收集。
【例 8】(实验综合题)实验室中,利用下列装置可以制取一些气体,请回答下列问题:
(1)写出带标号的仪器的名称:①______,
____________________________________ ____。
(2)向气体发生装置内加入药品前,应该进行的操作是
______________________________
________________________________________________________________________。
(3)实验室若用高锰酸钾制取氧气,选择的发生装置是________,文字表达式为
________________________________________________________________________。
(4)乙炔又称电石气,是一种无色、无味、密度比空气略小,不溶于水的气体。实验室
用电石(固体)与水反应制取乙炔。你认为制取乙炔应选择的发生装置是________,收集装置
是____________。
解析:本题综合考查了实验室制取氧气的仪器、步骤、装置的选取、原理。在气体的制
取中一定要检查装置的气密性,防止装置漏气。(3)实验室用高锰酸钾制取氧气,高锰酸钾
是固体,且反应需要加热,故应选 择 A 装置。(4)用电石和水制取乙炔气体,是固体和液体
之间的反应,且反应不需要加热,故选用发生装置 B。生成物乙炔密度比空气略小,不能选
用排空气法收集;由于不溶于水,可选用收集装置 E。
答案:(1)铁架台 集气瓶
(2)检查装置的气密性
(3)A 高锰酸钾――→加热 锰酸钾+二氧化锰+氧气
(4)B E
相关文档
- 2019九年级化学上册 第七单元课题22021-11-109页
- 九年级化学上册物质构成的奥秘单元2021-11-1017页
- 人教版九年级化学上册课件第一单元2021-11-10123页
- 人教版九年级化学上册教案(第二单元2021-11-104页
- 九年级化学上册 33 元素教学 新版2021-11-1019页
- 九年级化学上册第一章大家都来学化2021-11-104页
- 九年级化学上册第3单元综合技能过2021-11-104页
- 模式2:人教版九年级化学上册导学案(82021-11-1081页
- 人教版九年级化学上册全册单元考点2021-11-1049页
- 2019九年级化学上册 第三单元《物2021-11-1011页