- 2.14 MB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
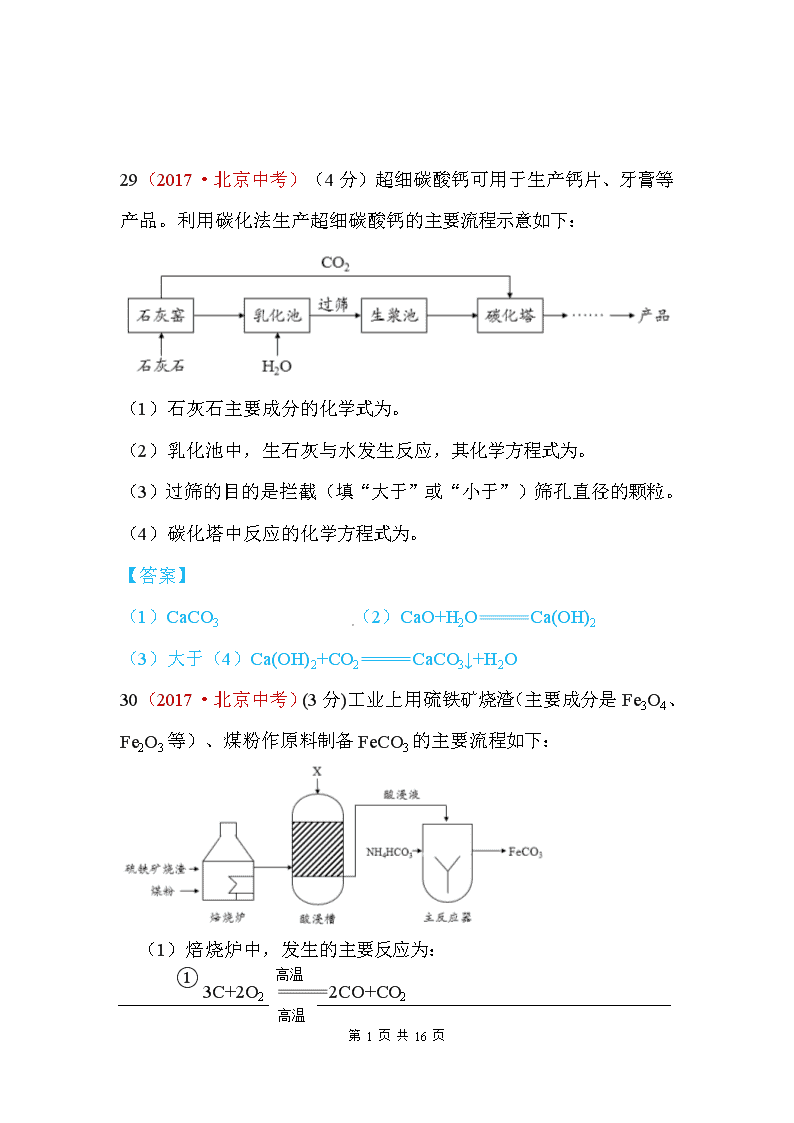
29(2017·北京中考)(4分)超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:
(1) 石灰石主要成分的化学式为。
(2) 乳化池中,生石灰与水发生反应,其化学方程式为。
(3) 过筛的目的是拦截(填“大于”或“小于”)筛孔直径的颗粒。
(4) 碳化塔中反应的化学方程式为。
【答案】
(1)CaCO3 (2)CaO+H2O=Ca(OH)2
(3)大于(4)Ca(OH)2+CO2=CaCO3↓+H2O
30(2017·北京中考)(3分)工业上用硫铁矿烧渣(主要成分是Fe3O4、Fe2O3等)、煤粉作原料制备FeCO3的主要流程如下:
高温
(1)焙烧炉中,发生的主要反应为:
高温
① 3C+2O2 =2CO+CO2
第 16 页 共 16 页
高温
② Fe2O3+CO=2FeO+CO2
③ Fe3O4+CO=3FeO+CO2
上述反应中的各物质,碳元素呈现种化合价。
(2)酸浸槽中,FeO转化为FeSO4,加入的物质X是。
(3)主反应器中,生成FeCO3的反应物为。
【答案】
(1)3 (2)硫酸 (3)FeSO4和NH4HCO3
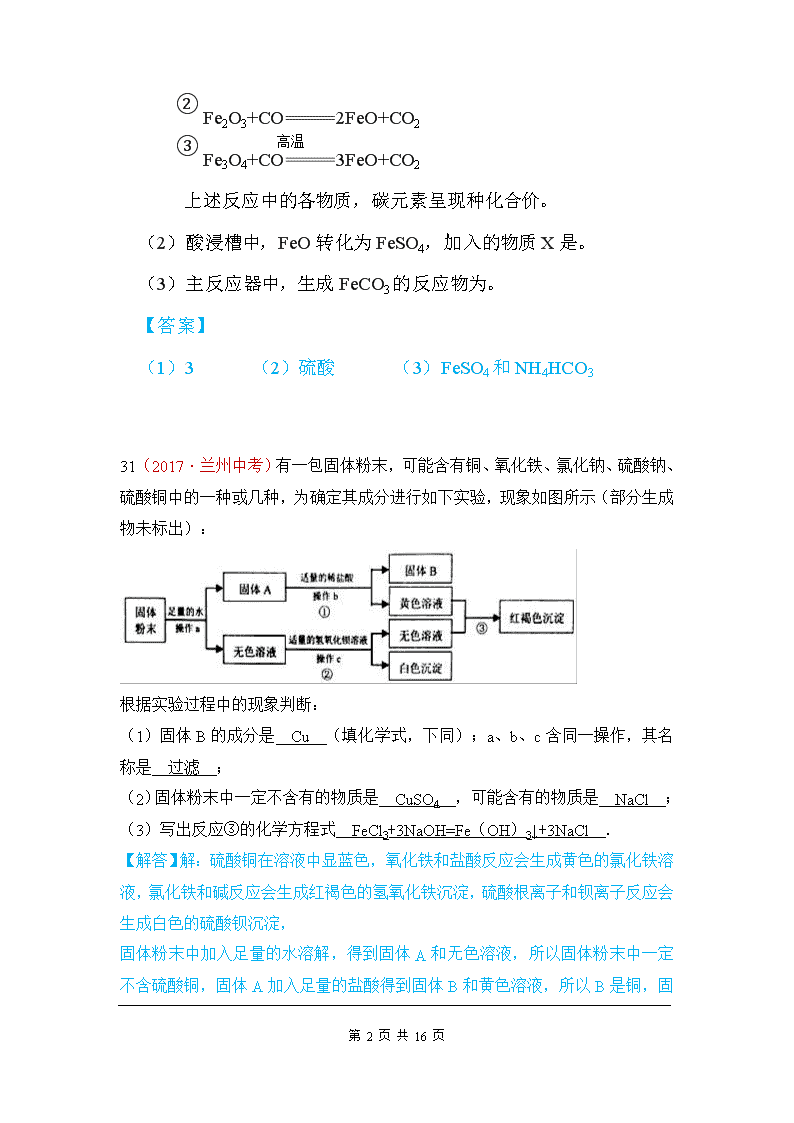
31(2017·兰州中考)有一包固体粉末,可能含有铜、氧化铁、氯化钠、硫酸钠、硫酸铜中的一种或几种,为确定其成分进行如下实验,现象如图所示(部分生成物未标出):
根据实验过程中的现象判断:
(1)固体B的成分是 Cu (填化学式,下同);a、b、c含同一操作,其名称是 过滤 ;
(2)固体粉末中一定不含有的物质是 CuSO4 ,可能含有的物质是 NaCl ;
(3)写出反应③的化学方程式 FeCl3+3NaOH=Fe(OH)3↓+3NaCl .
【解答】解:硫酸铜在溶液中显蓝色,氧化铁和盐酸反应会生成黄色的氯化铁溶液,氯化铁和碱反应会生成红褐色的氢氧化铁沉淀,硫酸根离子和钡离子反应会生成白色的硫酸钡沉淀,
第 16 页 共 16 页
固体粉末中加入足量的水溶解,得到固体A和无色溶液,所以固体粉末中一定不含硫酸铜,固体A加入足量的盐酸得到固体B和黄色溶液,所以B是铜,固体粉末中含有铜、氧化铁,无色溶液加入氢氧化钡会生成白色沉淀,所以固体粉末中一定含有硫酸钠,硫酸钠和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠,所以
(1)固体B的成分是Cu,a、b、c含同一操作,可以将不溶性固体从溶液中分离出来,其名称是过滤;
(2)通过推导可知,固体粉末中一定不含有的物质是CuSO4,可能含有的物质是NaCl;
(3)反应③是氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠,化学方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
故答案为:(1)Cu,过滤;
(2)CuSO4,NaCl;
(3)FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
23(2017·绥化中考)从海水中可制备纯碱和金属镁,其流程如下图所示。
(1)粗盐提纯时,每步操作都会用到的一种玻璃仪器是 。(填仪器名称)
(2)粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可加入下列物质:
a.适量的盐酸 b.稍过量的Na2CO3溶液 c. 稍过量的Ba(OH)2溶液,利用过滤等操作进行除杂,则加入这三种物质的先后顺序为 。(填字母序号)
(3)向饱和的氯化铵溶液中通入氨气和二氧化碳,经过一系列变化,最终可制得纯碱。请写出第Ⅲ步反应的化学方程式 。
(4)第V步Mg(OH)2与盐酸的反应 中和反应。(选填“是”或“不是”)
23. (1)玻璃棒 (2) cba
(3) 2NaHCO3 Na2CO2+CO2↑+H2O (4)是
第 16 页 共 16 页
35(2017·哈尔滨中考)(5分)某钢铁厂实验室为测定赤铁矿中Fe2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为__________________________________;
(2)样品中Fe2O3的质量分数是_______;
(3)根据已知条件列出求解200g稀硫酸中溶质质量(x)的比例式___________________;
(4)若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为_________;
(5)该钢铁厂每天用上述赤铁矿石1900t来生产生铁。则理论上日产含杂质5%的生铁的质量为_________。
19(2017·江西中考)(6分)碱式碳酸镁是一种新型阻燃剂,其工业制备流程如下:
(l)常温下向溶液中加入少量的NH4HCO3固体,固体不能溶解,则该溶液为NH4HCO3的_____(填“饱和”或“不饱和”)溶液;
(2)操作I的名称是________;“一系列操作”中包括蒸发,实验室中蒸发溶液时用玻璃棒搅拌的作用是________;
(3)副产品氯化铵与氢氧化钠反应,生成了一种可直接进入上述流程循环利用的物质是____。
19. (1)饱和 (2)过滤 防止液体飞溅 (3)氨气
11(2017·安顺中考)(6分)某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
第 16 页 共 16 页
请回答下列问题:
(1)溶液A中共含有____种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式:____________(只写一个)。
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为________。
氢氧化物
Fe(OH)3
Cu(OH)2
Mg(OH)2
开始沉淀的pH
1.5
4.2
8.6
完全沉淀的pH
3.2
6.7
11.1
(3)写出溶液B中加入熟石灰发生的化学反应方程式:___________。
11、(6分)
(1)4;MgO+2HCl=MgCl2+H2O(2分); (或Fe2O3+6HCl=2FeCl3+3H2O;CuO+2HCl=CuCl2+H2O)
(2)6.7~8.6,或6.7
相关文档
- 江苏省2018-2020年三年中考物理真2021-11-1061页
- 2020全国中考数学试卷分类汇编(2)2021-11-109页
- 江西省2016-2020中考物理1年模拟真2021-11-1018页
- 贵州、广西部分地区2020年中考语文2021-11-1012页
- 2020年全国中考数学试卷分类汇编(2021-11-1034页
- 备战2021 2020中考化学真题 考点62021-11-1015页
- 2016年全国各地中考数学试题分类解2021-11-1010页
- 2020年中考语文真题专题分类汇编-2021-11-102页
- 全国各地2018-2020三年中考物理真2021-11-1030页
- 2019年全国中考数学真题分类汇编:整2021-11-1023页