- 246.70 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
九年级化学上册(人教版)第三单元 单元练习卷
一、单选题
1.某同学从衡阳到西藏旅游,到达西藏后,发现从衡阳带来的密封饼干包装袋鼓起了。包装袋鼓起的原因是( )
A. 袋内饼干的体积变大 B. 袋内气体分子的体积变大
C. 袋内气体分子个数增多 D. 袋内气体分子间的间隙变大
2.如图所示,在小烧杯A中盛有滴入酚酞溶液的蒸馏水,然后向小烧杯B中倒入浓氨水,立即用大烧杯罩住烧杯A和B,过一段时间后发现烧杯A中溶液由无色变为红色。下列有关说法错误的是( )
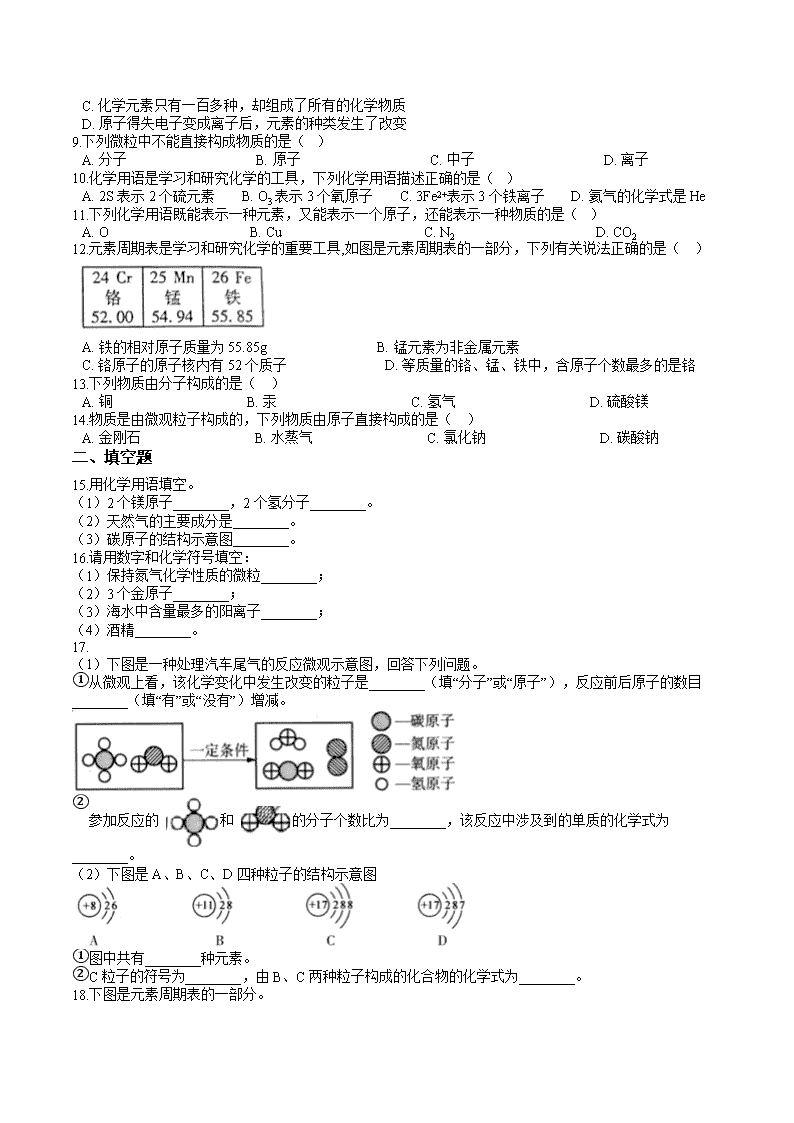
A. 实验说明浓氨水易挥发 B. 实验说明分子不断运动
C. 烧杯A中溶液变红,说明显碱性 D. 烧杯B中溶液的pH逐渐变大
3.杜甫的绝句《沙暖睡鸳鸯》中写到“迟日近山丽,春风花草香”诗中描写的情景用化学原理解释正确的是( )
A. 分子很小,但分子有一定的质量 B. 分子很小,但分子之间有间隙
C. 分子很小,但分子在不停地运动着 D. 分子很小,但分子是由原子构成的
4.如图是某原子的结构示意图和对应元素在元素周期表中的信息。下列说法错误的是( )
A. x为13 B. 该原子易失去电子 C. 该元素为非金属元素 D. 该元素位于元素周期表的第三周期
5.制造北斗三号卫星使用了钛合金材料,钛原子的质子数为22,相对原子质量为48,则钛原子的核外电子数为( )
A. 22 B. 48 C. 70 D. 26
6.下列因果关系错误的是( )
A. 因为分子构成不同,所以水和过氧化氢的化学性质不同
B. 因为质子数不同,所以碳原子和氮原子所属的元素种类不同
C. 因为碳原子排列方式不同,所以金刚石和石墨的性质完全不同
D. 因为电子层数及最外层电子数不同,所以钠原子 和钠离子 的化学性质不同
7.在原子中,能决定元素种类的是( )
A. 电子层数 B. 质子数 C. 中子数 D. 核外电子数
8.下列关于物质组成与构成的说法,错误的是( )
A. 原子中核外电子,特别是最外层电子,是决定原子构成物质的关键因素
B. 原子在分子中的配置(原子的种类、数量和排列方式)决定了分子的种类
C. 化学元素只有一百多种,却组成了所有的化学物质
D. 原子得失电子变成离子后,元素的种类发生了改变
9.下列微粒中不能直接构成物质的是( )
A. 分子 B. 原子 C. 中子 D. 离子
10.化学用语是学习和研究化学的工具,下列化学用语描述正确的是( )
A. 2S表示2个硫元素 B. O3表示3个氧原子 C. 3Fe2+表示3个铁离子 D. 氦气的化学式是He
11.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )
A. O B. Cu C. N2 D. CO2
12.元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分,下列有关说法正确的是( )
A. 铁的相对原子质量为55.85g B. 锰元素为非金属元素
C. 铬原子的原子核内有52个质子 D. 等质量的铬、锰、铁中,含原子个数最多的是铬
13.下列物质由分子构成的是( )
A. 铜 B. 汞 C. 氢气 D. 硫酸镁
14.物质是由微观粒子构成的,下列物质由原子直接构成的是( )
A. 金刚石 B. 水蒸气 C. 氯化钠 D. 碳酸钠
二、填空题
15.用化学用语填空。
(1)2个镁原子________,2个氢分子________。
(2)天然气的主要成分是________。
(3)碳原子的结构示意图________。
16.请用数字和化学符号填空:
(1)保持氮气化学性质的微粒________;
(2)3个金原子________;
(3)海水中含量最多的阳离子________;
(4)酒精________。
17.
(1)下图是一种处理汽车尾气的反应微观示意图,回答下列问题。
①从微观上看,该化学变化中发生改变的粒子是________(填“分子”或“原子”),反应前后原子的数目________(填“有”或“没有”)增减。
②参加反应的 和 的分子个数比为________,该反应中涉及到的单质的化学式为________。
(2)下图是A、B、C、D四种粒子的结构示意图
①图中共有________种元素。
②C粒子的符号为________,由B、C两种粒子构成的化合物的化学式为________。
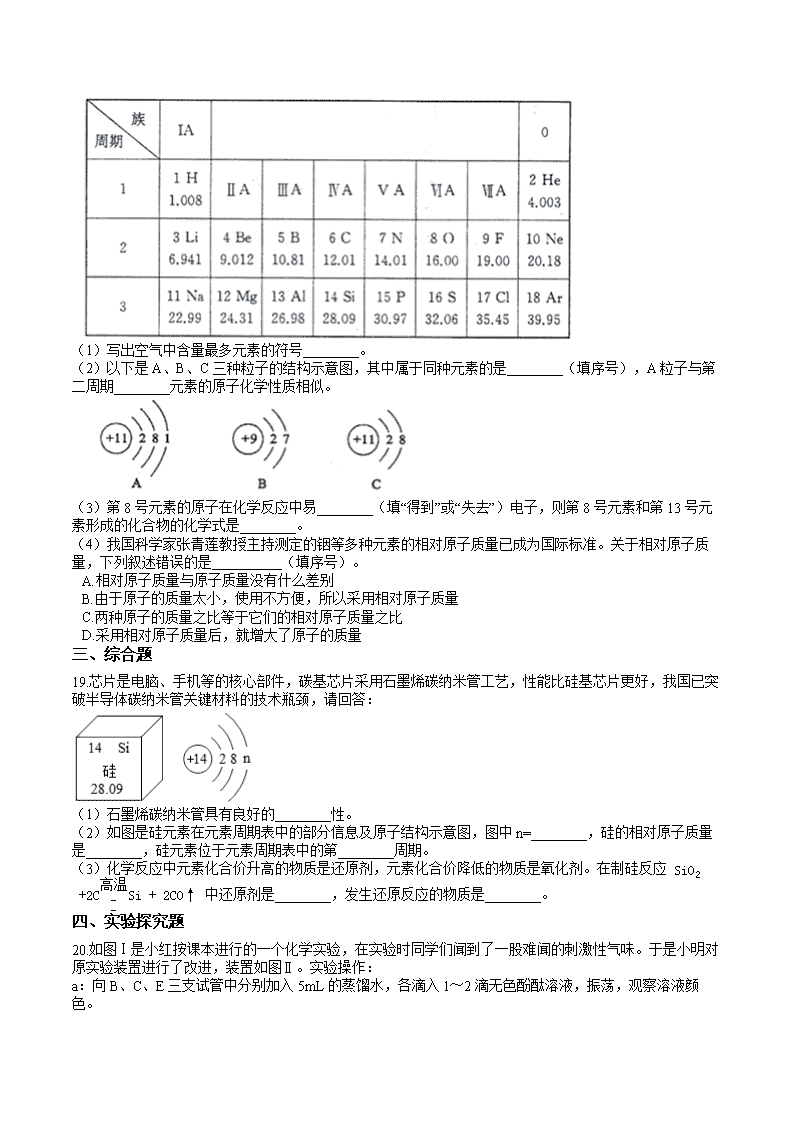
18.下图是元素周期表的一部分。
(1)写出空气中含量最多元素的符号________。
(2)以下是A、B、C三种粒子的结构示意图,其中属于同种元素的是________(填序号),A粒子与第二周期________元素的原子化学性质相似。
(3)第8号元素的原子在化学反应中易________(填“得到”或“失去”)电子,则第8号元素和第13号元素形成的化合物的化学式是________。
(4)我国科学家张青莲教授主持测定的铟等多种元素的相对原子质量已成为国际标准。关于相对原子质量,下列叙述错误的是__________(填序号)。
A.相对原子质量与原子质量没有什么差别
B.由于原子的质量太小,使用不方便,所以采用相对原子质量
C.两种原子的质量之比等于它们的相对原子质量之比
D.采用相对原子质量后,就增大了原子的质量
三、综合题
19.芯片是电脑、手机等的核心部件,碳基芯片采用石墨烯碳纳米管工艺,性能比硅基芯片更好,我国已突破半导体碳纳米管关键材料的技术瓶颈,请回答:
(1)石墨烯碳纳米管具有良好的________性。
(2)如图是硅元素在元素周期表中的部分信息及原子结构示意图,图中n=________,硅的相对原子质量是________,硅元素位于元素周期表中的第________周期。
(3)化学反应中元素化合价升高的物质是还原剂,元素化合价降低的物质是氧化剂。在制硅反应 SiO2+2C高温__Si+2CO↑ 中还原剂是________,发生还原反应的物质是________。
四、实验探究题
20.如图Ⅰ是小红按课本进行的一个化学实验,在实验时同学们闻到了一股难闻的刺激性气味。于是小明对原实验装置进行了改进,装置如图Ⅱ。实验操作:
a:向B、C、E三支试管中分别加入5mL的蒸馏水,各滴入1~2滴无色酚酞溶液,振荡,观察溶液颜色。
b:在A、D试管中分别加入2mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察几分钟,分析讨论:
(1)E试管放有酚酞溶液的目的是________
(2)进行操作b后观察到的现象是________试管内溶液先变红。
(3)由此可以得出的实验结论是①________;②________。
(4)对比改进前的实验,改进后实验的优点是________
答案解析部分
一、单选题
1.【答案】 D
【解析】【解答】将方便面从衡阳带到西藏,西藏属于高原地区,气压低,故饼干包装袋内气体分子间间隔变大,而饼干的体积、气体分子的体积和个数不会变化。
故答案为:D。
【分析】根据分子间存在间隔分析。
2.【答案】 D
【解析】【解答】A. A中溶液变红色是因为氨水具有挥发性,挥发出来的氨气进入酚酞溶液形成氨水,氨水显碱性使酚酞变红,实验说明浓氨水易挥发,故说法正确,不符合题意。
B. 氨水具有挥发性,是因为分子是不断运动的,实验说明分子不断运动,故说法正确,不符合题意。
C. 酚酞遇碱性溶液变红,烧杯A中溶液变红,说明显碱性,故说法正确,不符合题意。
D. 浓氨水具有挥发性,氨水挥发,B溶液碱性减弱,pH减小,故说法错误,符合题意。
故答案为:D。
【分析】氨水具有挥发性,会挥发出氨气。
氨水显碱性,碱性溶液能使无色酚酞试液变红色。
碱性减弱,pH值减小。
3.【答案】 C
【解析】【解答】“迟日近山丽,春风花草香”的意思春天的江河山川非常明丽,春风里到处弥漫着花草的香味。闻到香味是由于分子很小,分子是不断运动的,物质通过分子的运动,散发气味。与分子的构成,质量、间隔无关,
故答案为:C。
【分析】花香分子在不断的无规则运动,被人的鼻子捕捉到,就闻到了花香。
4.【答案】 C
【解析】【解答】A.原子序数为13的元素是铝元素,铝原子核内质子数为13,此选项不符合题意;
B.铝原子最外层有3个电子,易失去电子,此选项不符合题意;
C.由“金”字旁可知,铝元素为金属元素,此选项符合题意;
D.原子核外有几个电子层,元素就位于第几周期,铝原子核外有3个电子层,所以铝元素位于元素周期表的第三周期,此选项不符合题意。
故答案为:C。
【分析】从元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量;原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层,最外层电子数大于4则易得电子,从而形成阴离子,最外层电子数小于4则易失电子,形成阳离子。
5.【答案】 A
【解析】【解答】质子数=原子的核外电子数=22。
故答案为:A。
【分析】根据原子中质子数=原子的核外电子数分析。
6.【答案】 C
【解析】【解答】A、分子是保持物质化学性质的最小微粒,因此,分子构成不同,水和过氧化氢的化学性质不同,符合题意。
B、元素是具有相同核电荷数(即质子数)同一类原子的总称。质子数不同,碳原子和氮原子所属的元素种类不同,符合题意。
C、因为碳原子排列方式不同,所以金刚石和石墨的物理性质不同,化学性质相近,符合题意。
D、微粒的化学性质与最外层电子数关系密切。电子层数及最外层电子数不同,钠原子 和钠离子 的化学性质不同,符合题意。
故答案为:C。
【分析】A、根据物质的结构决定物质的性质分析
B、根据元素的概念分析
C、根据碳单质的原子排列分析
D、根据决定元素化学性质的是最外层电子数分析
7.【答案】 B
【解析】【解答】元素是质子数相同的一类原子的总称,故在原子中,能决定元素种类的是质子数。
故答案为:B。
【分析】根据元素的概念分析
8.【答案】 D
【解析】【解答】A、原子中核外电子,特别是最外层电子,决定原子化学性质,是决定原子构成物质的关键因素,说法不符合题意。
B、原子在分子中的配置(原子的种类、数量和排列方式)决定了分子的种类,说法不符合题意。
C、组成和结构不同,物质种类不同,化学元素只有一百多种,却组成了所有的化学物质,说法不符合题意。
D、元素的种类是由原子核内质子数决定。原子得失电子变成离子后,核内的质子数没有改变,元素的种类没有发生改变,符合题意。
故答案为:D。
【分析】A、根据决定元素化学性质的是最外层电子数分析
B、根据元素的概念分析
C、根据物质是由元素组成的分析
D、根据元素的概念分析
9.【答案】 C
【解析】【解答】分子、原子、离子都可以直接构成物质,中子不能直接构成物质;
故答案为:C。
【分析】构成物质的粒子有分子、原子、离子。
10.【答案】 D
【解析】【解答】A、“2S”表示两个硫原子而不是硫元素,不符合题意。
B、O3代表一个臭氧分子中有3个氧原子,而不是表示3个氧原子,不符合题意。
C、3Fe2+表示3个亚铁离子,而不是铁离子,不符合题意。
D、氦气的化学式是He,符合题意。
故答案为:D。
【分析】A、根据元素只讲种类不讲个数分析
B、根据化学式中的数字表示原子个数分析
C、根据铁离子带三个单位正电荷分析
D、根据稀有气体直接用元素符号表示分析
11.【答案】 B
【解析】【解答】元素符号能表示一种元素,还能表示该元素的一个原子;化学式能表示一种物质,当元素符号又是化学式时,就同时具备了上述三层意义。A、O属于气态非金属元素,可表示氧元素,表示一个氧原子,但不能表示一种物质,不符合题意。
B、Cu属于金属元素,可表示铜元素,表示一个铜原子,还能表示铜这一纯净物,符合题意。
C、该符号是氮气的化学式,不是元素符号,不符合题意。
D、该符号是二氧化碳的化学式,不是元素符号,不符合题意。
故答案为:B。
【分析】根据元素符号的含义进行分析解答,金属、固体非金属、稀有气体都是由原子直接构成的,故它们的元素符号,既能表示一个原子,又能表示一种元素,还能表示一种物质。本题主要考查元素符号、化学式等化学符号的意义,元素符号表示一种元素和一个原子,化学式表示一种物质,并记住特例方可符合题意解答。
12.【答案】 D
【解析】【解答】A、在元素周期表中,元素名称下方的数字表示相对原子质量,故铁的相对原子质量为55.85,相对原子质量是一个比值,单位为“1”,常省略不写,不符合题意;
B、由“金”字旁可知,锰元素为金属元素,不符合题意;
C、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数=24,不符合题意;
D、相对原子质量反应了原子的实际质量,相对原子质量越大,原子的实际质量越大,由图可知,相对原子质量:铬<锰<铁,故等质量的铬、锰、铁中,含原子个数最多的是铬,符合题意。
故答案为:D。
【分析】A、根据相对原子质量是比值单位为“1”分析;
B、根据带“钅”的元素为金属元素分析;
C、根据原子中质子数=原子序数分析;
D、根据等质量金属中相对原子质量越小则原子个数越多分析。
13.【答案】 C
【解析】【解答】A. 铜由铜原子构成,故不符合题意;
B. 汞由汞原子构成,故不符合题意;
C. 氢气由氢分子构成,故符合题意;
D. 硫酸镁由镁离子和硫酸根离子构成,故不符合题意。
故答案为:C。
【分析】一般情况下,金属单质、固态非金属单质和稀有气体都是由原子直接构成;大部分盐、碱和活泼金属氧化物都是由离子直接构成;其余物质,都有分子直接构成。
14.【答案】 A
【解析】【解答】A、金刚石是由碳原子直接构成,符合题意。
B、水蒸气是由水分子直接构成,不符合题意。
C、氯化钠是由氯离子和钠离子构成,不符合题意。
D、碳酸钠是由钠离子和碳酸根离子构成的,不符合题意。
故答案为:A。
【分析】金属单质、固态非金属单质和稀有气体单质都是由原子直接构成的分析
二、填空题
15.【答案】 (1)2Mg;2H2
(2)CH4
(3)
【解析】【解答】(1)原子通常用元素符号表示,多个原子就是在元素符号前面加上相应的数字,故2个镁原子表示为:2Mg;分子通常用化学式表示,多个分子就是在化学式前面加上相应的数字,故2个氢分子表示为:2H2;
(2)天然气的主要成分是甲烷,甲烷的化学式为:CH4;
(3)碳原子是6号元素,原子的核内质子数=原子序数=原子的核外电子数=6,核外电子排布,第一层通常是2个电子,则第二层是4个电子,故碳原子的结构示意图为: 。
【分析】(1)元素符号前面有数字,表示多个原子。
化学式前面有数字,表示多个分子。
(2)根据甲烷的化学式,进行分析。
(3)根据原子的结构示意图的画法,进行分析。
16.【答案】 (1)N2
(2)3Au
(3)Na+
(4)C2H5OH 或 C2H6O
【解析】【解答】(1)分子是保持物质化学性质的最小粒子,保持氮气化学性质的微粒是氮分子,符号为 N2 ;
(2)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,所以3个金原子表示为3Au;
(3)在海水中,含量靠前的元素种类排序为:氧、氢、氯、钠、镁、硫、钙,但水电离出的氢离子和氢氧根离子较少,所以海水中含量最多的阳离子是钠离子,符号为 Na+ ;
(4)酒精是乙醇的俗称,化学式为 C2H5OH 或 C2H6O 。
【分析】(1)分子是保持物质化学性质的最小粒子。
(2)元素符号前有数字,表示多个该原子。
(3)根据在海水中,含量靠前的元素种类排序为:氧、氢、氯、钠、镁、硫、钙,进行分析。
(4)根据酒精的化学式,进行分析。
17.【答案】 (1)分子;没有;1:2;N2
(2)3;Cl-;NaCl
【解析】【解答】(1)①化学变化中最小的微粒是原子,原子在化学变化中不发生变化,因此该化学变化中发生改变的粒子是分子,反应前后原子的数目没有增减;根据图示反应②为 CH4+2NO2一定条件__N2+CO2+2H2O ,因此参加反应的甲烷和二氧化氮的分子个数比为1:2;该反应中涉及到的单质的化学式为N2;(2)①质子数相同的为同一种元素,因此图中共有3种元素;C粒子的质子数为17,是氯元素,核内17个质子,核外18个电子,带一个单位的负电荷,因此符号为Cl-;②B是Na+ , 因此B、C两种粒子构成的化合物的化学式为NaCl。
【分析】(1)根据具体的原子结合反应的方程式进行分析
(2)根据元素是具有相同质子数或核电荷数的同一类原子的总称、原子得失电子形成的离子分析
18.【答案】 (1)N
(2)AC;Li
(3)得到;Al2O3
(4)A,D
【解析】【解答】(1)空气中含量最多的气体是氮气,由氮元素组成,氮元素的符号为N;(2)质子数决定元素的种类,属于同种元素的是AC;原子的最外层电子数相同,化学性质相似,A粒子与第二周期Li元素的原子化学性质相似;(3)第8号元素的原子是氧原子,它原子的最外层电子数是6,在化学反应中易得到电子;第8号元素是氧,常显-2价,第13号元素是铝,常显+3价,形成的化合物的化学式是Al2O3;(4)A、相对原子质量是一个比值,单位是“1”,不写出,原子质量的单位是g,正确;
B、由于原子的质量太小,使用不方便,所以采用相对原子质量,不正确;
C、原子的相对原子质量与原子的质量成正比,两种原子的质量之比等于它们的相对原子质量之比,不正确;
D、相对原子质量是一个比值,采用相对原子质量后,并没有增大原子的质量,正确。
故答案为:AD。
【分析】(1)根据空气中各气体的含量进行分析
(2)根据原子结构示意图的含义进行分析
(3)根据元素的原子最外层电子数小于4时失去电子分析
(4)根据相对原子质量的概念分析
三、综合题
19.【答案】 (1)导电
(2)4;28.09;三
(3)C;SiO2
【解析】【解答】(1)根据题意可知,石墨烯碳纳米管具有良好的导电性。
(2)如图是硅元素在元素周期表中的部分信息及原子结构示意图,原子中质子数=核外电子数,图中n=14-8-2=4,硅的相对原子质量是28.09,硅元素核外有三个电子层,位于元素周期表中的第三周期。
(3)化学反应中元素化合价升高的物质是还原剂,元素化合价降低的物质是氧化剂,在制硅反应 SiO2+2C高温__Si+2CO↑ 中,碳的化合价由0价升高为+2价,故还原剂是C, SiO2 中硅元素化合价由+4价降为0价,故发生还原反应的物质是 SiO2 。
【分析】(1)根据题意可知,分析石墨烯碳纳米管的性质。
(2)在原子中,质子数=核外电子数。
根据元素周期表,汉字下面的数字表示相对原子质量。
原子的核外电子层数=元素周期数。
(3)根据在化学反应中,反应后元素化合价升高的物质是还原剂,反应后元素化合价降低的物质是氧化剂,进行分析。
四、实验探究题
20.【答案】 (1)进行对比
(2)B试管中的酚酞溶液慢慢变红色,C试管中的酚酞溶液很快变红色
(3)分子是客观存在,并总在不断运动的;温度越高,分子运动速度越快
(4)能尽量防止氨气逸出,更能体验化学变化的过程;能够说明温度对分子运动的快慢的影响等
【解析】【解答】:(1)酚酞试液本身为无色,而当遇碱液时变红,单独放只盛有酚酞试液的试管,是想说明氨水能使酚酞试液变红,起到一个对比的作用,故答案为:进行对比;
(2)A试管为常温,D试管为高温,温度不一样,分子的运动速度就不一样,故答案为:B试管中的酚酞溶液慢慢变红色,C试管中的酚酞溶液很快变红色。
(3)根据实验现象可以得出本题答案为:①分子是客观存在,并总在不断运动的,②温度越高,分子运动速度越快。
(4)改进前能闻到刺激性气味,是因为装置气密性不好,且同一温度下不能说明影响分子的运动快慢的因素,而改进后的装置则解决了这个问题,所以本题的答案为:能尽量防止氨气逸出,更能体验化学变化的过程;能够说明温度对分子运动的快慢的影响等。
【分析】构成物质的微粒在不停的运动,微粒之间有间隙。常用的酸碱指示及有紫色石蕊和酚酞,石蕊遇酸变红遇碱变蓝,酚酞遇酸不变色,遇碱变红。
相关文档
- 中考化学复习分类专项精讲精练十讲2021-11-1026页
- 必备中考数学专题复习课件第二部分2021-11-1019页
- 江苏省南京市2018年中考历史试题(wo2021-11-107页
- 2012中考化学复习精品 燃料和热量2021-11-103页
- 2017年湖北省咸宁市中考数学试卷2021-11-1033页
- 2009年北京市崇文区中考数学二模试2021-11-1013页
- 中考物理第6次模拟测试卷及答案解2021-11-1011页
- 2018年甘肃省张掖市中考数学试卷含2021-11-1026页
- 黑龙江省部分地区2020年中考语文解2021-11-1010页
- 2019年广西梧州市中考数学试卷2021-11-1024页