- 407.50 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
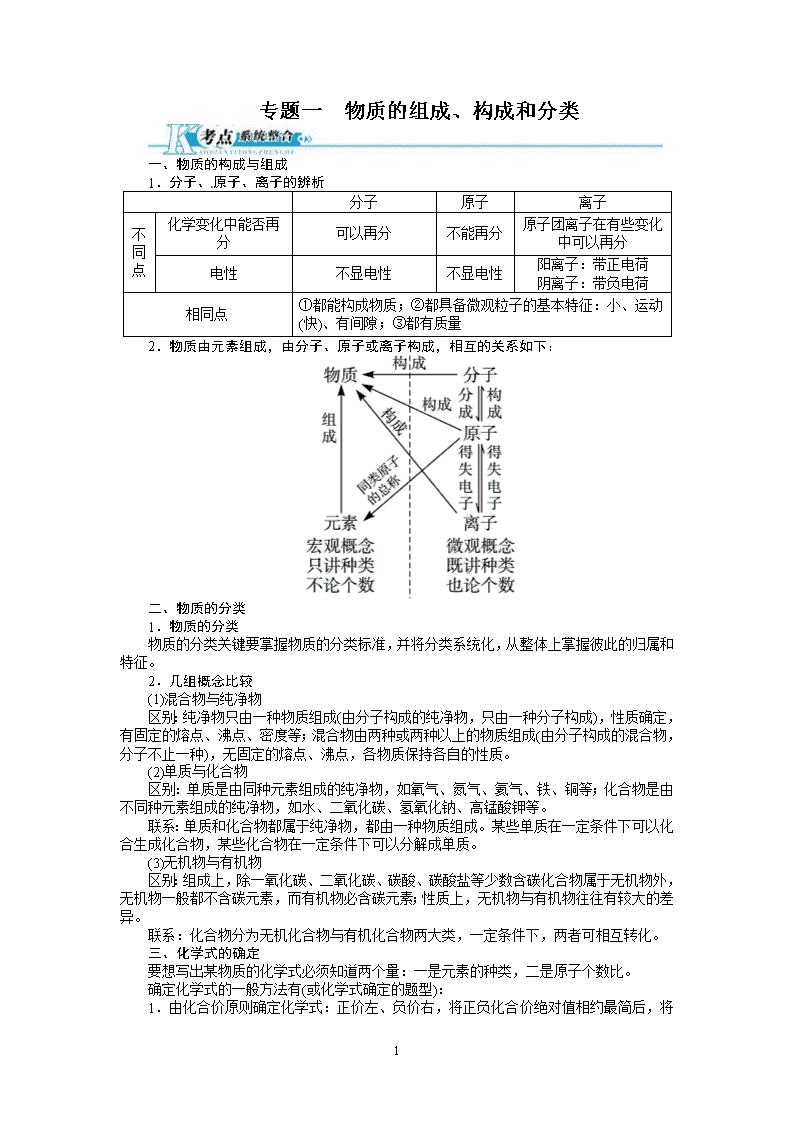
专题一 物质的组成、构成和分类
一、物质的构成与组成
1.分子、原子、离子的辨析
分子 原子 离子
不
同
点
化学变化中能否再
分 可以再分 不能再分 原子团离子在有些变化
中可以再分
电性 不显电性 不显电性 阳离子:带正电荷
阴离子:带负电荷
相同点 ①都能构成物质;②都具备微观粒子的基本特征:小、运动
(快)、有间隙;③都有质量
2.物质由元素组成,由分子、原子或离子构成,相互的关系如下:
二、物质的分类
1.物质的分类
物质的分类关键要掌握物质的分类标准,并将分类系统化,从整体上掌握彼此的归属和
特征。
2.几组概念比较
(1)混合物与纯净物
区别:纯净物只由一种物质组成(由分子构成的纯净物,只由一种分子构成),性质确定,
有固定的熔点、沸点、密度等;混合物由两种或两种以上的物质组成(由分子构成的混合物,
分子不止一种),无固定的熔点、沸点,各物质保持各自的性质。
(2)单质与化合物
区别:单质是由同种元素组成的纯净物,如氧气、氮气、氦气、铁、铜等;化合物是由
不同种元素组成的纯净物,如水、二氧化碳、氢氧化钠、高锰酸钾等。
联系:单质和化合物都属于纯净物,都由一种物质组成。某些单质在一定条件下可以化
合生成化合物,某些化合物在一定条件下可以分解成单质。
(3)无机物与有机物
区别:组成上,除一氧化碳、二氧化碳、碳酸、碳酸盐等少数含碳化合物属于无机物外,
无机物一般都不含碳元素,而有机物必含碳元素;性质上,无机物与有机物往往有较大的差
异。
联系:化合物分为无机化合物与有机化合物两大类,一定条件下,两者可相互转化。
三、化学式的确定
要想写出某物质的化学式必须知道两个量:一是元素的种类,二是原子个数比。
确定化学式的一般方法有(或化学式确定的题型):
1.由化合价原则确定化学式:正价左、负价右,将正负化合价绝对值相约最简后,将
2
其交叉写在元素符号或原子团右下角。
2.由元素质量比确定原子个数比,根据相对分子质量确定化学式。
3.由化学方程式或质量守恒定律,计算原子个数,确定化学式。
4.由物质中某元素的质量分数的大小确定物质的化学式、据化合价来确定化学式。
四、元素化合价判断的方法
化合价判断的原则是化合物中各元素正、负化合价的代数和等于零,常见的元素化合价
的判断方法:
1.根据化学式求元素的化合价;
2.根据根(或原子团)的化合价求其中某一元素的化合价。
五、化学式计算的总思路
a 类计算是化学式的基本计算。即由化学式计算相对分子质量、化合物中各元素的质量
比或某元素的质量分数。
b 类计算是化学式计算的逆运算。如由化合物中元素的质量比或质量分数,求元素的原
子个数比,进而确定化学式;或由相对分子质量计算化合物中未知元素的相对原子质量,由
化合物中某元素的质量分数计算未知元素的相对原子质量,进一步确定该未知元素,从而得
到化学式。
考向一 物质的组成与构成
【例 1】 过氧化氢(H2O2)是隐形眼镜洗液的主要成分,下列说法正确的是( )。
A.它是由氢气和氧气组成的
B.它是由氢元素和氧元素组成的
C.它是由两个氢原子和两个氧原子组成的
D.它是由两个氢元素和两个氧元素组成的
解析:过氧化氢是纯净物,由一种物质组成,不可能是氢气和氧气的混合物;构成过氧
化氢的基本粒子是过氧化氢分子,一个过氧化氢分子是由两个氢原子和两个氧原子构成的;
元素只讲种类,不讲个数,故正确答案为 B 项。
答案:B
方法归纳 解答此类题目,应从元素的角度进行回答,并且要注意元素是宏观概念,只
讲种类,不讲个数。
考向二 物质的分类
【例 2】 分类是化学研究常用的方法。下列对物质分类正确的是( )。
A.氧气(O2)和水(H2O)都属于氧化物
B.氧气(O2)和臭氧(O3)都属于单质
C.碳酸钙(CaCO3)和甲烷(CH4)都属于有机物
D.火碱(NaOH)和纯碱(Na2CO3)都属于碱
解析:A 项中氧气是单质;C 项中碳酸钙属于无机物;D 项中纯碱属于盐;B 项中氧气
和臭氧都属于单质。
答案:B
方法归纳 解此类题目一定要弄清分类标准,以及各类物质的含义。
考向三 化学式的计算
【例 3】 已知 Na2S、Na2SO3、Na2SO4 的混合物中硫元素的质量分数为 32%,则混合物
中氧元素的质量分数为( )。
A.32% B.22% C.40% D.无法计算
解析:在 Na2S、Na2SO3、Na2SO4 中 Na、S 原子个数比是恒定的,都是 2∶1,其质量
3
比为 46∶32。设混合物中钠元素的质量分数为 x,则
2Na ~ S
46 32
x 32%
46
32
= x
32%
,解得 x=46%。
混合物中氧元素的质量分数:1-32%-46%=22%。
答案:B
方法归纳 比例守恒的思想是指在给出的化学式中某几种原子个数比是恒定的,解此类
题目的关键是:利用化学式中恒定的原子个数比求出各元素的质量比。
1.从下列图片中不能获取的信息是( )。
A.分子之间有间隔 B.硅原子是由原子核和电子构成的
C.受热水分子运动速率加快 D.构成物质的粒子有分子、原子和离子
2.下图是电解水的微观模型示意图,从中获得信息错误..的是( )。
A.两种生成物的分子个数比为 2∶1
B.生成物中有一种化合物和一种单质
C.反应前后原子的种类和数目没有变化
D.化学反应中,分子分为原子,原子不能再分
3.下图为物质的分类关系,①与②是并列关系,③包含在②中,若②是纯净物,则③
不可能是( )。
A.一氧化碳 B.硫酸铜 C.空气 D.铜
4.如图为元素周期表的一部分,下列有关说法中,错误的是( )。
4
A.氮原子的质子数为 7 B.氧的相对原子质量为 16.00
C.碳元素只能组成一种单质 D.碳、氮、氧三种元素的原子序数依次增加
5.实验室用氯酸钾和二氧化锰制取氧气,加热一段时间后剩余固体混合物 10 g,继续
加热至完全反应后固体变为 9.04 g,再将固体加水充分溶解、过滤、干燥得到 1.59 g 黑色固
体。求 10 g 剩余固体混合物中氯元素的质量分数为( )。
A.7.1% B.35.5% C.28.4% D.42.6%
6.用化学用语填空:
(1)银__________;(2)4 个二氧化硫分子__________;(3)2 个铝离子__________;(4)高
锰酸钾__________;(5)+5 价的氮元素__________;(6)由 Ca2+和 H2PO -
4 构成的磷酸二氢钙
__________。
7.M 元素的一种微粒的结构示意图为 ,已知:
(1)M 元素的单质是空气的重要组成部分,约占空气总体积的 1/5,则 x=________。
(2)M 元素与下列选项中________(填序号)元素不能形成化合物。
8.请用线段 连接有对应关系的相邻两列间的点。
9.用微粒的观点回答下列问题:
(1)保持水的化学性质的微粒是________。
(2)水通电分解过程中,不变的微粒是________。
(3)用湿抹布擦过的桌面,一段时间后变干的原因是____________________。
(4)一定质量的水蒸气冷凝成水时,其体积变小的原因是____________________。
10.人类对原子结构的认识永无止境。
(1)道尔顿认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面
包”,如今这些观点均________(填“正确” 或“错误”),卢瑟福进行α粒子散射实验后,
认为原子是“行星模型”,即原子是由带________电荷的原子核和核外电子构成的。
5
(2)下图是元素周期表的一部分(数字表示相应元素的原子序数)。表中部分元素的原子
(离子)结构示意图如下,其中属于阳离子的是________(填数字序号)。
选用表中元素填空:
A2B2 型化合物的化学式是________,带一个单位负电荷的一种阴离子是________。某
耐火材料是由 Mg 元素、O 元素组成的化合物,写出其化学式________。
11.在化学晚会上,冬冬 同学表演了一个小魔术,他将两个“空瓶”中间的毛玻璃片
抽去,两瓶均由瓶口向瓶底逐渐充满红棕色气体,其奥秘如图所示。
请从微观角度解释魔术中产生上述现象的原因_______________________________。
12.下图是诺氟沙星胶囊的说明书,某患者遵医嘱,每次服用诺氟沙星胶囊 400 mg,
一段时间后病情有了好转。请回答以下问题:
诺氟沙星胶囊
主要成分:诺氟沙星
(化学式为 C16H18FN3O3)
相对分子质量:319
规格:每粒 0.1 g 一日 2 次,10 日一个疗程
贮存:避光,密封保存)
(1)诺氟沙星分子中碳、氢的原子个数比为__________。
(2)诺氟沙星中氮元素的质量分数是______________(精确到 0.1%)。
(3)从组成上可知诺氟沙星属于______________(填“有机化合物”或“无机化合物”);
患者一个疗程共服用了________粒诺氟沙星胶囊。
参考答案
专题提升演练
1.B 苯分子图像说明了分子之间有间隔;水受热蒸发,说明了受热时水分子运动速
率加快;苯分子图像、硅原子构成的文字、氯化钠晶体模型说明了构成物质的粒子有分子、
原子和离子;硅原子是由原子核和电子构成的在 图片中不能体现,故 B 项所述信息无法获
取。
2.B 由图示可知,生成物都是由一种元素组成的纯净物,是单质。
3.C 由图示可知①表示混合物,②表示纯净物,③包含在②中,③可以是单质、化
合物,故③不可能是空气。
4.C 碳元素可组成多种单质,如金刚石、石墨等,故 C 不正确。
5.B 完全反应后固体为 KCl 和 MnO2,其中 MnO2 的质量为 1.59 g,故 KCl 的质量为
6
9.04 g-1.59 g=7.45 g,氯元素的质量分数=
7.45 g×(35.5
74.5
×100%)
10 g
×100%=35.5%。
6.答案:(1)Ag (2)4SO2 (3)2Al3+ (4)KMnO4 (5)N
+5
(6)Ca(H2PO4)
2
7.答案:(1)8 (2)①
解析:M 元素的单质约占空气体积的 1/5,M 元素是氧元素,氧原子的核内质子数为 8,
核电荷数也为 8;①所表示元素为氖元素是稀有气体元素,氧元素不能与它形成化合物。
8.答案:
解析:铜是紫红色固体,属于单质;Cu(OH)2 是蓝色絮状物,属于碱;HNO3 是挥发
性液体,属于酸;CuO 是黑色粉末,属于氧化物;Cu2(OH)2CO3 是绿色粉末,属于盐。
9.答案:(1)水分子
(2)氢原子和氧原子
(3)水分子是不断运动的,水分子扩散到空气中去了
(4)分子间间隔变小
解析:(1)分子是保持物质化学性质的最小粒子;(2)原子在化学变化中的种类、数目
和质量都不变;(3)分子的不断运动使水分子扩散到空气中,故变干;(4)由水蒸气冷凝
成水时,水分子间的间隔变小。
10.答案:(1)错误 正 (2)② H2O2 Cl- MgO
解析:(1)结合对原子的认识可知,原子是由居于原子中心的原子核和核外电子构成,
因而不是一实心球体,也不是“嵌着葡萄干的面包”,因而题中的观点是错误的;(2)阳离
子是指带有正电荷的原子,其质子数大于核外电子数,分析三种粒子的结构可知,只有②符
合这一特点;在书写符合条件的化学式时,可以联系所学的有关物质的化学式,选用表中元
素完成,如 H2O2;据镁元素和氧元素的化合价来书写其化学式为 MgO。
11.答案:分子不断运动,一氧化氮和氧气分子接触后分成原子,(每 2 个)氧原子和
(1 个)氮原子重新组合成(1 个)二氧化氮分子
解析:分子在不断地运动,一氧化氮与氧气反应生成红棕色的二氧化氮气体。从微观角
度可知:两个 NO 分子和一个 O2 分子先分成原子,然后原子重新构成两个 NO2 分子。
12.答案:(1)8∶9 (2)13.2% (3)有机化合物 80
解析:(1)由诺氟沙星的化学式为 C16H18FN3O3 可知诺氟沙星分子中碳、氢的原子个数
比为 16∶18=8∶9;(2)诺氟沙星中氮元素的质量分数=14×3
319
×100%=13.2%;(3)诺氟
沙星属于有机化合物,每次服用诺氟沙星胶囊 400 mg,每粒 0.1 g,每次服用 4 粒,一个疗
程共服用 10 日×2 次/日×4 粒/次=80 粒。
相关文档
- 中考化学总复习(人教版)综合模拟1(附2021-11-108页
- 中考化学总复习(人教版)阶段检测5(附2021-11-108页
- 中考化学总复习(人教版)精讲精练:第122021-11-1011页
- 中考化学总复习(人教版)精讲精练:专题2021-11-109页
- 中考化学总复习 专题检测题一(及答2021-11-1013页
- 中考化学总复习 练习题九(及答案)2021-11-1020页
- 中考化学总复习(人教版)精讲精练:第12021-11-1017页
- 中考化学总复习 专题检测题六(及答2021-11-1010页
- 中考化学总复习(人教版)精讲精练:第32021-11-1011页
- 中考化学总复习(人教版)综合模拟2(附2021-11-108页