- 412.50 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
专题七 图、表、线类试题
一、坐标图像题
1.特点
坐标图像题的特点是借助于数学方法中的坐标图,把多个因素对体系变化的影响,用坐
标图的形式直观地表示出来,考查学生看图、识图、发掘图形的隐含性质和相互联系的能力。
2.类型
坐标图像题的内容包括化学反应前后物质质量的变化、物质溶解时溶液的质量或溶质质
量分数的变化、溶液的 pH 的变化等。
3.解题策略
(1)抓住图像特征认真分析坐标中纵、横坐标所表示的含义,图像的起始点、转折点、
变化趋势、终点等。
(2)正确读取所需的数据或信息,弄清图像题中与曲线或直线变化的有关量的关系。
(3)认真解读题意,应用信息解答问题。
二、表格数据题
1.特点
表格数据分析题就是将物质的某组数据以表格的形式呈现。根据表格中数据提供的信息
对数据进行分析处理,从而解决问题的题型。
2.类型
主要包括给出化学反应前后的物质质量的表格数据,判断化学反应类型;根据多种物质
的 pH,判断溶液的酸碱性的强弱等;几种物质反应时,给出多次或多组物质的质量,依据
化学方程式进行计算等。
3.解题策略
(1)正确解读表格中的数据或条件,审题时挖掘出数字中隐藏的规律,再依据规律排序,
从而解决问题。
(2)若是多次或多组数据或条件,则需要通过比较、对比的方法,在比较中确定解题所
需的有用信息,寻找出系列数据中的特殊数据,分析特殊数据的特点,从特点着手设计解题
方案。
三、商标信息题
1.特点及类型
(1)利用标签中的信息(如化肥、农药、食品、药品或其他一些化学试剂),考查物质的组
成和分类。
(2)利用标签中的信息考查物质的性质。
(3)利用标签中的信息考查化学实验中的危险品的安全标志。
(4)利用标签中的信息考查有关化学式的基本计算。
2.解题策略
(1)正确解读商标信息。根据题意,从标签中找到解决问题的依据。
(2)记住常见商标中的图标及表示的意义。
四、溶解度曲线题
1.特点及类型
(1)给出某物质在不同温度时的溶解度,画出该物质的溶解度曲线。
(2)查出某物质在不同温度下的溶解度数值,并计算相应的溶质质量分数。
2
(3)比较不同物质在同一温度时的溶解度大小。
(4)确定物质溶解度受温度变化影响的大小。
(5)确定饱和溶液与不饱和溶液相互转化的措施。
(6)确定可溶性混合物分离的方法。
2.解题策略
(1)弄清楚溶解度曲线上的点、曲线的交叉点、曲线的变化趋势及涉及的“点”的位置
的意义并分析“点”的变化趋势,如果“点”左右移动与温度有关,如果竖直上、下移动,
则是恒温加减溶剂或加减溶质。
(2)根据溶解度曲线的变化趋势,可以确定该物质从溶液中获取时选择的适合方法。如
NaCl 的溶解度受温度变化影响很小,可以采取蒸发溶剂的方法获取氯化钠晶体;而 KNO3
的溶解度随温度升高明显增大,因此,可采用冷却热饱和溶液的方法获取晶体。
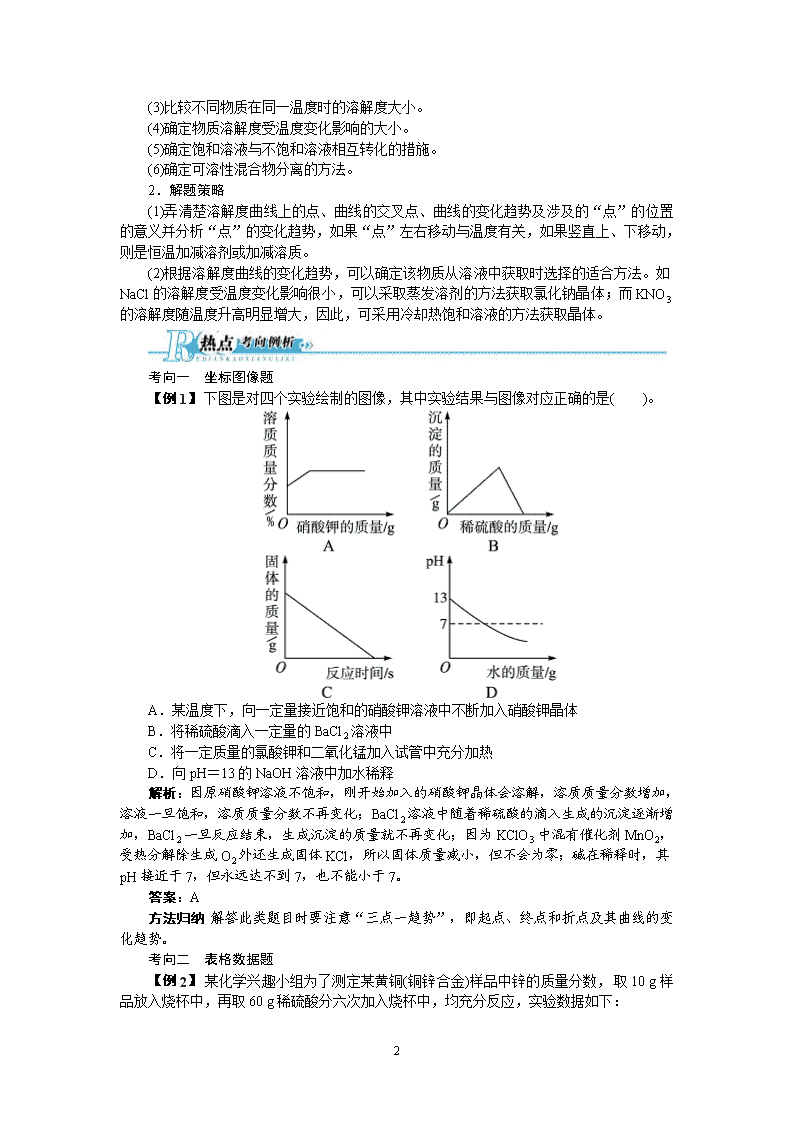
考向一 坐标图像题
【例 1】 下图是对四个实验绘制的图像,其中实验结果与图像对应正确的是( )。
A.某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B.将稀硫酸滴入一定量的 BaCl2 溶液中
C.将一定质量的氯酸钾和二氧化锰加入试管中充分加热
D.向 pH=13 的 NaOH 溶液中加水稀释
解析:因原硝酸钾溶液不饱和,刚开始加入的硝酸钾晶体会溶解,溶质质量分数增加,
溶液一旦饱和,溶质质量分数不再变化;BaCl2 溶液中随着稀硫酸的滴入生成的沉淀逐渐增
加,BaCl2 一旦反应结束,生成沉淀的质量就不再变化;因为 KClO3 中混有催化剂 MnO2,
受热分解除生成 O2 外还生成固体 KCl,所以固体质量减小,但不会为零;碱在稀释时,其
pH 接近于 7,但永远达不到 7,也不能小于 7。
答案:A
方法归纳 解答此类题目时要注意“三点一趋势”,即起点、终点和折点及其曲线的变
化趋势。
考向二 表格数据题
【例 2】 某化学兴趣小组为了测定某黄铜(铜锌合金)样品中锌的质量分数, 取 10 g 样
品放入烧杯中,再取 60 g 稀硫酸分六次加入烧杯中,均充分反应,实验数据如下:
3
第一次 第二次 第三次 第四次 第五次 第六次
加入稀硫酸
的质量/g 10 10 10 10 10 10
剩余固体的
质量/g 9.35 8.7 8.05 7.4 6.75 6.75
(1)黄铜样品中锌的质量分数为多少?(写出计算步骤,下同)
(2)所用稀硫酸的质量分数为多少?
解析:由表中数据分析可知,前五次,每加入 10 g 稀硫酸,剩余固体质量减少 0.65 g,
就是参 加反应的锌的质量,铜与硫酸不反应,第五次和第六次剩余固体质量不变,说明锌
已完全反应,铜的质量为 6.75 g,10 g 黄铜中锌的质量为(10 g-6.75 g),即可计算出样品中锌
的质量分数;根据反应锌的质量可计算出稀硫酸中溶质的质量分数。
答案:(1)由表中数据知该合金中铜的质量为 6.75 g,则锌的质量为 3.25 g,
黄铜样品中锌的质量分数为3.25 g
10 g
×100%=32.5%。
(2)设稀硫酸中溶质质量为 x
Zn + H2SO4===ZnSO4+H2↑
65 98
0.65 g x
65
0.65 g
=98
x
x=0.98 g
稀硫酸中溶质质量分数为0.98 g
10 g
×100%=9.8%。
答:略。(其他答案合理也可)
方法归纳 解答此类题目的关键是审题,再比较、分析表中数据,找出可直接或间接利
用的数据,结合相关化学方程式求解。
考向三 商标信息题
【例 3】 下图是某奶粉包装袋上的部分文字说明。
(1)这里的钙、铁、磷、锌指的是________(填“分子”“原子”或“元素”等)。
(2)这袋奶粉中含蛋白质的质量为________g。
(3)蛋白质是人体必需的重要营养物质之一。除蛋白质外,人体必需的营养物质还有
__________________(写出两种即可)。
解析:(1)标签中的钙、铁、锌等是指元素。
(2)300 g×25%=75 g。
(3)人类必需的营养物质除蛋白质外,还有糖类、油脂、维生素、水和无机盐等,任选
两种即可。但不能填葡萄糖、维生素 C 等具体的物质名称。
答案:(1)元素 (2)75 (3)糖类、油脂
考向四 溶解度曲线题
【例 4】 甲、乙两种物质的溶解度曲线如图。
4
(1)20 ℃时,甲物质的溶解度为________g;
(2)欲将 40 ℃乙物质的饱和溶液变为不饱和溶液,可采用的方法是________________;
(3)40 ℃时,将甲、乙两物质的饱和溶液各 100 g,分别降温到 20 ℃,所得甲物质溶液
的质量________(选填“>”“=”或“<”)乙物质溶液的质量。
解析:据图可知甲的溶解度随温度升高而升高,乙则是随温度升高而降低,所以乙的饱
和溶液变为不饱和溶液可采用降温的方法或直接加水;甲、乙的饱和溶液分别降温,甲有溶
质析出,溶液减少,乙变为不饱和状态,溶液的质量不变。
答案:(1)40
(2)降温或加水
(3)<
1.2012 年开始,山东省 17 地市将开展城市生活垃圾分类减量试点。废弃塑料购物袋
属于( )。
2.家庭常用洗涤剂的 pH 如下图所示,其中最接近中性的是( )。
5
3.下图表示的是单质、化合物、有机物之间的包含、不包含关系,若整个大圆圈代表
纯净物,则下图物质关系表示正确的是( )。
4.有 M、N、X、Y 四种物质,在一定条件下充分反应后,测得各物质在反应前后的
质量如下表所示:
物质 M N X Y
反应前质量/g 2 20 34 0
反应后质量/g 2 38 0 16
对该反应的下列说法中错误的是( )。
A.该反应生成的 N、Y 的质量比为 9∶8 B.该反应属于化合反应
C.该反应属于分解反应 D.M 在反应中可能作催化剂
5.下列曲线正确的是( )。
6.请仔细观察下图回答有关问题:
6
(1)过量排放二氧化碳会导致________。
(2)形成酸雨的主要气体有________(写一种)。
(3)请你就如何防止酸雨形成,提一点建议___________________________________。
7.泰安的豆腐闻名遐迩。豆腐制作是中国古代的一项重要发明,现在豆腐在全球已成
为颇受欢迎的食品,其制作的主要工艺流程通常如下:
(1)上述工艺流程中,磨浆属于________(填“物理”或“化学”)变化,由豆腐花制豆腐
的过程就是将豆腐与水分离,该过程利用的操作名称是________。
(2)豆腐中含有丰富的植物蛋白,食用豆腐能为人体提供蛋白质。蛋白质对生命活动的
重要意义是____________________________________________________________________。
(3)除大豆外,很多食物也能提供丰富的蛋白质,请你写出其中两种_________________。
8.根据下图衣服标签回答下列问题:
(1)面料中的棉属于________(填“天然”或“合成”,下同)有机高分子材料,面料中的
涤纶属于________有机高分子材料。
(2)你知道合成纤维有下列哪三个优点________(填字母)。
A.强度高、弹性好 B.耐磨
C.吸水性、透气性较好 D.耐化学腐蚀
9.(1)如图是氯化钠和硝酸钾的溶解度曲线,从图中你能得到的信息有________(只写一
条)。
7
(2)某同学做了如下两个实验。
根据如图的溶解度曲线,判断 a~f 对应的溶液中,为饱和溶液的是________。
(3)由实验 1、2 可知,使不饱和溶液转化为饱和溶液的方法有____________________。
10. 锌是人体生长发育过程中必不可少的元素,被誉为“生命之花”。葡萄糖酸锌口服
液是以葡萄糖酸锌[化学式为(C6H11O7)2Zn]为主要原料制成的保健品,具有补锌功能。请
阅读产品说明后回答:
(1)葡萄糖酸锌的相对分子质量是__________________________________________;
(2)成人保健每天需服用两支,可补锌多少毫克?
11.全国人大和政协会议使用了一种含碳酸钙的“石头纸”。为测定其中碳酸钙的含量,
课外活动小组的同学称取 50 g 碎纸样品。分别在 5 只烧杯中进行了实验,实验数据见下表(假
设纸张其他成分既不溶于水,也不与水反应):
烧杯① 烧杯② 烧杯③ 烧杯④ 烧杯⑤
加入样品的质量
/g 10 10 10 10 10
加入稀盐酸的质 10 20 30 40 50
8
量/g
充分反应后生成
气体的质量/g 0.88 1.76 X 3.52 3.52
(1)表中 X 的值为________;
(2)求样品中碳酸钙的质量分数;
(3)烧杯④中物质充分反应后所得溶液的质量为________g。
12. 为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与 10.0
g 赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全
吸收,该溶液总质量与反应时间的变化关系如下图。
(1)上述反应产生二氧化碳的质量为________g;
(2)计算该赤铁矿石中氧化铁的质量分数;
(3)若上述反应后剩余固体质量为 m 克,写出计算该赤铁矿石中氧化铁质量分数的表达
式:________(用 m 表示)。
参考答案
专题提升演练
1.B B 表示可回收物标志,废弃塑料购物袋属于可回收物品。
2.B 本题通过柱状图的形式给出了生活中常用洗涤剂的 pH,因 pH=7 的溶液呈中性,
因而只有洗发露的 pH 最接近 7。
3.C 本题通过图示形式考查对物质的分类及各类型之间关系的认识。因纯净物包括
单质、化合物,化合物包括有机化合物和无机化合物,故只有 C 符合各类物质之间的包含
关系。
4.B 在化学反应中,质量减少的为反应物,质量增多的为生成物。分析表格得到 N
增多 18 g,Y 增多 16 g,X 减少 34 g。所以该反应为 X―→N+Y,属于分解反应,生成的
N、Y 的质量比为 9∶8,M 质量没变,可能作催化剂。
5.C A 中,加水稀释盐酸,可使溶液酸度减弱趋近于中性,但不会变为碱性,即 pH
增大趋近于 7,但不会大于 7,故错误;B 中浓硫酸溶于水,放出大量的热,使溶液温度升
高,但较长时间冷却后,最后溶液温度应达到室温,不会低于室温,故错误;C 中,煅烧石
灰石,当达到一定温度时,石灰石会分解放出二氧化碳气体,固 体质量会减少,当石灰石
全部分解后,固体质量不变,故正确;D 中,随 温度升高,气体(氧气)的溶解度减小,
故错误。
6.答案:(1)温室效应 (2)SO2(合理即可) (3)减少使用化石燃料(合理即
可)
解析:目前导致“温室效应”的主要气体是 CO2,它的过量排放会导致“温室效应”;
从图示可看出产生的气体有 CO2、SO2、NO、NO2 等,形成酸雨的主要气体为氮和硫的氧化
物;从图中可看出这些气体的产生主要是大量使用化石燃料而引起的。
7.答案:(1)物理 过滤 (2)蛋白质是构成人体细胞的基础物质 (3)牛奶、鱼
或鸡蛋等
解析:(1)磨浆是将大豆粉碎的过程,没有新物质生成,属于物理变化;将不溶物与水
分离的操作为过滤操作。(2)蛋白质是构成人体细胞的基础物质,是帮助人体生长和修补身
9
体破损组织所需要的主要营养物质。(3)富含蛋白质的食品有鱼、肉、蛋、奶等。
8.答案:(1)天然 合成 (2)ABD
解析:(1)羊毛、棉花属于天然有机高分子材料;涤纶属于合成有机高分子材料;(2)
合成纤维强度高,弹性好,耐磨、耐化学腐蚀,但吸水性、透气性不好。
9.答案:(1)硝酸钾溶解度随温度的升高而增大(只要合理即可) (2)b、c、f (3)
增加溶质或改变温度
解析:(1)由溶解度曲线可知,两物质在某温度下的溶解度大小或溶解度随温度的变化
情况;两曲线的交点可表示两物质在某温度下溶解度相等;(2)20 ℃时,NaCl 的溶解度为
36.0 g,即 20 g 水中最多溶解 7.2 g NaCl,故 b、c 两溶液一定为饱和溶液;20 ℃时,KNO3
的溶解度为 31.6 g,即 20 g 水中最多溶解 6.32 g KNO3,则 d 为不饱和溶液,在 60 ℃时,
KNO3 的溶解度为 110 g,即此温度下,20 g 水中最多溶解 22 g KNO3,而此时 e 中含有溶质
的质量为 15 g+5 g=20 g,小于 22 g,即为不饱和溶液,当降温到 20 ℃时,有溶质析出,
即 f 为饱和溶液;(3)由 a→b 为增加溶质;由 e→f 为降低温度。
10.答案:(1)455 (2)7.06 mg
解析:(1)葡萄糖酸锌的相对分子质量=(12×6+1×11+16×7)×2+65=455。
(2)每 100 mL 中含锌 35.3 mg,则每 10 mL 中含锌 3.53 mg。3.53 mg×2=7.06 mg。
11.答案:(1)2.64 (2)80% (3)44.48
解析:(1)由表格数据信息知,当第二次加入 20 g 盐酸时,生成气体的质量恰好是第
一次的两倍,说明每 10 g 稀盐酸与样品反应能产生 0.88 g 气体;而第四次实验中,当加入
40 g 盐酸时,生成气体的质量 3.52 g 是 0.88 g 的 4 倍,说明第三次实验中碳酸钙仍未完全反
应,因第五次加入 50 g 盐酸时产生的气体的质量与第四次产生的气体质量相等,故第四次
实验中盐酸已反应完全,故 X 的值应是 0.88×3=2.64;(2)由上述分析可知,当碳酸钙完
全反应时,生成二氧化碳的总质量为 3.52 g,据此质量,利用碳酸钙与盐酸反应的化学方程
式,可以求出碳酸钙的质量;解题过程为:
解:设 10 g 样品中碳酸钙的质量为 x
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 3.52 g
100
44
= x
3.52 g x=8 g
此“石头纸”中碳酸钙的质量分数为: 8 g
10 g
×100%=80%。
烧杯④中,完全反应后所得溶液的总质量即为碳酸钙的质量+第四次反应中加入盐酸的
质量-生成二氧化碳的质量,即:8 g+40 g-3.52 g=44.48 g。
12.答案:(1)6.6
(2)解:设该样品中氧化铁的质量为 x。
3CO+Fe2O3 高温 2Fe+3CO2
160 3×44
x 6.6 g
160
132
= x
6.6 g
x=8.0 g
样品中氧化铁的质量分数为: 8.0 g
10.0 g
×100%=80%
答:该样品中氧化铁的质量分数为 80%。
(3)10-m
3
×100%
解析:(1)CO 与 Fe2O3 反应生成 CO2 和 Fe,CO2 被 NaOH 溶液吸收,由图示可知,溶液增
加的质量就是 CO2 的质量。(2)由 CO2 的质量,借助化学方程式 3CO+Fe2O3
高温 2Fe+3CO2
可计算出 Fe2O3 的质量,即可求出样品中氧化铁的质量分数。
相关文档
- 中考化学总复习(人教版)精讲精练:专题2021-11-106页
- 中考化学总复习(人教版)综合模拟1(附2021-11-108页
- 中考化学总复习(人教版)阶段检测5(附2021-11-108页
- 中考化学总复习(人教版)精讲精练:第122021-11-1011页
- 中考化学总复习(人教版)精讲精练:专题2021-11-109页
- 中考化学总复习 专题检测题一(及答2021-11-1013页
- 中考化学总复习 练习题九(及答案)2021-11-1020页
- 中考化学总复习(人教版)精讲精练:第12021-11-1017页
- 中考化学总复习 专题检测题六(及答2021-11-1010页
- 中考化学总复习(人教版)精讲精练:第32021-11-1011页