- 554.50 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第十单元测评
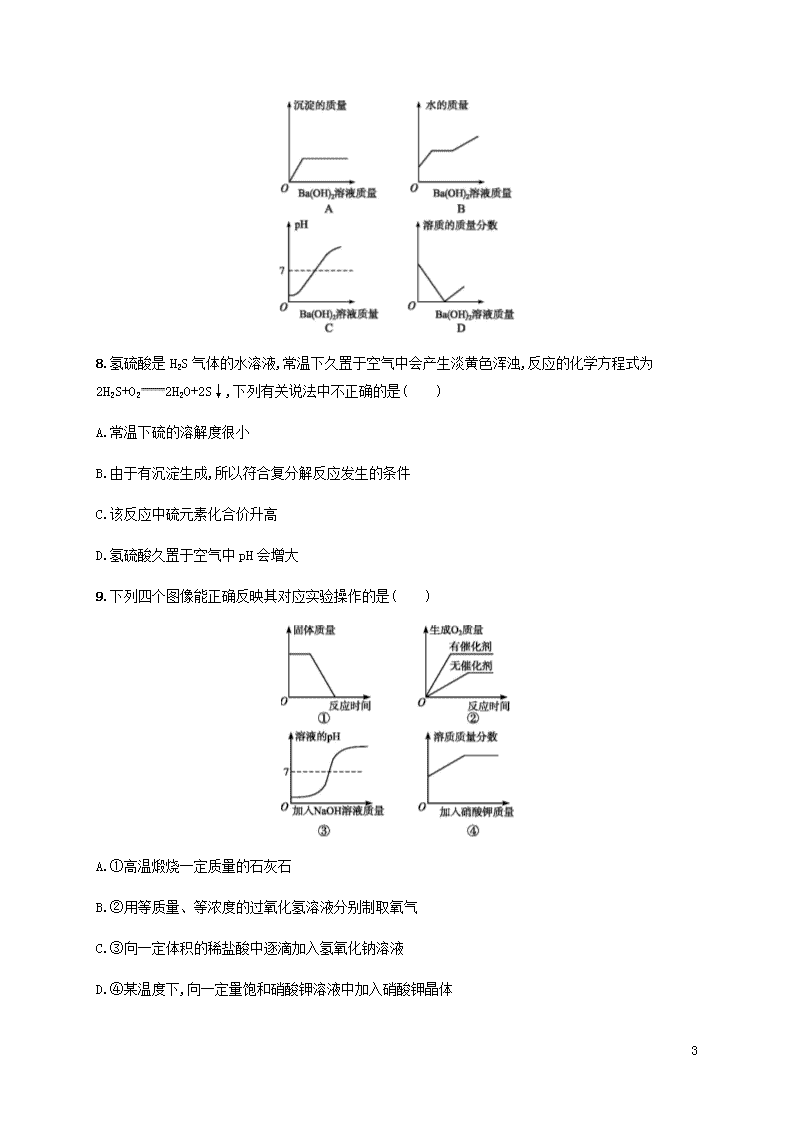
(时间:45分钟 满分:100分)
可能用到的相对原子质量:H 1 O 16 Na 23 Cl 35.5
一、快乐点击(每小题3分,共30分)
1.下列家庭小实验不能成功的是( )
A.用紫卷心菜制酸碱指示剂
B.用闻气味的方法鉴别白酒和白醋
C.用食盐水浸泡菜刀除去表面的锈斑
D.用果汁、小苏打、柠檬酸、凉开水等自制汽水
2.常温下,一些物质的pH如下,其中显酸性的物质是 ( )
A.柠檬汁 pH=2 B.鸡蛋清 pH=8
C.蒸馏水 pH=7 D.肥皂水 pH=10
3.下列对实验意外事故的处理错误的是( )
A.硫酸洒在实验台上,立即用烧碱溶液冲洗
B.实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓
11
C.酒精灯洒出的酒精在桌上燃烧,立即用湿布扑灭
D.浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上3%~5%的碳酸氢钠溶液
4.稀盐酸是化学实验中常用的试剂,但下列实验中,不宜使用稀盐酸的是( )
A.除去氯化钠溶液中的碳酸钠
B.除去铜粉中混有的铁粉
C.除去熟石灰中的石灰石
D.除去铁丝上的铁锈
5.推理是一种重要的学习方法。下列推理正确的是( )
A.碱中都含有氢氧根,所以碱中一定含有氢元素
B.分子是构成物质的微粒,因此物质都是由分子构成的
C.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应
D.铁丝能在氧气中燃烧,空气中有氧气,所以铁丝也能在空气中燃烧
6.碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )
A.能使紫色石蕊溶液变蓝色
B.能与盐酸反应生成水
C.能与Na2SO4溶液反应生成BaSO4沉淀
D.能与CO2反应生成水
7.向装有50 g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。有关量的变化情况见下图[横坐标表示Ba(OH)2溶液的质量,纵坐标表示小烧杯中量的变化]。其中肯定不正确的是( )
11
8.氢硫酸是H2S气体的水溶液,常温下久置于空气中会产生淡黄色浑浊,反应的化学方程式为2H2S+O22H2O+2S↓,下列有关说法中不正确的是( )
A.常温下硫的溶解度很小
B.由于有沉淀生成,所以符合复分解反应发生的条件
C.该反应中硫元素化合价升高
D.氢硫酸久置于空气中pH会增大
9.下列四个图像能正确反映其对应实验操作的是( )
A.①高温煅烧一定质量的石灰石
B.②用等质量、等浓度的过氧化氢溶液分别制取氧气
C.③向一定体积的稀盐酸中逐滴加入氢氧化钠溶液
D.④某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
11
10.将一个大烧杯倒扣在培养皿上,培养皿上所放物质如下图所示。下列对有关实验现象的描述肯定不正确的是( )
A.Ⅰ处溶液变蓝
B.Ⅱ处溶液变浑浊
C.Ⅲ处溶液颜色逐渐变浅
D.Ⅳ处试纸变红
二、积累运用(共27分)
11.(4分)用化学用语填空:
(1)人体胃液中帮助消化的酸是 ;
(2)2个碳酸根离子 ;
(3)消石灰的主要成分 ;
(4)硫酸中硫元素的化合价为+6价 。
12.(7分)小霖将一枚生锈的铁螺丝放入足量的稀盐酸中,观察到 ,
该反应的化学方程式为 ;一段时间后,又观察到 ,该反应的化学方程式为 。小霖结合学过的化学知识,向管理人员提出了一些防止机械设备进一步锈蚀的建议,请写出一条小霖的建议:
。
13.(8分)二氧化碳的“捕捉”与“封存”是实现温室气体减排的重要途径之一。实际生产中,经常利用足量NaOH溶液来“捕捉”CO2,流程图如下(部分条件及物质未标出)。
11
(1)分离室中进行的操作是 。
(2)该流程图所标出的物质中,溶于水放出大量热的氧化物是 。
(3)“捕捉室”内发生反应的化学方程式为 。
(4)该流程中可循环使用的一种物质是 。
14.(8分)如右图所示A~G是初中化学常见的物质。图中“→”表示转化关系,“—”表示相互能反应。已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F是氧化物。请回答:
(1)G的化学式为 ,E与F反应的基本反应类型是 ,写出物质B的一种用途 ;
(2)C与D反应的化学方程式可能是
。
三、情景分析(共15分)
15.(7分)(1)小亮在化学晚会上观看了“瓶吞鸡蛋”的魔术(如图1),瓶内发生反应的化学方程式是 。小亮思考:瓶能吞蛋,能不能吐蛋呢?他进行了如图2所示的实验,他加入试剂P,结果鸡蛋吐了出来,试写出反应的化学方程式 ,吐蛋的原因是 。
(2)近年来,世界上地震灾害频发。震灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法。漂白粉是常用的消毒剂。漂白粉的主要成分是次氯酸钙[Ca(ClO)2]和氯化钙。工业上将氯气通入石灰乳[Ca(OH)2]来制取漂白粉,试写出该反应的化学方程式
11
。
16.(8分)家庭厨房实际上就是一个化学世界,“柴米油盐酱醋糖”等都是化学物质。厨房内有一瓶无标签的液体,经步骤①:观察颜色与状态;步骤②:闻气味;步骤③:取该液体适量与一枚生锈的铁钉作用,看到铁锈逐渐溶解;步骤④:另取少量该液体与纯碱反应,发现有气泡产生。确认该液体为食醋。根据上述实验回答下列问题:
(1)在上述①至④的四个步骤中,其中根据物质的物理性质来判断的有 (填序号,下同),利用物质的化学性质来判断的有 。
(2)在步骤②中能闻到特殊气味,这是因为醋酸分子 的缘故。
(3)当食醋中的醋酸(CH3COOH)与纯碱反应时除有气泡生成外,还生成了醋酸钠(CH3COONa)和水,请写出该反应的化学方程式:
。
四、实验探究(18分)
17.通过学习碱的性质,我校化学兴趣小组的同学对实验室中的“氢氧化钙是否变质以及变质的程度”展开了探究活动,请你一同参与:
(1)提出问题:氢氧化钙是否变质?
(2)猜想与假设:同学们经过讨论认为样品存在三种可能情况:没有变质;部分变质;完全变质。
(3)实验探究:
实验步骤及操作
实验现象
实验结论
取样品于试管中,加入足量蒸馏水振荡,静置。
①取上层清液,滴入无色酚酞溶液
②倒去上层清液,再向试管中注入稀盐酸
①无色酚酞溶液变红
②
部分变质
①无色酚酞溶液不变红
11
②
①
②没有气泡产生
(4)小结与思考:
①小蔓同学根据上述实验方案进行实验,确定该样品已部分变质,请写出样品变质的实验中反应的化学方程式: 、 。
②氢氧化钙俗称熟石灰,农业上常用来 。
五、计算应用(10分)
18.将5%的NaOH溶液逐滴加入到10 g稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示。试回答:
(1)a点溶液中大量存在的离子有 。
(2)当恰好完全反应时,消耗NaOH溶液的质量为 。
(3)计算稀盐酸中溶质的质量分数。
答案:1.C 2.A 3.A
4.C 除杂的目的是除去杂质、保留主要成分,又不混入新的杂质,而C中熟石灰[Ca(OH)2]和石灰石(CaCO3)都能与稀盐酸反应,达不到除杂的目的。
5.A
11
6.C 碱的通性是能使紫色石蕊溶液变蓝色,能与酸反应生成盐和水,能与CO2反应。而C项中钡离子与硫酸根离子结合生成BaSO4沉淀,氢氧化钡是唯一能与Na2SO4溶液反应生成BaSO4沉淀的碱。故C正确。
7.B 稀硫酸和Ba(OH)2溶液能反应生成硫酸钡沉淀和水,当硫酸反应完后,沉淀的质量不再改变,A正确;不断慢慢滴加10%的Ba(OH)2溶液至过量,水的质量不断增加,不会出现不变的情况,B错误;硫酸的pH小于7,当硫酸与Ba(OH)2溶液完全反应时溶液的pH等于7,加入Ba(OH)2溶液过量时,溶液的pH大于7,C正确;稀硫酸和Ba(OH)2溶液能反应生成硫酸钡沉淀和水,当两者不断反应时,溶质的质量分数逐渐减小,当Ba(OH)2溶液过量时溶质的质量分数又会逐渐增大,D正确。
8.B 常温下,生成的硫会从溶液中以沉淀的形式析出,说明硫的溶解度很小,故A正确;该反应的反应物和生成物都是一种单质和一种化合物,因而属于置换反应,故B不正确;反应物H2S中,硫的化合价为-2价,生成物中单质硫的化合价为0价,故C正确;由于氢硫酸容易被空气氧化成中性的水,故酸性逐渐减弱,pH会增大,故D正确。
9.C 本题考查对图像的分析和判断能力,解题时要注意图像中一些特殊的点、段的意义。高温煅烧石灰石生成氧化钙和二氧化碳,其中氧化钙为固体,故固体质量不可能变为0,A错误;催化剂只能改变反应速率,而不能改变最终产物的质量,B错误;在稀盐酸中逐滴滴加氢氧化钠溶液,溶液的pH逐渐升高,最终会超过7,C正确;饱和的硝酸钾溶液不能再溶解硝酸钾,因此溶质的质量分数不会随着硝酸钾的加入而增大,D错误。
10.A 大理石与稀盐酸反应产生二氧化碳,二氧化碳与水反应生成碳酸,能使紫色石蕊溶液和蓝色石蕊试纸变红色,A错误,D正确;二氧化碳能使澄清石灰水变浑浊,B正确;二氧化碳与氢氧化钠溶液反应生成碳酸钠,碱性减弱,酚酞溶液颜色变浅,C正确。
11.答案 (1)HCl (2)2C (3)Ca(OH)2 (4)H2O4
12.答案 锈迹消失,溶液变为黄色 Fe2O3+6HCl2FeCl3+3H2O 有气泡产生 Fe+2HClFeCl2+H2↑ 保持机械设备干燥、刷漆、涂油等
13.解析 (1)分离室是将固体和液体分离,用过滤操作。(2)该流程图所标出的物质中,CaO与水反应放出大量的热。(3)“捕捉室”内是二氧化碳与氢氧化钠的反应。(4)根据流程图中的虚线可知,该流程中可循环使用的物质为NaOH和CaO。
答案 (1)过滤 (2)CaO(或氧化钙)
11
(3)CO2+2NaOHNa2CO3+H2O
(4)NaOH或CaO(任答一种即可)
14.解析 A是人体胃液中含有的酸,可知A是盐酸;G是最轻的气体,应是H2;H2与氧化物F能相互转化,F是H2O;B是氧化物,并且能由盐酸制取,B应是CO2,则C是CO;E、D两种氧化物都能与盐酸反应,则都是金属氧化物。部分金属氧化物与水能发生化合反应,CO2可用于灭火或用作气体肥料等;C与D的反应是CO与金属氧化物的反应。
答案 (1)H2 化合反应 灭火(或气体肥料、化工产品的原料等)
(2)3CO+Fe2O32Fe+3CO2(其他合理答案也可)
15.解析 “瓶吞鸡蛋”是由于瓶内的二氧化碳气体被氢氧化钠溶液吸收,压强减小,大气压将鸡蛋压入瓶内;要想让瓶内的鸡蛋“吐”出来,可使瓶内压强增大,利用气压将鸡蛋压出,酸可与碳酸钠溶液反应生成二氧化碳气体,故P试剂可能为盐酸(或硫酸)。
答案 (1)2NaOH+CO2Na2CO3+H2O Na2CO3+2HCl2NaCl+H2O+CO2↑ 反应生成二氧化碳气体,瓶内压强增大(其他合理答案也可)
(2)2Cl2+2Ca(OH)2Ca(ClO)2+CaCl2+2H2O
16.解析 (1)颜色、状态、气味等属于物质的物理性质;能与生锈铁钉和纯碱反应属于该物质的化学性质。(2)能闻到醋酸的气味是醋酸分子不断运动的结果。(3)可仿照碳酸钠与盐酸的反应来书写化学方程式。
答案 (1)①② ③④
(2)在不断运动
(3)Na2CO3+2CH3COOH2CH3COONa+H2O+CO2↑
17.解析 由实验结论部分变质可知,部分氢氧化钙肯定变化为碳酸钙,而碳酸钙能与盐酸反应生成二氧化碳气体。由无色酚酞溶液不变红可知,溶液已经不显碱性,表明氢氧化钙已全部变质,加入盐酸肯定生成二氧化碳气体。由加入盐酸没有气泡产生可知,样品中没有碳酸钙,即没有变质,氢氧化钙仍能使无色酚酞溶液变红。
答案 (3)实验探究:
11
实验步骤及操作
实验现象
实验结论
①
②有气泡产生
①
②有气泡产生
完全变质
①无色酚酞溶液变红
②
没有变质
(4)小结与思考:
①Ca(OH)2+CO2CaCO3↓+H2O
CaCO3+2HClCaCl2+H2O+CO2↑
②改良酸性土壤
18.答案 (1)Na+、Cl-
(2)16 g
(3)解:设10 g稀盐酸样品中含HCl的质量为x。
HCl+NaOHNaCl+H2O
36.5 40
x 16 g×5%
x=0.73 g
盐酸中HCl的质量分数为×100%=7.3%
11
答:稀盐酸中HCl的质量分数为7.3%。
11
相关文档
- 初中语文PPT教学课件:14 应有格物致2021-11-1118页
- 初中物理中考复习单元复习课件:第212021-11-1130页
- 初中中考物理复习课件:第20讲 生活2021-11-1129页
- 2020届初中物理章节复习 第2章 声2021-11-1114页
- 2020届初中物理章节复习 第14章 内2021-11-119页
- 2018年江苏省盐城市初中毕业与升学2021-11-1121页
- 2020届初中生物中考一轮复习考点测2021-11-114页
- 2018届初中地理总复习课件:第16讲 2021-11-1165页
- 2019年安徽省初中学业水平考试历史2021-11-1114页
- 初中数学中考复习课件章节考点专题2021-11-1146页