- 891.85 KB
- 2021-11-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020-2021学年初三化学上册同步解析与测评:原子的结构
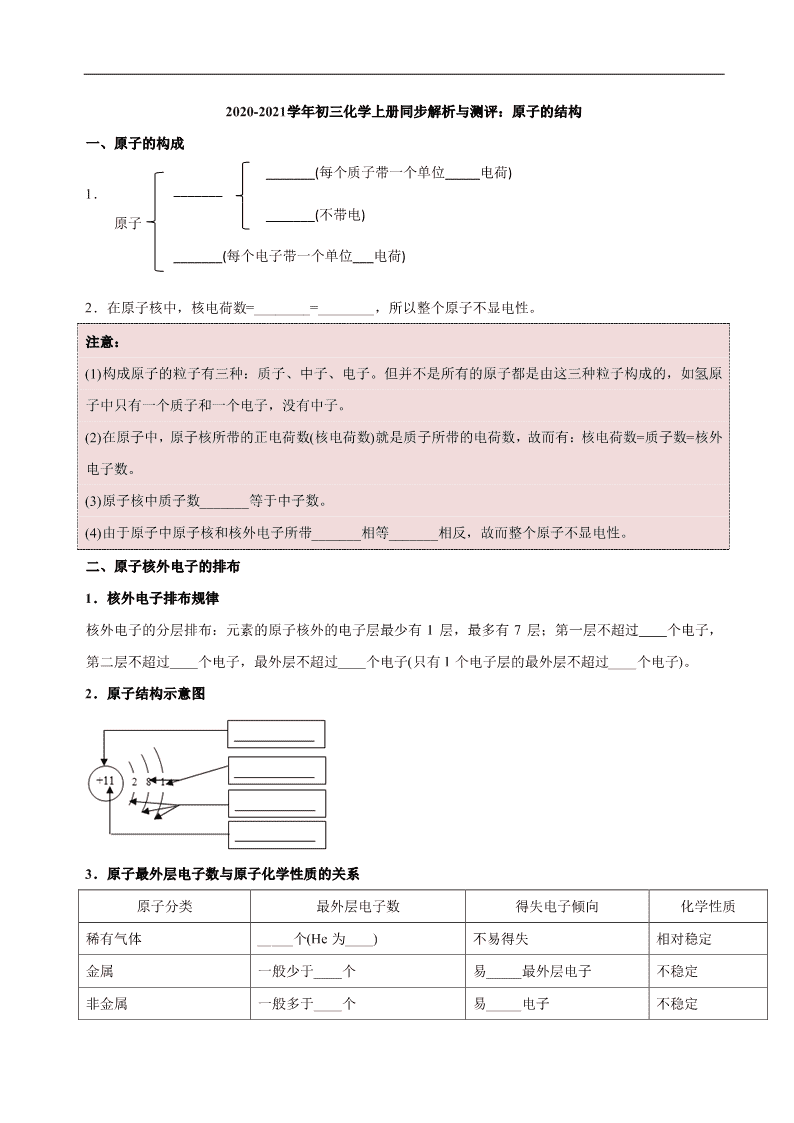
一、原子的构成
1.
2.在原子核中,核电荷数=________=________,所以整个原子不显电性。
注意:
(1)构成原子的粒子有三种:质子、中子、电子。但并不是所有的原子都是由这三种粒子构成的,如氢原
子中只有一个质子和一个电子,没有中子。
(2)在原子中,原子核所带的正电荷数(核电荷数)就是质子所带的电荷数,故而有:核电荷数=质子数=核外
电子数。
(3)原子核中质子数_______等于中子数。
(4)由于原子中原子核和核外电子所带_______相等_______相反,故而整个原子不显电性。
二、原子核外电子的排布
1.核外电子排布规律
核外电子的分层排布:元素的原子核外的电子层最少有 1 层,最多有 7 层;第一层不超过 个电子,
第二层不超过 个电子,最外层不超过 个电子(只有 1 个电子层的最外层不超过____个电子)。
2.原子结构示意图
3.原子最外层电子数与原子化学性质的关系
原子分类 最外层电子数 得失电子倾向 化学性质
稀有气体 _____个(He 为____) 不易得失 相对稳定
金属 一般少于____个 易_____最外层电子 不稳定
非金属 一般多于____个 易_____电子 不稳定
_______
_______(每个质子带一个单位_____电荷)
_______(不带电)
_______(每个电子带一个单位___电荷)
原子
4.离子
(1)概念:带电的__________。
(2)分类
阳离子:带___电的原子。如:钠离子_____(填离子符号,下同)、镁离子_____。
阴离子:带___电的原子。如:氯离子_____、硫离子_____。
(3)离子符号表示的意义
(4)氯化钠的形成过程
在上述过程中,钠原子因失去 1 个电子而带上 1 个单位的____电荷;氯原子因得到 1 个电子而带上一个
单位的____电荷。带____电荷的两种离子相互作用就形成了氯化钠。可见,______也是构成物质的粒子。
三、相对原子质量
国际上以 为标准,其它原子的质量跟它相比较所得的 ,作为这种原子的 质
量,符号为 ,相对原子质量的计算公式为 。根据这个标准,碳、氢、氧的相对
原子质量分别约为 、 、 ,质子、中子的相对质量都约为 。跟质子、中子
相比,电子的质量 ,可以忽略不计,所以原子的质量主要集中在 上,因此,相对原子质
量的近似求法是:
相对原子质量≈ 数+ 数
注意:相对原子质量只是一个比值,单位为 1,常省略不写。一般化学计算我们可采用相对原子质量的近
元素符号右上角的数字表示该离子所带的______,“ +”“ -”表示离子的_____
离子符号前面数字表示离子的______
2Fe3+
似值。
【答案】一、1.原子核 质子 正 中子 核外电子 负
2.质子数 核外电子数
注意:(3)不一定 (4)电量 电性
二、1.2 8 8 2 2.原子核 各电子层所容纳的电子数 电子层 核内质子数
3.8 2 4 失去 4 得到
4.(1)原子 (2)正 Na+ Mg2+ 负 Cl- S2- (3)电荷数 电性 个数
(4)正 负 相反 离子
三、一种碳原子质量的 1/12 比 相对原子 Ar
12 1C 12
原子的实际质量
原子的实际质量
12 1 16 1 很小
原子核 质子 中子
一、原子结构示意图的书写及相关判断
要正确书写原子结构示意图,必须遵循核外电子排布的一般规律:①每一电子层上所容纳的电子数不超
过 2n2 个(n 为电子层数)。例如,第一层上只能容纳 2×12=2 个;第二层上能容纳 2×22=8 个电子;第三层
上能容纳 2×32=18 个电子,依此类推。②核外电子是逐层排布的,先排满第一层,再排第二层,第二层排
满后,再排第三层,依此类推。③最外层电子数不得超过 8 个。
(2020·广州)如图为氧原子的结构示意图,从图中可获得的信息是
A.氧原子核内质子数为 8、中子数为 0,核外电子数为 8
B.氧原子核外第一层上有 6 个电子
C.氧原子的原子核在整个原子中所占体积极小
D.氧原子在化学反应中容易得到 2 个电子
【解析】A、氧原子核内质子数为8、中子数为 ,质子数=核外电子数,核外电子数为8,故A不正确;
B、氧原子核外第一层上有2个电子,故B不正确;
C、原子是由原子核和核外电子构成的,原子核在原子中所占体积极小,则氧原子的原子核在整个原子中
所占体积极小,但是原子结构示意图不能得到该信息,故C错误;
D、氧原子的最外层电子数为6,大于4,在化学反应中容易得到2个电子,故D正确。故选D。
【答案】D
二、原子结构示意图最外层电子数与化学性质的关系
1.最外层电子数为 8(氦为 2 个电子)时,达到相对稳定结构。
2.最外层电子数为小于 4 时,在化学反应中,一般易失去电子,形成阳离子,达到相对稳定结构。
3.最外层电子数为大于 4 时,在化学反应中,一般易得到电子,形成阴离子,达到相对稳定结构。
结论:①元素的化学性质与原子的最外层电子数有关;
②判断化学性质是否相似: 最外层电子数相同的原子具有相似的化学性质(氢、氦、硼除外)。
(2020·常德)如下图是五种微粒的结构示意图,下列说法正确的是
A.①④属于金属元素
B.②的微粒符号是 Al3+
C.②③⑤属于阳离子
D.②④位于元素周期表的同一周期
【解析】图①~⑤分别表示氟原子(F)、铝离子(Al3+)、镁离子(Mg2+)、铝原子(Al)、氖原子(Ne);
A、①表示氟原子,属于非金属元素,A选项错误;
B、②表示铝离子,符号为Al3+,B选项正确;
C、⑤表示铝原子,不是离子,C选项错误;
D、②和④表示的是同一种元素,因此其位置相同,D选项错误;
【答案】B
三、原子和离子的区别
粒子种类 原子 阳离子 阴离子
区别
粒子结构 质子数=核外电子数 质子数>核外电子数 质子数<核外电子数
粒子电性 不显电性 带正电 带负电
相同点
都是构成物质的一种粒子。同种元素的原子和离子核内质子相同,即核电荷
数相同核外电子数不同。
联系
得电子 得电子
失电子 失电子
阳离子 原子 阴离子
(2019·威海) 下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
【解析】A、同种分子排列方式不同,但分子的种类不变,化学性质相同,故选项说法错误。
B、在干冰中,分子总是在不断的运动的,故选项说法错误。
C、同种原子按不同方式结合,可以构成不同的物质,如水和过氧化氢,故选项说法正确。
D、原子得失电子形成离子后,原子核不变,故选项说法错误。
【答案】C
四、相对原子质量的计算
相对原子质量是基于原子本身的实际质量太小,国际上采取以一种碳原子(碳 12 原子)的质量的 1/12 为标
准,其他原子的质量与这个标准的比值,就是该原子的相对原子质量。相对原子质量是一个比值,在应
用中常取整数值。一般地,当相对原子质量取整数时,在数值上等于该原子的质子数加中子数。另外,
不要误认为相对原子质量的单位为“g”或没有单位,实际上相对原子质量的国际单位为“1”,但一般不写出。
原子的质量与相对原子质量的区别与联系
原子的质量 相对原子质量
来源 测定出来的 比较出来的
性质 绝对的 相对的
数值 非常小 大多数取整数
单位 Kg 1
以碳 12 为例 1.993×10-26 Kg 12
联系
①相对原子质量= 12 1C 12
原子的实际质量
原子的实际质量
②原子的质量越大,其相对原子质量越大。
注意: 理解相对原子质量的几个注意事项:
1.相对原子质量是一个比值,不是原子的实际质量。
2.相对原子质量有单位,国际单位为“1”,一般不写。
3.作为标准的是碳 12 原子实际质量的 1/12,而不是碳原子的质量。
下列关于相对原子质量的说法中,正确的是( )
A.相对原子质量由原子的核外电子数决定的
B.相对原子质量是一个比值
C.相对原子质量是一个原子的质量,以克为单位
D.相对原子质量是一个原子的质量,以千克为单位
【解析】A、原子的质量主要集中在原子核(由质子和中子构成)上,相对原子质量由质子数和中子数决
定的,故选项说法错误.
B、相对原子质量是一个比值,故选项说法正确.
C、相对原子质量是个比值,是一个比值,单位是“1”,不是克,故选项说法错误.
D、相对原子质量是一个比值,不是一个原子的质量,单位是“1”,不是千克,故选项说法错误.
【答案】C
五、物质由微粒构成
(2020·重庆 B 中考)下列微粒中不能直接构成物质的是( )
A.分子 B.原子 C.中子 D.离子
【解析】分子、原子、离子都可以直接构成物质,中子不能直接构成物质;
【答案】C
1.(2020·威海)科学理论在传承中不断发展,科学家们传承前人的正确观点,纠正错误观点,形成科学
理论,关于原子结构的学说有:①在球体内充斥正电荷,电子镶嵌其中②原子是可分的③原子呈球形④
原子中有带负电的电子⑤原子中有带正电的原子核⑥原子核很小,但集中了原子的大部分质量
其中经过卢瑟福传承和发展后形成的观点是( )
A. ②③④⑤⑥ B. ①②③④
C. ④⑤⑥ D. ⑤⑥
2.(2019·江西)考古学家通过测定碳 14 的含量等方法将人类生活在黄土高原的历史推前至距今 212 万
年。碳 14 原子的核电荷数为 6,相对原子质量为 14,则该原子核外电子数为
A.6 B.8 C.14 D.209
3.(2019·临沂)与元素的化学性质关系最密切的是( )
A.元素的相对原子质量 B.原子的核外电子数
C.元素的核电荷数 D.原子的最外层电子数
4.(2019·常州)已知某氧原子的实际质量为mg,其相对原子质量为16。有一种铕(Eu)原子的相对原
子质量为152,铕(Eu)原子的质量为( )
A. 152m g16 B. 152m
16
C. 152m g12 D. 152m
12
5.(2020·黔东南州)2019 年 8 月《Science》杂志报道,科学家合成了一种环状碳分子 C18,这种分子具
有广泛的应用前景。1 个环状碳分子 C18 中共含有 18 个( )
A.原子 B.质子 C.中子 D.电子
6.氧分子是由氧原子构成的,如图为氧原子的结构示意图。下列说法正确的是
A.氧原子的最外层电子数为 2
B.氧原子在化学反应里容易失去 6 个电子
C.氧原子得到 2 个电子后变成氧离子,形成稳定结构
D.氧原子在化学反应时形成氧离子的离子符号为 O2+
7.( 2020·襄阳)如图是硫原子的结构示意图,下列由图中获取的信息错误的是( )
A.硫原子的核电荷数为 16
B.硫原子在化学反应中易失去电子
C.硫原子的结构示意图中的 x 等于 8
D.硫原子所形成离子的符号为 S2﹣
8.(2019•温州)联合国把今年定为“元素周期表年”。俄国科学家门捷列夫对元素周期表的编制做出巨大
贡献,人们将 101 号元素命名为“钔”来纪念他。钔原子的核电荷数为 101,相对原子质量为 258,则钔原
子的质子数为( )
A.101 B.157 C.258 D.359
9.(2020·鸡西)今有四种粒子的结构示意图,下列说法正确的是 ( )
A.它们表示四种元素
B.②对应的原子在化学反应中易失去电子
C.④表示的元素是非金属元素
D.①③表示的都是阳离子
10.( 2019·威海)下列对分子、原子、离子的认识正确的是
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
11.对相对原子质量的叙述正确的是( )
A.相对原子质量就是一个原子的真实质量
B.相对原子质量的单位是克
C.相对原子质量是一个比值,没有单位.
D.相对原子质量是以一种碳原子质量的 1/12 为标准,其它原子的质量与之比较所得的比值
12.( 2020·苏州)下列物质由离子构成的是
A.铜 B.水 C.氯化钠 D.氖气
13.根据如图提供的信息,回答相关问题。
(1)A 原子容易__________(填“得”或“失”)电子达到稳定结构。
(2)表示原子的粒子有__________(填字母,下同)。
(3)表示阴离子的有__________。
(4)表示阳离子的有__________。
(5)A、B、C、D 粒子中具有相对稳定结构的是__________。
(6)若 E 中 x=18,则该粒子属于__________(填“原子”或“离子”)。
14.(2020·金华)人们为了揭示原子结构的奥秘,经历了漫长的探究过程。1911 年物理学家卢瑟福用带
正电的 α 粒子轰击金属箔,实验发现:多数 α 粒子穿过金属箔后仍保持原来的运动方向,绝少数 α 粒子
发生了较大角度的偏转。
(1)卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的 。
(2)当 α 粒子轰击金属箔时,图中四条运动轨迹不可能出现的是 (填字母)。
15.下图为六种常见元素的原子结构示意图,依据图中信息回答下列问题:
(1)上述六种元素中属于金属元素的是 (填元素名称),己元素的化学性质与 (填元素符号)元素
相似。
(2)在化学反应中,戊元素的原子容易 失去(填“失去”或“得到”)电子形成阳离子,该元素的离子符
号是_______________。
1.【答案】A
【解析】①在球体内充斥正电荷,电子镶嵌其中是错误的,因为质子带正电荷,位于原子核内,核外电
子在原子核外高速运动;②原子是可分的,分为原子核和核外电子;③原子呈球形是正确的;④原子中
有带负电的电子正确;⑤原子中有带正电的原子核是正确的;⑥原子核很小,但集中了原子的大部分质
量正确的,原子的质量主要集中在原子核上。
2.【答案】A
【解析】原子中,质子数=核电荷数=核外电子数,故 A 正确;
3.【答案】D
【解析】元素的化学性质与其原子的核外电子排布,特别是最外层电子的数目有关,而相对原子质量、
原子核外电子数及核电荷数与元素的化学性质关系并不密切。
4.【答案】A
【解析】氧原子的实际质量为 mg,其相对原子质量为 16,碳原子的质量的 1
12
为 mg
16
,铕(Eu)原子的
相对原子质量为 152,铕(Eu)原子的质量为 152= mg15 g16
2m
16 ,故选 A。
5.【答案】A
【解析】分子是由原子构成的,1 个环状碳分子 C18 中含有 18 个碳原子,1 个环状碳分子 C18 中共含有 18
个碳原子。故选:A。
6.【答案】C
【解析】A、由原子结构示意图可知:氧原子的最外层电子数为 6,此选项错误;B、氧原子的最外层电
子数为 6,多于 4 个,易得电子成为阴离子,此选项错误;C、氧原子的最外层电子数为 6,多于 4 个,
易得 2 个电子成为氧离子,形成稳定结构,此选项正确;D、氧原子的最外层电子数为 6,多于 4 个,易
得 2 个电子成为带 2 个单位负电荷的氧离子,符号为:O2−,此选项错误。故选 C。
7.【答案】B
【解析】A、由硫原子的结构示意图可知,硫原子的质子数是 16,硫原子的核电荷数为 16,故 A 正确;
B、硫原子的最外层电子数是 6,大于 4,在反应中易得到电子,故 B 错误;
C、在原子中质子数等于电子数,所以硫原子的结构示意图中的 x=16﹣2﹣6=8,故 C 正确;
D、硫原子的最外层电子数是 6,大于 4,在反应中易得到两个电子,硫原子所形成离子的符号为 S2﹣,故
D 正确。
8.【答案】A
【解析】在原子中,核内质子数=核电荷数,钔原子的核电荷数为 101,则钔原子的质子数为 101;
9.【答案】B
【解析】A、决定元素种类的是核内质子数。原子结构示意图中圆圈内的数字表示核内质子数,①②③④
的质子数分别为:8、12、11、12,故它们表示三种不同的元素,故选项错误;
B、对于原子,核内质子数数=核外电子数,②表示原子,其最外层电子数为 2,小于 4,易失去,故选项
正确;
C、④中质子数为 12,为镁元素,所以表示的元素是金属元素,故选项错误;
D、①中核内质子数=8<核外电子数=10,属于阴离子;④中核内质子数=12>核外电子数=10,属于阳离子,
故选项错误。
10.【答案】C
【解析】A、同种分子排列方式不同,但分子的种类不变,化学性质相同,故选项错误;B、分子总是在
不断的运动的,在干冰中也在不停的运动,故选项错误;C、同种原子按不同方式结合,可以构成不同的
物质,如水和过氧化氢,故选项正确;D、原子得失电子形成离子,是核外电子的变化,原子核不变,故
选项错误。故选 C。
11.【答案】D
【解析】A、相对原子质量是一个比值,不是一个原子的真实质量,故选项说法错误.
B、相对原子质量是一个比值,单位是“1”,不是克,故选项说法错误.
C、相对原子质量是一个比值,有单位,单位是“1”,故选项说法错误.
D、相对原子质量是以一种碳原子质量的 1 12 为标准,其它原子的质量与之比较所得的比值,故选项
说法正确。
12.【答案】C
【解析】铜是金属由原子直接构成,水由水分子构成,氖气是稀有气体有原子构成,氯化钠是由钠离子
和氯离子构成,故答案为 C。
13.【答案】(1)得 (2)AC (3)D (4)B (5)BD (6)原子
【解析】(1)A 粒子的最外层电子数是 6,在化学反应中易得到 2 个电子达到相对稳定结构。
(2)当质子数=核外电子数,为原子,A、C 中,质子数=核外电子数,为原子。
(3)当质子数<核外电子数,为阴离子,D 为阴离子。
(4)当质子数>核外电子数,为阳离子,B 为阳离子。
(5)粒子的最外层电子数为 8(氦为 2 个),属于相对稳定结构,BD 的最外层为电子数均为 8,均属于
相对稳定结构。
(6)E 中 x=18,18=2+8+8,质子数=核外电子数,所以 E 为原子。
14. 【答案】(1)原子核 (2)C
【解析】(1)卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的原子核。
(2)当 α 粒子轰击金属箔时,图中四条运动轨迹不可能出现的是 C,是因为粒子都带正电荷,轨迹应该是
和 D 相似,向上偏转。
15. 【答案】(1)钠铝 F (2)Al3+
【解析】(1)由微粒的核内质子数可知,上述六种元素中丁、戊的质子数分别是 11、13,分别是钠、铝,
属于金属元素,由于己原子的最外层电子数与丙原子的元素的电子数相同都是 7,化学性质相似。
(2)戊元素的原子的最外层电子数是 3,小于 4,容易失去电子形成阳离子,质子数是 13,该元素的离子
是铝离子,符号是 Al3+。
相关文档
- 人教版九年级化学《课堂设计》第三2021-11-116页
- 2020九年级化学上册 第三单元 物质2021-11-1111页
- 2020九年级化学上册第三单元课题22021-11-116页
- 第3单元 课题2:原子的结构(1) 导学2021-11-112页
- 人教版九年级化学上册《课题2 原子2021-11-1040页
- 初中化学九年级上册第三单元物质构2021-11-1022页
- 初中化学九年级上册第三单元物质构2021-11-103页
- 初中化学九年级上册第三单元物质构2021-11-1023页
- 初中化学九年级上册第三单元物质构2021-11-104页
- 2020九年级化学上册第三单元课题22021-11-103页