- 4.24 MB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一课时
第二课时
第三单元 物质构成的奥秘
课题
2
原子的结构
人教
版 九年级 化学 上册
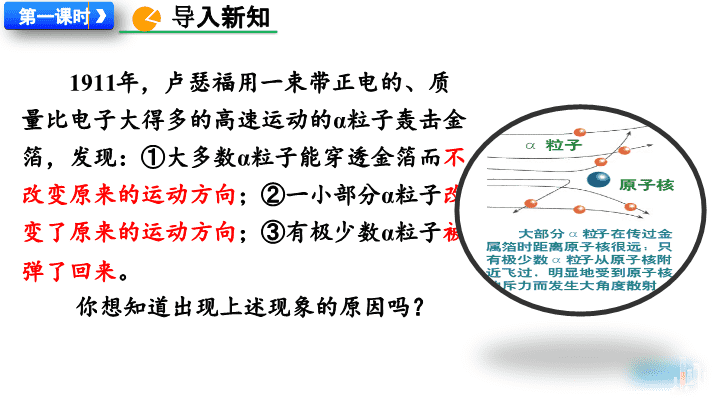
1911
年,卢瑟福用一束带正电的、质量比电子大得多的高速运动的
α
粒子轰击金箔,发现:①大多数
α
粒子能穿透金箔而
不改变原来的运动方向
;②一小部分
α
粒子
改变了原来的运动方向
;③有极少数
α
粒子
被弹了回来
。
你
想知道出现上述现象的原因吗?
第一课时
导入新知
1.
知道原子是由
原子核
和
核外电子
构成的,并知道整个原子呈
电中性
的原因。记住
核电荷数
、
质子数
和
核外电子数
之间的关系。
3.
初步掌握
相对原子质量
的概念,并学会查找元素的
相对原子质量
。
2.
了解
离子
的概念及形成过程,认识
离子
是构成物质的一种微粒,会写常见的
离子符号
。
知识点
1
原子的构成
【
思考
】
原子质量和体积都很小,那它还能不能再分呢?原子是实心球吗?
硅原子
乒乓球
原子大小比较
原子结构研究发展史
实心球模型
枣糕模型
行星模型
电子云模型
玻尔模型
原子的构成
原子结构
原子核大小比较
原子结构示意图
观察图片,你想到了什么?
1
.
原子
不是
一个
实心球体
;
2
.
原子
是由居于原子中心的
原子
核
和
核外电子
构成的;
3
.
原子核
带
正电荷
,电子带
负电荷
;
…………
4
.
原子核
由
质子
和
中子
构成;
质子
中子
【
观察思考
】
原子的构成示意图
粒子
种类
电性
质量
质子
1
个单位正电荷
1.6726×10
-27
kg
中子
不带电
1.6749×10
-27
kg
电子
1
个单位负电荷
质子质量的
1/1836
观察上面表格,你有什么发现?
构成原子的粒子的电性和质量
1.
一个质子和一个电子所带的
电量相等
,
电性相反
。
2.
一个质子和一个中子的
质量约相等
。
3.
原子的质量主要集中在
原子核
上。
几种原子的构成
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
氯
17
18
17
【思考】
从下列表格中你可以得到哪些结论?
质子数
=
核外电子数
不是所有的原子都含有中子
质子数不一定等于中子数
【
结论
】
【
思考
】
原子中存在着带电的粒子,为什么整个原子不显电性?
【
提示
】
由于原子里
质子数等于电子数
,一个质子和一个电子所带的
电量相等
,
电性相反
,所以整个原子不显电性。
1.
2017
年
5
月
9
日,相关机构发布 等四种元素的中文名称, 元素的核电荷数为
118
,相对原子质量为
294
,则原子核外电子数为( )
A
.
118
B
.
176
C
.
294
D
.
412
A
观看视频,总结核外电子的运动特点。
知识点
2
原子核外电子的排布
第二课时
探究新知
点击
图片播放视频
1
.
电子
在核外做
高速运动
。
2
.
没有
固定的运动轨道。
3
.
运动
区域与电子本身
能量
有关
。
【
思考
】
如何直观、形象地表示电子的分层排布呢?
电子层
离核远近
能量高低
一 二 三 四 五 六 七
低 高
近 远
分 层 排 布
原子结构示意图的意义
核电荷数
原子核
电子层
电子数
最外层
电子数≤
8
(
只有
1
层,电子不超过
2
)
原子
原子的最外层电子数特点
结构是否稳定
推测原子
性质
得失电子
稀有气体原子
金属
原子
非金属原子
8
个(
He
为
2
个)
比较稳定
一般少于
4
个
一般多于
4
个
不稳定
不稳定
原子的最外层电子数决定原子的化学性质。
【
讨论归纳
】
易失电子
易得电子
既不得电子,也不失电子
稳定
不稳定
不稳定
离 子
定义:
带电荷
的原子叫做离子。
离子的形成:
阴
离子
(-)
阳
离子
(+)
得
电子
失
电子
原子
离子的表示方法:在元素符号的
右上角
先标出所带的
电荷数
再注明
正负
。
钠离子
符号
Na
+
离子分类
阳离子
——
带正电荷
阴离子
——
带负电荷
Ca
2
+
Cl
-
钙离子
符号
氯离子
符号
一个镁离子
一个镁离子带
2
个单位的正电荷
Mg
2+
表示什么?
离子符号的意义
离子与原子的区别与联系
原子
离子
概念
电性
结构
联系
不带电
原子是化学变化中的最小微粒
离子是带电的原子
带电
大多数原子是不稳定结构
稳定结构
原子
阳离子
失电子
得电子
失电子
得电子
阴离子
知识点
3
相对原子质量
一个
碳原子
的质量是:
0
.
00000000000000000000000001993
千克,即
1
.
993×10
-26
千克
一个
氧原子
的质量是:
0
.
00000000000000000000000002657
千克,即
2
.
657×10
-26
千克
一个
铁原子
的质量是:
0
.
00000000000000000000000009288
千克,即
9
.
288×10
-26
千克
原子的实际质量
几种原子的质量
从上述几个数据中,你能想到什么?
1
.
不同
原子的质量不同;
2
.
原子
的质量很小;
3
.
如此
小的数据书写、使用均不方便;
…………
以一种
碳原子的质量
的
1/12
作为标准,其他原子的质量与它相比较所得的比,作为这种原子的
相对原子质量
(符号
Ar
)
。
计算公式
某原子的相对原子质量
碳原子
质量
×
1/12
= ——————————
某原子
的实际质量
相对原子质量
已知
1
个碳原子的质量是
1.993×10
-26
kg
,一
个氧原子的质量是
2.657×10
-26
kg
,求
氧原子的相对原子质量。
解:
标准
=
1.993×10
-26
kg×1/12=1.66×10
-27
kg
氧原子的相对原子质量
=
1.66×10
-27
kg
2.657×10
-26
kg
=16
答:
氧原子的相对原子质量是
16
。
【
算一算
】
1.
相对原子质量
_______
原子的实际质量。
2.
原子实际质量越大,它的相对原子质量数
________
。
3.
相对原子质量的单位
:_______________________
原子实际质量的单位是
:_______
不等于
越大
“
1
”
(
书写时一般不写出
)
千克
相对原子质量与原子实际质量的关系
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
铁
26
30
26
56
相对原子质量
=
质子数
+
中子数
相对原子质量与质子数和中子数的关系
2.
铁的相对原子质量为
56
,核外有
26
个电子,则铁原子核内含有的中子数是( )
A
.
26 B
.
28
C
.
30 D
.
56
C
巩固练习
例
学习
完“原子的构成”之后,萍萍同学形成了以下认识,其中错误的是( )
A
.原子由居于中心的原子核和核外电子构成
B
.核外电子在离核远近不同的区域中运动
C
.原子核的质量和电子的质量相差不大
D
.原子核的体积与整个原子的体积相比要小很多
连接中考
原子的构成
C
素养考点
1
连接中考
巩固练习
原子核外电子排布
素养考点
2
例
如图为某粒子的结构示意图
,下列说法正确的是
(
)
A
. 该
粒子有12个质子
B
. 该
粒子有2个电子层
C
. 该
粒子属于非金属原子
D
. 该
粒子已达到相对稳定结构
A
D
基础巩固题
1
.
道尔顿
、汤姆生和卢瑟福等科学家对原子结构进行了不断探索。下列叙述正确的是(
)
①原子由原子核和核外电子构成
②原子的质量主要集中在原子核上
③原子核在原子中所占的体积极小
A
.①②
B
.①③
C
.②③
D
.①②③
基础巩固题
2.
同一原子中,下列说法错误的是(
)
A
.质子和电子的数目相同
B
.原子和中子的电性不同
C
.原子核和电子的质量不同
D
.原子核和原子的体积不同
B
3
.
下列
关于
Mg
、
Mg
2+
两种粒子的判断中不正确的是( )
A
.核电荷数相同
B
.质量几乎相等
C
.
Mg
2+
比
Mg
稳定
D
.电子层数相同
D
基础巩固题
D
能力提升题
1
.
镭是一种放射性元素,镭原子的质子数为
236
,下列说法正确是( )
A
.核电荷数为
138
B
.镭原子的质量为
22g
C
.中子数为
88
D
.镭属于金属元素
能力提升题
2.
下列有关分子、原子、离子的说法中,正确的是( )
A
.原子是自然界中最小的粒子
B
.分子是化学变化中最小的粒子
C
.所有原子的原子核都由质子、中子构成
D
.分子、原子不显电性,离子显电性
D
3
.
在
“
宏观
—
微观
—
符号
”之间建立联系,是学习化学的一种重要思维方式。观察下列示意图回答有关问题。
请
回答下列问题:
(
1
)
x
的值为
,与
Br
化学性质相似的是
。
(
2
)表中具有相对稳定结构的是
、
。
(
3
)属于离子的是
。
(
4
)
D
表示
离子(填离子符号)的结构示意图,它属于
(填“阴离子”或“阳离子”)。
7
E
C
D
D
Na
+
阳离子
原子
原子核
核外电子
质子
中子
(
每个质子带
1
个单位正电荷
)
(
不带电
)
(
每个电子带
1
个单位负电荷
)
核电荷数
=
质子数
=
核外电子数
一、
原子的构成
课堂小结
原子核外电子是
分层排布
的
原子的结构可以用
原子结构示意图
表示
原子的核外电子排布,特别是
最外层的电子数目
,跟原子的
化学性质
有密切关系
原子通过得失电子达到
8
电子稳定结构
——
离子
二、原子核外电子排布
课堂小结
1
2
3
4
定义:
以一种
碳原子的质量
的
1/12
作为标准,其他原子的质量与它相比较所得的比,就是这种原子的相对原子质量。
相对原子质量≈质子数
+
中子数
三、相对原子质量
课堂小结
公式:
某原子的相对原子质量
碳原子
质量
×
1/12
= ——————————
某原子
的实际质量
作业
内容
教材作业
完成课后
“
练习与应用
”
题目
自主安排
配套练习册练习题