- 681.58 KB
- 2021-11-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第5课时 质量守恒定律和化学方程式
考题分层训练
考点1 质量守恒定律
1.[2019· 黔南]化学反应前后肯定没有发生变化的是 ( )
①原子数目 ②分子数目 ③元素种类 ④物质种类 ⑤原子种类 ⑥物质的总质量
A.①④⑥ B.①③⑤⑥
C.①②⑥ D.②③⑤
2.[2019·衢州]1784年,科学家卡文迪什演示了“人工空气”的燃烧,发现燃烧产物只有水,据此判断“人工空气”是 ( )
A.氢气 B.氮气
C.二氧化碳 D.氧气
3.[2019·湘西]我国历史悠久,“四大发明”闻名世界,其中“火药”是“四大发明”之一。黑火药爆炸的化学方程式为S+2KNO3+3CK2S+X↑+3CO2↑,其中X的化学式为 ( )
A.N2 B.NO2
C.NO D.SO2
4.[2019·贵港]在2A+3BC+2D反应中,36 gA与56 g B恰好完全反应生成28 g C和一定量的D。若C的相对分子质量为14,则C和D的相对分子质量之比为 ( )
A.7∶1 B.7∶8 C.7∶16 D.7∶32
5.[2018·连云港]物质a和b在一定条件下反应生成c和d的微观示意图如图5-1所示,下列说法正确的是 ( )
图5-1
A.物质c是一氧化碳
B.该反应不符合质量守恒定律
C.该反应前后,原子的种类发生改变
D.该反应前后,分子的个数保持不变
6.[2018·聊城]将宏观、微观及化学符号联系在一起是化学学科的特点。某化学反应的微观示意图如图5-2
16
所示,下列叙述正确的是 ( )
图5-2
A.反应前后各元素化合价不变
B.该化学变化中发生改变的微粒是原子
C.该反应不符合质量守恒定律
D.参加反应的CO2和H2分子个数比为1∶3
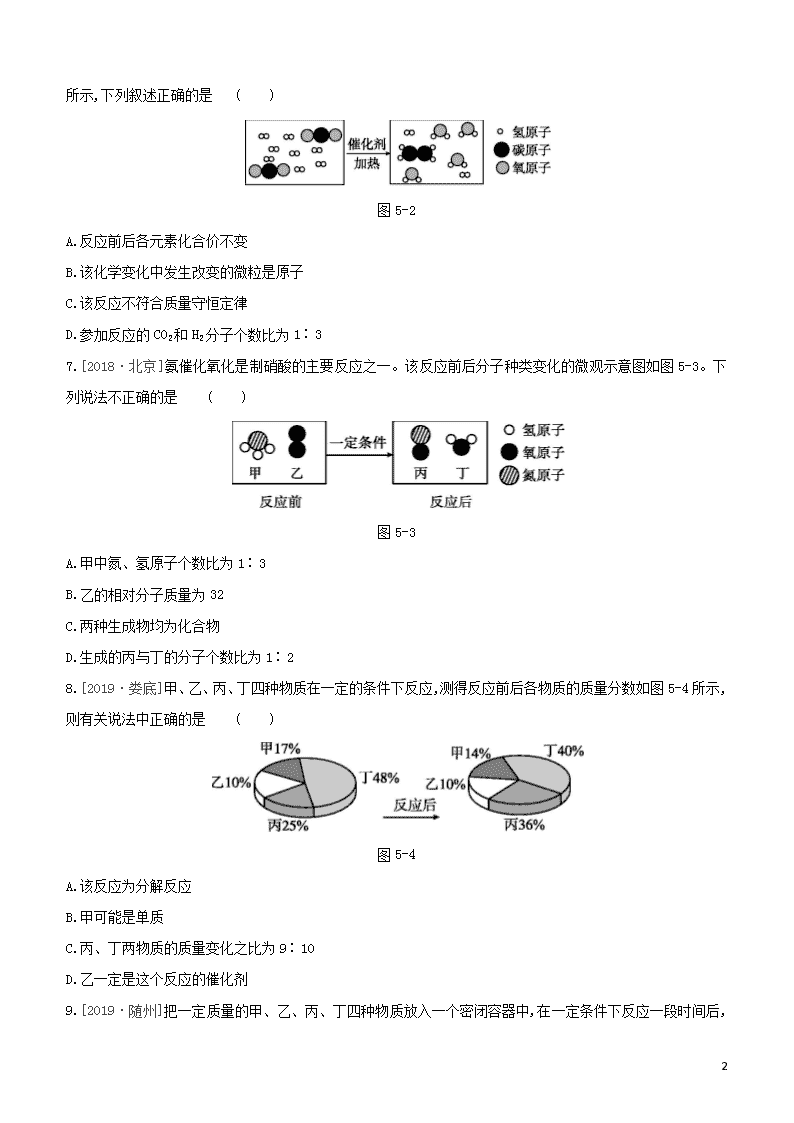
7.[2018·北京]氨催化氧化是制硝酸的主要反应之一。该反应前后分子种类变化的微观示意图如图5-3。下列说法不正确的是 ( )
图5-3
A.甲中氮、氢原子个数比为1∶3
B.乙的相对分子质量为32
C.两种生成物均为化合物
D.生成的丙与丁的分子个数比为1∶2
8.[2019·娄底]甲、乙、丙、丁四种物质在一定的条件下反应,测得反应前后各物质的质量分数如图5-4所示,则有关说法中正确的是 ( )
图5-4
A.该反应为分解反应
B.甲可能是单质
C.丙、丁两物质的质量变化之比为9∶10
D.乙一定是这个反应的催化剂
9.[2019·随州]把一定质量的甲、乙、丙、丁四种物质放入一个密闭容器中,在一定条件下反应一段时间后,
16
测得反应后的质量如下表所示。相关说法不正确的是 ( )
物质
甲
乙
丙
丁
反应前的质量/g
4.0
2.0
3.0
2.0
反应后的质量/g
1.2
x
2.4
5.4
A.该反应是化合反应
B.x=2.0,乙可能是催化剂
C.参加反应的甲、丙的质量比是1∶2
D.丙可能是单质
考点2 化学方程式
10.[2019·邵阳]某纯净物X在氧气中高温煅烧的化学方程式为4X+11O22Fe2O3+8SO2,则X的化学式是 ( )
A.FeS B.FeSO4
C.FeS2 D.Fe2O3
11.[2019·凉山]下列表述正确的是 ( )
选项
反应物及
反应条件
化学反应方程式
实验现象
A
铁丝在氧气中点燃
4Fe + 3O22Fe2O3
剧烈燃烧,火星四射,生成黑色固体
B
磷在空气中点燃
4P + 5O22P2O5
产生大量白雾,放出大量的热
C
将CO2通入到滴有紫色石蕊溶液的水中
CO2 + H2OH2CO3
滴有紫色石蕊溶液的水由紫色变为蓝色
D
将H2通入CuO片刻并加热
H2 + CuOCu + H2O
黑色的粉末逐渐变为红色,试管口有冷凝的液体滴下
12.[2019·自贡]下列化学方程式书写正确的是 ( )
A.Fe与稀盐酸:2Fe+6HCl2FeCl3+3H2↑
B.Ba(NO3)2溶液与稀盐酸:Ba(NO3)2+2HClBaCl2+2HNO3
C.NaOH溶液通入二氧化碳:NaOH+CO2NaCO3+H2O
D.乙醇燃烧:C2H5OH+3O22CO2+3H2O
13.[2019·苏州]根据下列反应事实写出相应的化学方程式。
16
(1)碳酸氢钠与稀盐酸反应: 。
(2)铁钉浸入硫酸铜溶液: 。
(3)二氧化碳通入澄清石灰水: 。
(4)稀盐酸除去铁锈: 。
14.[2019·重庆B]从烧煤的绿皮火车到利用电能的动车、高铁,火车的速度更快、能源更环保。
(1)铁路上常用铝热剂对钢轨进行焊接,发生反应的化学方程式为2Al+Fe2O3Al2O3+2Fe,该反应属于基本反应类型中的 反应,发生还原反应的物质是 (填名称)。
(2)绿皮车使用的煤为三大化石燃料之一,常温下呈液态的化石燃料为 。煤气化能得到更清洁的能源,煤气化的部分反应为C+CO22CO、C+H2OCO+H2。关于上述两个反应的说法错误的是 (填序号)。
A.都是化合反应
B.生成物都易燃
C.反应物都是单质与氧化物
考点3 根据化学方程式的计算
15.向盛有10 g铜铝合金样品的烧杯中加入100 g稀硫酸,恰好完全反应,反应结束后,测得烧杯内物质的总质量为109.4 g,则合金样品中铜的质量分数是 ( )
A.73% B.54% C.46% D.27%
16.用1 000 t含有氧化铁80%的赤铁矿石,理论上可以炼出97%的生铁的质量约是 ( )
A.560 t B.571 tC.577 t D.583 t
17.实验室加热氯酸钾(KClO3)和二氧化锰的混合物28.0 g制取氧气,完全反应后剩余固体质量为18.4 g。请计算:
(1)生成氧气的质量。
(2)原混合物中氯酸钾的质量。
16
18.[2019·安徽]侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下:
NaCl+CO2+NH3+H2ONaHCO3+NH4Cl。请计算:
(1)氯化铵中氮元素的质量分数。
(2)生产8.4 t碳酸氢钠,理论上需要氯化钠的质量。
考点1 质量守恒定律及其应用
1.[2018·烟台]工业上用甲和乙两种物质在一定条件下反应生成丙和X,反应的微观示意图如图5-5所示。参加反应的甲和乙及生成丙的质量比为甲∶乙∶丙=23∶17∶1。下列判断错误的是( )
图5-5
A.丙属于单质
B.参加反应的乙与生成的丙分子个数之比为1∶1
C.物质X中含三种元素
D.甲这种物质是由原子直接构成的
2.[2018·宜昌]在一密闭的容器中,一定质量的炭粉与过量的氧气在点燃的条件下充分反应,容器内各相关量与时间(从反应开始计时)的对应关系正确的是 ( )
图5-6
16
3.化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(如图5-7)。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的白光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
图5-7
(1)请写出镁条燃烧的化学方程式: 。
(2)同学们称量发现:在石棉网上收集到的产物质量小于镁条质量。有人认为这个反应不遵循质量守恒定律,你认为出现这样实验结果的原因可能是 。
(3)小红按图5-8所示装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
图5-8
提出问题黄色固体是什么?
查阅资料①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色固体氮化镁(Mg3N2);③氮化镁可与水剧烈反应产生氨,该气体能使湿润的红色石蕊试纸变蓝。
作出猜想黄色固体是Mg3N2。
实验探究请设计实验,验证猜想。
实验操作
实验现象及结论
反思与交流
①氮化镁中氮元素的化合价是 。
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧,产物MgO却远多于Mg3N2,合理的解释是
。
③同学们又联想到氢气能够在氯气中燃烧,于是对燃烧条件又有了新的认识:
。
16
考点2 质量守恒定律和化学方程式的综合运用
4.为避免汽车尾气中的有害气体对大气的污染,目前最有效的方法是给汽车安装尾气净化装置,其净化原理是2NO+2CON2+xCO2。下列说法不正确的是 ( )
A.x=2
B.最终排放的汽车尾气是混合物
C.反应中氮元素的化合价由+2变为0
D.该反应生成的N2和CO2的质量比为1∶2
5.[2018·贵港]把8.9 g镁锌合金放入一定量的稀盐酸中,恰好完全反应,产生0.4 g H2,在上述反应后的溶液中滴入足量的NaOH溶液,充分反应后生成NaCl的质量为 ( )
A.23.4 g B.29.25 g
C.30.5 g D.26.25 g
6.[2019·衡阳]将一定量的丙醇(C3H8O)和氧气置于一个密封的容器中引燃,测得反应前后各物质的质量如下表所示。下列说法错误的是 ( )
物质
丙醇
氧气
水
二氧化碳
X
反应前质量/g
6.0
14.8
0
0.4
0
反应后质量/g
0
2
7.2
9.2
a
A.表中a的值为2.8
B.参加反应的氧气和生成二氧化碳的质量比为16∶11
C.X中一定含碳元素、氧元素
D.该反应属于分解反应
考点3 有关化学方程式的计算
7.某市石灰石资源丰富,一课外小组同学取石灰石样品12 g于烧杯中,向盛有样品的烧杯中加入足量一定溶质质量分数的稀盐酸充分反应,所用稀盐酸质量(用X表示)和烧杯中剩余固体质量(用Y表示)如图5-9所示(石灰石的主要成分是碳酸钙,杂质不溶于水也不与酸反应)。请计算下列问题。
图5-9
16
(1)石灰石中碳酸钙的质量是多少?
(2)充分反应后共生成多少克二氧化碳?
(3)所用稀盐酸的溶质质量分数是多少?
8.[2015·呼和浩特一模]有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如表所示:
甲
乙
丙
取用金属混合物的质量/g
10
10
20
取用稀硫酸的质量/g
100
200
100
反应后过滤,得干燥固体的质量/g
4
4
13
请分析数据,回答下列问题:
(1)10 g混合物中所含铁粉的质量为 。
(2)稀硫酸中溶质的质量分数为多少?(列式计算,写出相关的文字和计算过程)
(3)若取用金属混合物15 g,加入120 g稀硫酸中,充分反应后所得溶液中的溶质质量分数为 。(计算结果精确到0.1%)
16
9.[2019·泰安]长期使用的热水锅炉会产生水垢。水垢的主要成分是碳酸钙和氢氧化镁。某兴趣小组为了测定水垢中CaCO3的含量,将6 g水垢粉碎放在烧杯中,然后向其中加入40 g某浓度的稀盐酸,使之充分反应(水垢中除碳酸钙和氢氧化镁外都不与稀盐酸反应)。实验数据记录如下:
反应时间/min
0
1
2
3
4
5
6
7
8
烧杯内所盛物质的总质量/g
46.0
45.2
44.8
45.1
44.1
43.9
43.8
43.8
43.8
(1)表中有一数据是不合理的,该数据的测得时间是第 min。
(2)计算水垢中CaCO3的质量分数。(计算结果精确至0.1%)
10.[2019·宿迁]黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10 g粉末状黄铜样品放入烧杯中,量取45 mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如下表:
第一次
第二次
第三次
加入稀硫酸的体积/mL
15
15
15
生成氢气的质量/g
m
0.04
0.02
试求:
(1)m的数值为 。
(2)此黄铜样品中铜的质量分数。(写出计算过程)
16
【参考答案】
考题分层训练
夯实基础
1.B [解析]化学变化是生成新物质的变化,反应前后物质种类不同,因此,化学变化前后物质的种类一定发生改变;化学变化的实质是构成反应物分子的原子进行重新组合,形成生成物分子的过程;该过程中,分子种类一定改变,分子数目可能不变,原子种类、数目一定不变,所以说原子是化学变化中的最小微粒,因此,元素种类、质量不变,物质的质量总和不变。综合以上分析,化学反应前后肯定没有发生变化的是①原子数目,③元素种类,⑤原子种类,⑥物质的总质量。
2.A [解析]氢气具有可燃性,在氧气中燃烧生成水。
3.A [解析]化学方程式2KNO3+3C+SK2S+X↑+3CO2↑中,根据质量守恒定律可知,反应前后原子的种类和个数不变,K、N、S、O、C原子的个数在反应前为2、2、1、6、3,根据反应前后原子的数目不变,可推出X的化学式为N2。
4.B [解析]根据质量守恒定律,生成的D的质量为36 g+56 g-28 g=64 g,设D的相对分子质量为x,则
2A+3BC+2D
14 2x
28 g64 g
142x=28g64g x=16
则C和D的相对分子质量之比为14∶16=7∶8。
5.D [解析]本题考查微观示意图与化学变化的本质关系。由微观示意图知,该反应的化学方程式为2O2+CH4c+2H2O。根据化学反应前后原子的种类、个数均不发生改变可推知,c物质的化学式为CO2,故A、C错误;该反应前后元素的种类、质量不发生变化,符合质量守恒定律,B错误;由化学方程式可知,2个氧分子和1个甲烷分子发生反应,生成2个水分子和1个二氧化碳分子,反应前后分子个数保持不变,故D正确。
6.D [解析]根据微观示意图可知:CO2和H2在催化剂和加热的条件下转化为化工原料C2H4和H2O,反应的化学方程式为2CO2+6H2C2H4+4H2O。反应前氢气中氢元素的化合价为0,反应后水中氢元素的化合价为+1,所以反应前后各元素的化合价并不是不变的,故A错误;原子是化学变化中的最小粒子,所以在化学变化中原子没有发生改变,故B错误;所有的化学反应都遵循质量守恒定律,所以该反应也符合质量守恒定律,故C错误;参加反应的两种分子的个数比是2∶6=1∶3,故D正确。
7.D [解析]图示的反应化学方程式为4NH3+5O24NO+6H2O,甲为NH3,氮、氢原子个数比为1∶3;乙为O2,其相对分子质量为32;两种生成物为NO和H2O,它们均是由两种元素组成的纯净物,都是化合物;生成的
16
丙(NO)与丁(H2O)的分子个数比为化学式前的计量数之比,即4∶6=2∶3。
8.B [解析]本题考查的是质量守恒定律的知识点。根据图示可知,甲物质反应后质量分数减小,为反应物;乙物质反应后质量分数不变,可能为催化剂或者杂质;丙物质反应后质量分数增大,为生成物;丁物质反应后质量分数减小,为反应物,结合可知,化学方程式可能为甲+丁乙。该反应为化合反应,故A错误;甲可能是单质,如硫和氧气反应生成二氧化硫,故B正确;丙、丁的质量变化之比为(36%-25%)∶(48%-40%)=11∶8,故C错误;乙可能是杂质,故D错误。
9.C [解析]化学反应中,反应物质量减少,生成物质量增加。由表中实验数据可知,反应前后,甲减少了4.0 g-1.2 g=2.8 g,丙减少了3.0 g-2.4 g=0.6 g,丁增加了5.4 g-2.0 g=3.4 g,甲、丙减少的质量之和等于丁增加的质量,根据质量守恒定律,该反应可表示为甲+丙丁。参加反应的甲、丙质量比为2.8 g∶0.6 g=14∶3。
10.C [解析]由纯净物X在氧气中高温煅烧的化学方程式可知,生成物中有4个Fe原子,22个O原子,8个S原子,反应物中已有22个O原子,所以4X中含4个Fe原子和8个S原子,X中含1个Fe原子,2个S原子,化学式为FeS2。
11.D [解析]铁在氧气中燃烧生成的应该是四氧化三铁;磷在空气中点燃生成五氧化二磷,产生的是大量的白烟;将二氧化碳通入滴有紫色石蕊溶液的水中,生成碳酸,能使溶液颜色变为红色。
12.D [解析]铁在稀盐酸中发生反应生成物为FeCl2,不是FeCl3,化学方程式为Fe+2HClFeCl2+H2↑,故A错误;Ba(NO3)2溶液与稀盐酸混合时,不会产生沉淀、气体或水,该反应不能发生,故B错误;NaOH溶液与二氧化碳反应生成碳酸钠和水,碳酸钠的化学式为Na2CO3,反应的化学方程式为2NaOH+CO2Na2CO3+H2O,故C错误;乙醇在氧气中燃烧生成二氧化碳和水,反应的化学方程式为C2H5OH+3O22CO2+3H2O,故D正确。
13.(1)NaHCO3+HClNaCl+CO2↑+H2O
(2)Fe+CuSO4Cu+FeSO4
(3)CO2+Ca(OH)2CaCO3↓+H2O
(4)Fe2O3+6HCl2FeCl3+3H2O
14.(1)置换 氧化铁
(2)石油 A
[解析](1)单质铝和氧化铁在高温下反应生成单质铁和氧化铝,属于置换反应;化学反应中物质得到氧发生的是氧化反应,物质失去氧发生的是还原反应,该反应中氧化铁失去氧元素被还原成单质铁,发生了还原反应。(2)三大化石燃料中煤是固态、石油是液态、天然气是气态。题中所述两个反应中,前者是两种物质反应生成一种物质,属于化合反应,后者生成物有两种,不属于化合反应,A错误;两个反应的生成物一氧化碳、氢气都是可燃性气体,B正确;两个反应都是碳单质分别和氧化物二氧化碳、水反应,C正确。
16
15.C [解析]反应后产生的氢气质量为10 g+100 g-109.4 g=0.6 g。
设参加反应的铝的质量是x。
2Al+3H2SO4Al2(SO4)3+3H2↑
54 6
x 0.6 g
546=x0.6g x=5.4 g
铜的质量为10 g-5.4 g=4.6 g,
则合金样品中铜的质量分数是4.6g10g×100%=46%。
16.C [解析]本题主要考查有关不纯物质的化学方程式的计算。先利用纯度=纯物质质量不纯物质的质量×100%,求出纯净的氧化铁的质量,再利用化学方程式计算冶炼出铁的质量,最后再利用纯度公式算出生铁质量。
参加反应的Fe2O3的质量为1 000 t×80%=800 t。
设炼出生铁的质量为x。
Fe2O3+3CO2Fe+3CO2
160 112
800 t 97%×x
160112=800t97%×x x≈577 t
17.解:(1)生成氧气的质量为28.0 g-18.4 g=9.6 g。
(2)设原混合物中氯酸钾的质量为x。
2KClO32KCl+3O2↑
245 96
x 9.6 g
24596=x9.6g
x=24.5 g
答:(1)生成氧气的质量为9.6 g;(2)原混合物中氯酸钾的质量为24.5 g。
18.解:(1)氯化铵中氮元素的质量分数为1453.5×100%≈26.2%。
(2)设生产8.4 t碳酸氢钠,理论上需要氯化钠的质量为x。
NaCl+CO2+NH3+H2ONaHCO3+NH4Cl
58.5 84
16
x 8.4 t
58.584=x8.4t x=5.85 t
答:(1)氯化铵中氮元素的质量分数约为26.2%;(2)生产8.4 t 碳酸氢钠,理论上需要氯化钠的质量为5.85 t。
能力提升
1.B [解析]本题考查化学变化中的微观示意图。由该反应的微观示意图及反应中甲、乙、丙的质量比为23∶17∶1可知,该反应的化学方程式为2Na+2NH32NaNH2+H2。丙是H2,属于单质,故A正确;参加反应的乙与生成丙的分子个数比为2∶1,故B错误;物质X是NaNH2,由Na、N、H三种元素组成,故C正确;甲是金属钠,由钠原子直接构成,故D正确。
2.A [解析]炭粉和过量的氧气充分反应生成二氧化碳,反应方程式为C+O2CO2。气体的分子数等于化学计量数,所以反应前后气体的分子数不变,图像A正确;炭粉和氧气反应生成二氧化碳,气体的质量增加,图像B错误;因为炭粉的量少,所以反应完全,固体质量最后为零,图像C错误;根据质量守恒定律反应前后物质的总质量不变,该反应在一密闭容器中进行,所以物质总质量一直不变,图像D错误。
3.(1)2Mg+O22MgO
(2)大量的白烟弥漫到空气中,使得生成物收集不全
(3)实验探究取少量产物中的黄色固体放入试管中,加入适量的水,在试管口放置湿润的红色石蕊试纸
有刺激性气味的气体生成,试纸由红色变为蓝色;黄色固体是Mg3N2
反思与交流①-3
②氮气化学性质不如氧气活泼
③燃烧不一定需要有氧气参加
[解析](1)镁条在空气中燃烧生成氧化镁,化学方程式为2Mg+O22MgO。
(2)镁条燃烧的同时产生大量白烟,即有氧化镁固体小颗粒扩散到空气中,使收集到的产物不全,所以在石棉网上收集到的产物质量小于镁条的质量。
(3)实验探究根据查阅的资料可知:氮化镁可与水剧烈反应产生氨,该气体能使湿润的红色石蕊试纸变蓝;可以取少量黄色粉末放入试管内,加入适量水,用湿润的红色石蕊试纸来检验是否有氨放出,若试纸变蓝,则说明黄色粉末是氮化镁。反思与交流①化合物中各元素的化合价的代数和为0,设氮化镁中氮元素的化合价为x,则(+2)×3+2x=0,解得x=-3。②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,原因是氧气化学性质比氮气活泼,Mg更容易与氧气反应。③狭义的燃烧是可燃物与氧气发生的剧烈的发光、放热的氧化反应,广义上的燃烧不一定要有氧气的参与。
16
4.D [解析]本题考查质量守恒定律及其应用、纯净物和混合物的判别、有关元素化合价的计算。根据反应的化学方程式可知,反应物中碳、氮、氧原子个数分别为2、2、4,反应后的生成物中碳、氮、氧原子个数分别为x、2、2x,根据化学反应前后原子种类、数目不变,则x=2;根据化学方程式可知生成物是氮气和二氧化碳两种物质,属于混合物;反应前氮元素存在于一氧化氮中,化合价为+2,反应后氮元素存在于氮气中,化合价为0;该反应生成的氮气和二氧化碳的质量比为28∶(2×44)=7∶22。
5.A [解析]根据质量守恒定律,盐酸中的氯元素全部转化为氯化钠中的氯元素,氯元素质量守恒。
设生成NaCl的质量为x。
2HCl~H2 ~2NaCl
2 117
0.4 g x
2117=0.4gx
x=23.4 g
故生成NaCl的质量为23.4 g。
6.D [解析]a=6.0+14.8+0.4-2-7.2-9.2=2.8,故A正确;参加反应的氧气和生成二氧化碳的质量比为(14.8-2)∶(9.2-0.4)=16∶11,故B正确;X中碳元素质量为6.0×3660-(9.2 g-0.4 g)×1244=1.2 g,氧元素质量为6.0 g×1660+(14.8 g-2 g)-7.2 g×1618-(9.2 g-0.4 g)×3244=1.6 g,1.2g+1.6 g=2.8 g,故X中一定含碳元素、氧元素,故C正确;反应后丙醇、氧气质量减少,是反应物,水、二氧化碳和X质量增加,是生成物,不是分解反应,故D错误。
7.解:(1)石灰石中碳酸钙的质量为12 g-2 g=10 g。
(2)设生成二氧化碳的质量为x,反应消耗HCl的质量为y。
CaCO3+2HClCaCl2+H2O+CO2↑
100 73 44
10 g y x
10044=10gx x=4.4 g
10073=10gy y=7.3 g
(3)所用稀盐酸的溶质质量分数为7.3g50g×100%=14.6%。
答:(1)石灰石中碳酸钙的质量为10 g;(2)充分反应后共生成4.4 g二氧化碳;(3)所用稀盐酸的溶质质量分数为14.6%。
8.(1)6 g
16
(2)解:设100 g稀硫酸中含有溶质硫酸的质量为x。
由题可知10 g固体中含有6 g铁,20 g中含有12 g 铁,20 g混合物与100 g稀硫酸反应溶解铁7 g,所以此时100 g硫酸完全反应。
Fe + H2SO4FeSO4+H2↑,
56 98
7 g x
5698=7gx x=12.25 g
稀硫酸中溶质的质量分数为12.25g100g×100%=12.25%。
答:稀硫酸中溶质的质量分数为12.25%。
(3)17.8%
9.(1)3
(2)解:设6 g水垢中含有碳酸钙的质量为x。
CaCO3+2HClCaCl2+H2O+CO2↑
100 44
x 46.0 g-43.8 g
10044=x46.0g-43.8g
x=5 g
水垢中CaCO3的质量分数为5g6g×100%≈83.3%。
答:该水垢中CaCO3的质量分数为83.3%。
10.(1)0.04
(2)解:10 g样品反应生成氢气的质量为0.04 g+0.04 g+0.02 g=0.1 g。
设黄铜样品中锌的质量为x。
Zn+H2SO4ZnSO4+H2↑
65 2
x 0.1 g
652=x0.1g
x=3.25 g
故此黄铜样品中铜的质量分数为10g-3.25g10g×100%=67.5%。
答:此黄铜样品中铜的质量分数是67.5%。
16
16
相关文档
- 新课标RJ2020中考化学复习方案主题2021-11-127页
- 呼和浩特专版2020中考化学复习方案2021-11-118页
- 新课标RJ2020中考化学复习方案主题2021-11-117页
- 新课标RJ2020中考化学复习方案主题2021-11-1118页
- 新课标RJ2020中考化学复习方案主题2021-11-1133页
- 包头专版2020中考化学复习方案主题2021-11-1110页
- 中考化学专复习题试卷二物质的化学2021-11-1134页
- 中考化学总复习(人教版)精讲精练:专题2021-11-109页
- 河北专版2020中考化学复习方案主题2021-11-1022页
- 包头专版2020中考化学复习方案主题2021-11-1012页