- 249.50 KB
- 2021-11-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
化学实验
一. 教学内容:
化学实验
二. 教学过程:
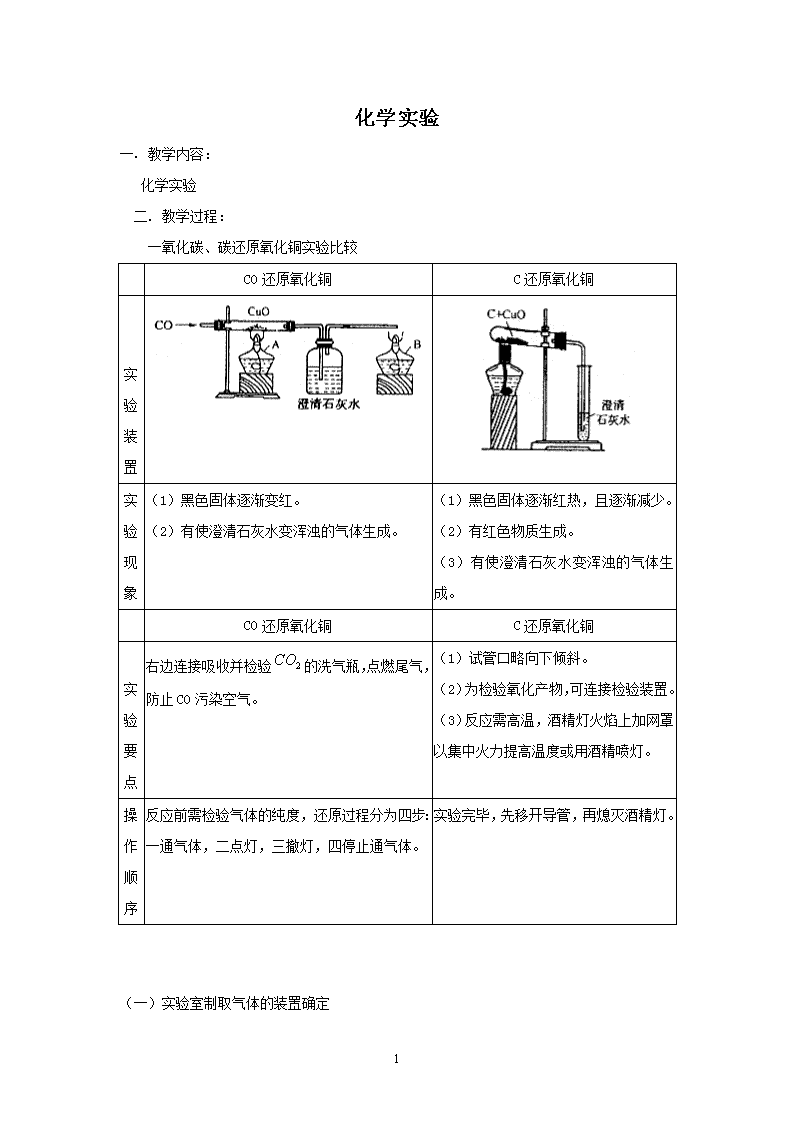
一氧化碳、碳还原氧化铜实验比较
CO 还原氧化铜 C 还原氧化铜
实
验
装
置
实
验
现
象
(1)黑色固体逐渐变红。
(2)有使澄清石灰水变浑浊的气体生成。
(1)黑色固体逐渐红热,且逐渐减少。
(2)有红色物质生成。
(3)有使澄清石灰水变浑浊的气体生
成。
CO 还原氧化铜 C 还原氧化铜
实
验
要
点
右边连接吸收并检验 CO2 的洗气瓶,点燃尾气,
防止 CO 污染空气。
(1)试管口略向下倾斜。
(2)为检验氧化产物,可连接检验装置。
(3)反应需高温,酒精灯火焰上加网罩
以集中火力提高温度或用酒精喷灯。
操
作
顺
序
反应前需检验气体的纯度,还原过程分为四步:
一通气体,二点灯,三撤灯,四停止通气体。
实验完毕,先移开导管,再熄灭酒精灯。
(一)实验室制取气体的装置确定
2
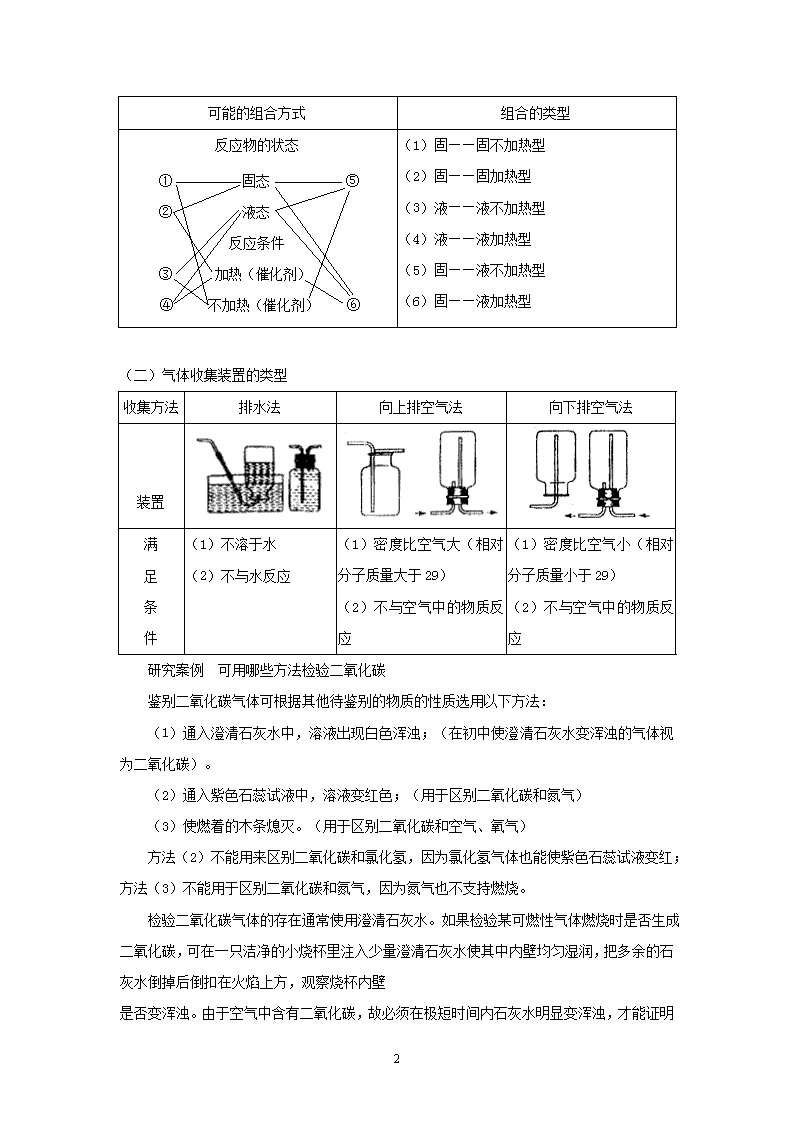
可能的组合方式 组合的类型
反应物的状态
① 固态 ⑤
② 液态
反应条件
③ 加热(催化剂)
④ 不加热(催化剂) ⑥
(1)固——固不加热型
(2)固——固加热型
(3)液——液不加热型
(4)液——液加热型
(5)固——液不加热型
(6)固——液加热型
(二)气体收集装置的类型
收集方法 排水法 向上排空气法 向下排空气法
装置
满
足
条
件
(1)不溶于水
(2)不与水反应
(1)密度比空气大(相对
分子质量大于 29)
(2)不与空气中的物质反
应
(1)密度比空气小(相对
分子质量小于 29)
(2)不与空气中的物质反
应
研究案例 可用哪些方法检验二氧化碳
鉴别二氧化碳气体可根据其他待鉴别的物质的性质选用以下方法:
(1)通入澄清石灰水中,溶液出现白色浑浊;(在初中使澄清石灰水变浑浊的气体视
为二氧化碳)。
(2)通入紫色石蕊试液中,溶液变红色;(用于区别二氧化碳和氮气)
(3)使燃着的木条熄灭。(用于区别二氧化碳和空气、氧气)
方法(2)不能用来区别二氧化碳和氯化氢,因为氯化氢气体也能使紫色石蕊试液变红;
方法(3)不能用于区别二氧化碳和氮气,因为氮气也不支持燃烧。
检验二氧化碳气体的存在通常使用澄清石灰水。如果检验某可燃性气体燃烧时是否生成
二氧化碳,可在一只洁净的小烧杯里注入少量澄清石灰水使其中内壁均匀湿润,把多余的石
灰水倒掉后倒扣在火焰上方,观察烧杯内壁
是否变浑浊。由于空气中含有二氧化碳,故必须在极短时间内石灰水明显变浑浊,才能证明
3
产生的气体是二氧化碳。
案例二 可用哪些方法区别二氧化碳和一氧化碳
研究思路 鉴别物质是根据物质的物理性质或化学性质的差异,把它们区别开来的过
程。对于一氧化碳和二氧化碳这两种气体,它们都是无色无味的气体,密度和溶解性比较起
来很不方便,因此不能用物理方法将它们鉴别开来。这两种物质的化学性质有很大的差异:
(1)一氧化碳具有可燃性,燃烧时发出蓝色的火焰;二氧化碳在一般情况下既不能燃烧又
不支持燃烧;(2)一氧化碳具有还原性,能还原某些金属氧化物;(3)二氧化碳能跟水化
合生成碳酸,碳酸能使紫色石蕊试液变红色;(4)二氧化碳能使澄清石灰水变浑浊;(5)
一氧化碳能与血红蛋白化合,使深红色的血液变成鲜红色。
鉴别方法 方法一:用一根燃着小木条分别伸到集气瓶口,能点燃的是一氧化碳,熄灭
的是二氧化碳。
方法二:将两种气体分别通过灼热的氧化铜,能使黑色氧化铜变成光亮红色铜的气体是
一氧化碳,另一种气体是二氧化碳。
方法三:用湿润的紫色石蕊试纸检验气体,能使试纸变红色的气体是二氧化碳(这是因
为二氧化碳跟试纸上的水反应生成了碳酸),另一种气体是一氧化碳。
方法四:将气体分别跟石灰水作用,能使石灰水变浑浊的是二氧化碳,另一种气体是一
氧化碳。
方法五:将气体分别通入新鲜鸭血中,能使深红色的鸭血变成鲜红色的是一氧化碳,另
一种是二氧化碳。
物质性质的实验
氧气化学性质的实验如下表所示:
4
与氧气反
应的物质
现象 化学方程式
木炭
剧烈燃烧,发光,放热产生使澄清石灰
水变浑浊的气体。 C O CO 2 2
点燃
硫
空气
氧气
在空气中燃烧放热,产生淡蓝色火焰。
在氧气中燃烧产生明亮的蓝紫色火焰。
均产生有刺激性气味的气体。
S O SO 2 2
点燃
红磷 剧烈燃烧,冒白烟,黄色火焰,放热。 4 5 22 2 5P O P O 点燃
铁丝
剧烈燃烧,放热,火星四射,生成黑色
固体。 3 2 2 3 4Fe O Fe O 点燃
铝
剧烈燃烧,放热,发出耀眼的白光,生
成白色固体。 4 3 22 2 3Al O Al O 点燃
石蜡
剧烈燃烧,发出白光,有火焰,生成水
和使澄清石灰水变浑浊的气体。
【典型例题】
例 1. 不能用质量守恒定律解释的现象是( )
A. 蜡烛燃烧后,越来越短,最终消失
B. 铁丝燃烧,其固体质量增加
C. 潮湿的衣服在阳光下晾干
D. 高锰酸钾受热后,固体质量减少
例 2. 下列各图中所示的化学实验操作不正确的是( )
例 3. 从防止空气污染考虑,下列实验应在通风橱中进行的是( )
5
例 4. 扑灭图书档案、贵重设备、精密仪器等火灾,不会留下任何痕迹而使物品损坏,
最适宜的灭火器具是( )
例 5. 下列实验操作错误的是( )
例 6. 在探究 CO2 和 NaOH 是否发生化学反应时,某同学设计出下列三种实验装置。
(1)三个实验是否都能证明 CO2 跟 NaOH 发生了化学反应?
__________________________
(2)分别写出实验①、②所能看到的实验现象:
实验①__________________;实验②__________________。
(3)请进一步设计实验来证明 CO2 和 NaOH 肯定发生了化学反应(简述实验操作步
骤、现象及结论)
____________________________________________________
答案:(1)能
6
(2)试管内液面上升,并充满试管;塑料瓶变扁。
(3)取少量反应后的溶液于试管中,滴入稀盐酸,如果出现气泡,则说明 CO2 确实跟
NaOH 发生了化学反应。
例 7. 下列实验操作图中,各有一处错误需改正,将改正的内容填在相应的空格中(用
文字叙述)
实验
内容
铁丝在氧气中燃烧 用滴管滴加液体 加热液体药品 用向上排空气法收
集气体
实
验
操
作
图
改正
答案:集气瓶底放少量水;胶头滴管竖直,不能进入试管口;试管内液体不要超过容积
1
3 ;导气管应伸入集气瓶底
例 8. 在日常生活中,燃烧现象屡见不鲜。你想过没有:发生燃烧的条件是什么?下面请
你从提供的 6 个实验中,选择合适的实验来探究这一问题。
实验假设 实验内容(填
序号)
实验现象 实验结论
(1)可能与物质有
[实验 1]应选
择实验
_____________燃烧;_____________
没有燃烧
物质燃烧必须满
足的条件:物质
7
关 ________、
________
具有可燃性
(2)可能与
________
________________
[实验 2]应选
择实验
________、
________
_______________________________;
_______________________________ 要 与 __________
接触
(3)可能与
________
________________
[实验 3]应选
择实验
________、
________
_____________;
_____________
_____________
_____________
【模拟试题】
填空题。
1. 化学反应常伴随着能量的变化,通常表现为_____________的变化。这就是化学反应中
的_____________或_____________现象。如碳在氧气中燃烧_____________热量,碳与二氧
化碳反应_____________热量。化学反应放出的热是一种重要的_____________,人们可直接
利用,如_____________、_____________等。
2. 目前,人类通过_____________获得的能量,大多来自于_____________,而化石燃料
资源是有限的。因此,控制燃烧反应,使燃料_____________燃烧,对于_____________非常
重要。
3. 使燃料充分燃烧通常需要考虑两点:一是____________________________________;
二是_______________________________________。燃料燃烧不完全,不仅_____________,
而且还会_______________________________________。
4. 煤燃烧后的主要产物是_____________________,为什么有时能闻到一股刺激性气味?
____________________。把煤加工成蜂窝煤的主要目的是__________________________。
5. 氢气是未来的理想能源,水是自然界广泛存在的物质,用水生产大量的氢气是人类梦
寐以求的愿望,但是这一转化过程又需要大量能源。能提供既经济又不污染环境的理想的三
种能源(或方法)_______________________________________。
6. 甲烷、煤、石油、酒精等物质中,由于含有_____________两种共同元素,因此当它们
8
燃烧时都会生成_____________和_____________,而其中_____________和_____________
燃烧会产生 SO2 等大气污染物。
7. 厄尔尼诺现象产生的原因之一是大气中的二氧化碳剧增,为减缓此现象,最理想的燃
料是_____________。
8. 为了保护我们人类赖以生存的地球,应该限制二氧化碳的排放量,以控制日趋严重的
温室效应。
(1)科学家采取“组分转化”技术,将 CO2 和 H2 以一定比例混合,在一定条件下反
应,生成一种重要的化工原料和水。反应的化学方程式为 2 6 1 42 2 2CO H H O ( ) ,
括号内重要的化工原料的化学式为_____________;
(2)为了减缓大气中 CO2 含量的增加,以下建议可行的是(填序号)_____________。
①大量植树造林,禁止乱砍乱伐;
②禁止使用煤、石油、天然气等化石燃料;
③更多地利用核能、太阳能、风能、地热等。
9. 城市大气污染主要来源于工业污染和汽车尾气,99%的一氧化碳和一氧化氮的排放来源
于汽车尾气。我市近几年来汽车持有量的增长达 20%,环保面临着汽车污染的考验。
另据报道:将氢气应用于汽车发动机的技术已在我国研制成功;酒精为燃料的汽车已在
北京市、河南省使用;我市也有一部分汽车改用液化气为燃料。
(1)汽车尾气中的大气污染物有_____________(写化学式)。
(2)我市将部分汽车排气管加装三效转换器,促使一氧化碳在排气管内与空气作用转
化为二氧化碳,其反应方程式为__________________________。
(3)请提出我市治理汽车污染的一条合理化建议__________________________。
(4)就目前的情况看,氢气做燃料的汽车要投入使用前,你认为还需要研究解决的问
题有__________________________。
10. 小飞同学在调查大气污染可能因素时搜集了以下一些信息:
(1)工业废气的任意排放;
(2)人和动物呼出的气体;
(3)煤和石油的燃烧;
(4)飞机、汽车尾气的排放;
9
(5)燃放鞭炮;
(6)太阳能的使用。
请你帮他分析一下,可能引起空气污染的因素有_____________,为了改善空气质量,
可以采取的措施有哪些?请你列举至少三项。
答:(1)_____________;(2)_____________;(3)_____________。
11. 下面是一些常见气体的发生装置和收集装置,回答下列问题。
(1)选用如下图所示的代号(A、B、C、D、E)填入下表:
实验室制取气体 发生装置 收集装置
氧气(加热高锰酸钾)
氧气(过氧化氢)
二氧化碳
(2)在向气体发生装置装入药品前,必须检查装置的_____________。
(3)用排水法收集氧气实验结束前,必须先将_____________,然后_____________。
(4)D 中导气管必须放入集气瓶接近底部是为了_____________。
(5)图 B 中反应物的状态为_____________,反应条件为_____________;导管刚刚露
出橡皮塞的目的是为了_______________________________________。
(6)图 A 中反应物的状态为_____________,反应条件为_____________;其中试管口
要略低于试管底是为了防止_____________,酒精灯要用_____________焰进行加热。
(7)实验室制氧气可用加热___________________的方法,这个反应的化学方程式为
_______________________________________,该反应的条件为_____________,反应物的状
态为_____________,反应的发生装置为上图的_____________;实验室制氧气也可用将
_____________和_____________混合的方法,其中_____________起_____________作用,该
反应的化学方程式为__________________________,由于反应物分别为_____________态和
_____________态,反应条件为_____________,所以发生装置应选用_____________。收集
氧气可以选用_____________法和_____________法,因为氧气_____________。
10
(8)实验室制二氧化碳用_____________和_____________混合的方法,化学方程式为
________________________,在该反应中能否用稀硫酸来代替上述酸?_____________,原
因是__________________________。
由于反应物的状态分别是________态和________态,反应条件为_________________,
发生装置应选用_____________,收集方法为_____________法,因为_____________。
(9)由上述讨论可知,选择气体的发生装置的依据是__________________________;
收集方法的依据是__________________________。
(10)硫化氢( H S2 )是一种无色有臭鸡蛋气味的有毒气体,它的密度比空气大且能
溶于水,实验室常用块状硫化亚铁和稀硫酸反应来制得硫化氢气体。
分析:
a. 反应物及其状态:
一种反应物是_____________,为_____________态,另一种反应物是_____________,
为_____________态;反应条件_____________。
b. 生成气体的有关知识:溶解性_____________溶于水;密度_____________于空气。
结论:发生装置选用_____________,收集装置选用_____________。
12. 如下图所示的装置有多种用途,请回答下列问题:
(1)检验:证明 O2 中混有 CO2 的装置内应盛_____________。
(2)贮气:
①若用排空气法收集 H2 时,气体从装置_____________端通入,若用排空气法收集 CO2
时,气体从装置_____________端通入。
②若用排水法收集 O2 时,瓶内先装满水,气体从装置_____________端通入。
③若要用水将装置中的氧气排出进行实验时,水应从_____________端通入。
11
【试题答案】
填空题。
1. 热量,吸收,放出,放出,吸收,能源,取暖,做饭
2. 化学反应,化石燃料,充分,节约能源
3. 燃烧时要有足够多的空气( O2 ),燃料与空气( O2 )要有足够大的接触面,燃料燃
烧产生的热量减少,浪费资源,产生大量的 CO
4. CO SO2 2, ,增大煤与空气( O2 )的接触面积
5. 太阳能,地热能,风能
6. C H CO H O, , ,2 2 ,煤,石油
7. H2
8. (1) C H2 4 ;(2)①③
9. (1) CO NO NO, , 2
(2) 2 22 2CO O CO 催化剂
(3)略
(4)降低制取 H2 的成本, H2 的贮存、运输问题
10. (1)(3)(4)(5),措施略
11. (1)
实验室制取气体 发生装置 收集装置
氧气(加热高锰酸钾) A C 或 D
氧气(过氧化氢) B C 或 D
二氧化碳 B D
(2)气密性
(3)导管移出液面,熄灭酒精灯
(4)将空气排净
(5)固、液,常温,有利于 O2 的排出
(6)固,加热,冷凝的液体倒流到试管底而炸裂,外
12
(7) KMnO KMnO K MnO MnO O4 4 2 4 2 22; ;加热;固态;A;双氧水;
MnO MnO2 2; ;催化作用;2 22 2
2
2 2H O
MnO
H O O ;固;液;常温;B;排水;向
上排空气;不易溶于水,不与水反应, O2 比空气略重,不与空气中的物质反应
(8)大理石;稀盐酸; CaCO HCl CaCl CO H O3 2 2 22 ;否; CaSO4 微溶
于水,覆盖在大理石表面,大理石不与盐酸接触,反应终止;固;液;常温;B;排空气(向
上); CO2 能溶于水并与水反应, CO2 比空气重,不跟空气中的物质反应
(9)反应物状态是否加热使用催化剂等;在水中的溶解度是否与水反应,密度比空气
大小,是否与空气中的物质反应
(10)a. FeS ,固,稀 H SO2 4 ,液,常温
b. 能,大于,B,D
12. 澄清石灰水;①B,A;②B;③A
相关文档
- 北京市2020年中考化学真题试卷(含解2021-11-1217页
- 2019年湖南省湘西州中考化学试卷含2021-11-1210页
- 中考化学一轮专题复习:实验基本操作2021-11-123页
- 中考化学专项练习——实验探究题(四2021-11-124页
- 安徽专版2020中考化学复习方案课时2021-11-127页
- 2020年陕西省西北工业大学附中中考2021-11-1224页
- 2019年四川省自贡市中考化学试题(wo2021-11-128页
- 新课标RJ2020中考化学复习方案主题2021-11-1210页
- 广东省深圳市2020年中考化学模拟试2021-11-1220页
- 北京专版2020中考化学复习方案实验2021-11-1244页