- 961.82 KB
- 2021-11-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时训练(十五) 金属的化学性质
|夯实基础|
1.[2019·扬州]下列金属中,金属活动性最强的是 ( )
A.钾 B.铁 C.铜 D.金
2.[2019·南宁]下列金属不能跟稀盐酸反应产生氢气的是 ( )
A.银 B.锡 C.铝 D.镁
3.[2019·郴州]把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是 ( )
A.溶液蓝色变浅直至无色
B.铁钉表面析出红色物质
C.产生大量气泡
D.溶液质量增加
4.[2018·盐城]分别把X、Y、Z三种金属加入稀盐酸中,只有Z表面无现象。Y加入X的硝酸盐溶液中,有X析出。则三种金属的活动性顺序是( )
A.Y>X>Z B.X>Y>Z
C.X>Z>Y D.Z>Y>X
5.[2019·荆州]将某稀硫酸分成两等份,分别向其中加入锌粉或铁粉,反应结束后剩余的铁比剩余的锌多,产生氢气分别为a g和b g,则a和b的关系是 ( )
A.ab D.无法判断
6.[2019·衡阳]向CuO和铁粉的混合物中加入一定量的稀硫酸,微热,充分反应后冷却、过滤,在滤液中加入一枚洁净的铁钉,发现铁钉表面无任何变化。据此判断,下列结论正确的是 ( )
A.滤液中一定含有FeSO4、H2SO4
B.滤渣里一定有Cu
C.滤液中可能有CuSO4、H2SO4
D.滤渣里一定有Cu和Fe
7.[2019·北京]用粗木棍在涂有蜡的锌板上写“明”“和”两个字,露出下面的锌板,向“明”字上滴加CuSO4溶液,向“和”字上滴加盐酸。
图Z15-1
(1)“明”字上的现象是 。
(2)“和”字上产生气泡,用化学方程式解释: 。
8.根据下面部分金属的活动性顺序回答:
8
图Z15-2
(1)上述金属中活动性最强的是 。
(2)按年代最早被广泛使用的金属是 。
(3)已知:①X+H2SO4XSO4+H2↑;
②Y+2ZNO3Y(NO3)2+2Z;
③Y与稀硫酸不反应。
则符合要求的X、Y、Z分别是 (填序号)。
A.Cu、Hg、Ag B.Fe、Cu、Ag
C.Mg、Zn、Fe
9.[2018·淮安节选]某课外活动小组进行如下实验探究。验证锌与铁的金属活动性:
图Z15-3
(1)相同条件下,取等质量锌粉、铁粉,根据图Z15-3进行实验,实验过程中,观察到锌粉表面产生气泡的速率比铁粉快,由此得到的结论是 。
(2)实验结束后,发现U形管两边的金属粉末均无剩余,则硫酸剩余的情况可能是 (填序号)。
A.左、右两边均有剩余
B.左边有剩余,右边无剩余
C.左、右两边均无剩余
D.左边无剩余,右边有剩余
|拓展提升|
1.[2019·重庆B]假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁)”,下列物质最可能是“强水”的是 ( )
A.硫酸亚铁溶液 B.稀盐酸
C.浓硝酸和浓盐酸的混合物 D.稀硫酸
2.[2018·连云港]已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。下列说法正确的是 ( )
A.X氧化物的化学式只能表示为XO
B.Y能将X从它的盐溶液中置换出来
C.Z在自然界中只能以单质形式存在
D.三种金属的活动性顺序:X>Y>Z
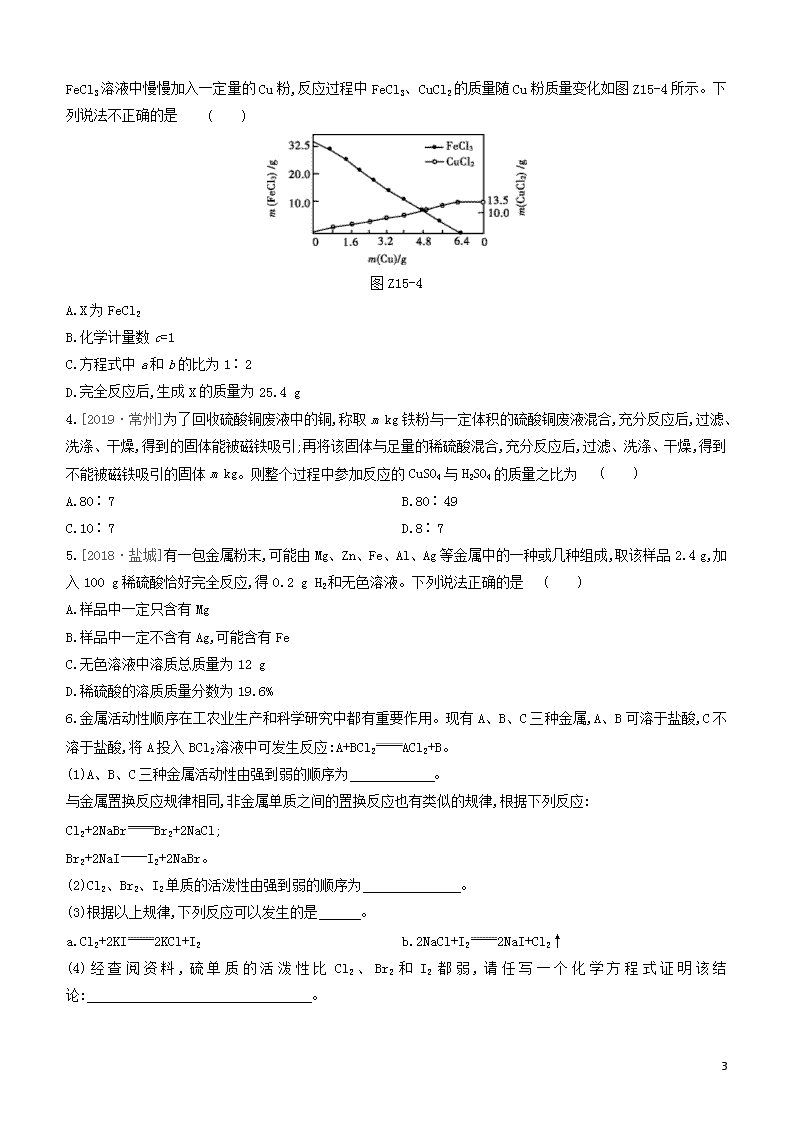
3.[2017·南通]FeCl3溶液常用于蚀刻印刷电路,反应原理为aFeCl3+bCucCuCl2+dX。向含溶质32.5 g的
8
FeCl3溶液中慢慢加入一定量的Cu粉,反应过程中FeCl3、CuCl2的质量随Cu粉质量变化如图Z15-4所示。下列说法不正确的是 ( )
图Z15-4
A.X为FeCl2
B.化学计量数c=1
C.方程式中a和b的比为1∶2
D.完全反应后,生成X的质量为25.4 g
4.[2019·常州]为了回收硫酸铜废液中的铜,称取m kg铁粉与一定体积的硫酸铜废液混合,充分反应后,过滤、洗涤、干燥,得到的固体能被磁铁吸引;再将该固体与足量的稀硫酸混合,充分反应后,过滤、洗涤、干燥,得到不能被磁铁吸引的固体m kg。则整个过程中参加反应的CuSO4与H2SO4的质量之比为 ( )
A.80∶7 B.80∶49
C.10∶7 D.8∶7
5.[2018·盐城]有一包金属粉末,可能由Mg、Zn、Fe、Al、Ag等金属中的一种或几种组成,取该样品2.4 g,加入100 g稀硫酸恰好完全反应,得0.2 g H2和无色溶液。下列说法正确的是 ( )
A.样品中一定只含有Mg
B.样品中一定不含有Ag,可能含有Fe
C.无色溶液中溶质总质量为12 g
D.稀硫酸的溶质质量分数为19.6%
6.金属活动性顺序在工农业生产和科学研究中都有重要作用。现有A、B、C三种金属,A、B可溶于盐酸,C不溶于盐酸,将A投入BCl2溶液中可发生反应:A+BCl2ACl2+B。
(1)A、B、C三种金属活动性由强到弱的顺序为 。
与金属置换反应规律相同,非金属单质之间的置换反应也有类似的规律,根据下列反应:
Cl2+2NaBrBr2+2NaCl;
Br2+2NaII2+2NaBr。
(2)Cl2、Br2、I2单质的活泼性由强到弱的顺序为 。
(3)根据以上规律,下列反应可以发生的是 。
a.Cl2+2KI2KCl+I2 b.2NaCl+I22NaI+Cl2↑
(4)经查阅资料,硫单质的活泼性比Cl2、Br2和I2都弱,请任写一个化学方程式证明该结论: 。
8
7.[2019·德州]我们通过学习知道:钠原子结构示意图为,钠原子在化学反应中易 电子,成为 (填名称)。
(1)“在金属活动顺序里,位于前面的金属能把位于后面的金属从其盐溶液里置换出来”,金属钠排在铜的前面,有的同学据此推断:钠能从蓝色硫酸铜溶液中把铜置换出来。教师按照下列图示顺序进行演示实验,并记录实验
现象:
图Z15-5
①由以上实验现象得出结论:因为反应中没有 色的物质生成,所以金属钠 (填“能”或“不能”)把铜从硫酸铜溶液中置换出来。
②对实验涉及的物质进行分析:硫酸铜溶液中溶剂为水,溶质为 (填化学式)。钠与硫酸铜溶液反应后培养皿中所含元素有Na、Cu、H、O、 (填元素符号)五种元素,查阅资料得知:“蓝色絮状难溶物”是一种学过的碱,该物质的名称是 。
(2)有的同学又产生新的疑问:钠能否与水发生反应?生成物是什么?
教师为解答学生的疑惑,又设计并进行如下实验,同时记录有关现象:
图Z15-6
请结合图示信息,回答下列问题。
①用手触摸图丙中烧杯外壁,感觉烫手,说明钠与水发生的是 (填“吸热”或“放热”)反应。
②从“图丙”中可以断定:液体中出现红色说明反应后液体显 性,结合液体中所含元素,继而推断有
8
(填化学式)生成。另外,钠与水反应还生成一种可燃性气体单质,请写出钠与水反应的化学方程式: 。
8.[2018·徐州]为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生,写出锌和稀硫酸反应的化学方程式: 。老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
[提出问题]
铜与浓硫酸反应的生成物是什么?其中气体是什么?
[猜想假设]
同学们对产生的气体作出了猜想。
猜想一:氢气;
猜想二:二氧化硫;
猜想三:氢气和二氧化硫的混合物。
[查阅资料]
(1)二氧化硫可以使品红溶液褪色,也能和碱性溶液反应;
(2)H2+CuOCu+H2O。
[实验探究]
师生设计了如下装置进行实验(部分仪器省略),请完成下列表格。
图Z15-7
主要实验步骤
主要现象
解释或结论
①加热装置A一段时间
装置B中的现象是
有二氧化硫生成
②点燃装置D处酒精灯
装置D玻璃管中无明显现象
猜想 正确
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气
④冷却,将A中液体用水稀释
A中液体变为 色
有硫酸铜生成
[表达交流]
(1)在步骤③中,鼓入空气的目的是 。
(2)请完成铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)CuSO4+SO2↑+ 。
[反思拓展]
(1)若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是 。
8
(2)下列各组药品能够证明锌的活动性比铜强的是 (填序号)。
①锌、铜、稀盐酸
②锌、硫酸铜溶液
③锌、铜、氯化镁溶液
8
【参考答案】
夯实基础
1.A 2.A 3.B 4.A
5.B [解析]根据题意判断稀硫酸完全反应,生成氢气的质量取决于稀硫酸的质量,反应消耗稀硫酸的质量相等,产生的氢气质量相等。
6.B [解析]在滤液中加入一枚洁净的铁钉,发现铁钉表面无任何变化,说明滤液中不含有硫酸铜、硫酸;稀硫酸和氧化铜反应生成硫酸铜和水,硫酸铜和铁反应生成硫酸亚铁和铜,滤渣中含有铜,不一定含有铁。
7.(1)“明”字位置逐渐出现红色固体,溶液由蓝色变为无色
(2)Zn+2HClZnCl2+H2↑
8.(1)Mg (2)Cu (3)B
9.(1)锌比铁活泼 (2)AB
拓展提升
1.C 2.D
3.C [解析]铜具有还原性,将+3价的铁还原为+2价的铁,X为氯化亚铁;反应原理为2FeCl3+CuCuCl2+2FeCl2,c=1,a与b的比为2∶1;根据质量守恒定律,并结合图像可知,生成的FeCl2的质量为25.4 g。
4.A [解析]假设m的值为64,溶液中硫酸铜的质量为64 kg64160×100%=160 kg,设生成64 kg的铜需要铁的质量为x。
Fe+CuSO4FeSO4+Cu
56 64
x 64 kg
5664=x64 kg x=56 kg
则与硫酸反应的铁的质量为64 kg-56 kg=8 kg。
设参与反应的H2SO4的质量为y。
Fe + H2SO4FeSO4+H2↑
56 98
8 kg y
5698=8 kgy y=14 kg
因此整个过程中参加反应的CuSO4与H2SO4的质量之比为160 kg∶14 kg=80∶7。
5.C [解析]加入100 g稀硫酸恰好完全反应,得0.2 g H2和无色溶液,说明样品中不含有银、铁;反应生成0.2 g氢气,说明参加反应的H2SO4质量是9.8 g,稀硫酸的溶质质量分数为9.8 g100 g×100%=9.8%;要生成0.2 g氢气,有3种可能:①2.4 g镁,②2.4 g铝、锌混合物,③2.4 g镁、锌、铝混合物;不论是哪种情况,反应的金属的质量都是2.4 g,则无色溶液中溶质总质量为2.4 g+9.8 g-0.2 g=12 g。
6.(1)A>B>C (2)Cl2>Br2>I2 (3)a
(4)I2+Na2S2NaI+S(合理即可)
[解析](1)根据题意,A、B可溶于盐酸,C不溶于盐酸,可知A、B的金属活动性比C强;根据将A投入BCl2
8
溶液中可发生反应:A+BCl2ACl2+B,可知A的金属活动性比B强,所以A、B、C三种金属活动性由强到弱的顺序为A>B>C。(2)由反应可知:Cl2能把Br2从NaBr溶液中置换出来,说明Cl2的活泼性大于Br2;Br2能把I2从NaI溶液中置换出来,说明Br2的活泼性大于I2;由此可知Cl2、Br2、I2非金属活泼性由强到弱的顺序是Cl2>Br2>I2。(3)Cl2的活泼性大于I2,反应Cl2+2KI2KCl+I2可以发生,反应2NaCl+I22NaI+Cl2↑不能发生。(4)要想证明硫单质的活泼性比Cl2、Br2和I2都弱,只要证明硫单质的活泼性比I2弱即可,化学方程式为I2+Na2S2NaI+S。
7.失去 钠离子
(1)①红 不能 ②CuSO4 S 氢氧化铜
(2)①放热
②碱 NaOH 2Na+2H2O2NaOH+H2↑
[解析]本题是对物质性质的探究、金属活动性顺序的应用。从钠原子的结构示意图可以看出,钠原子最外层电子数是1,在化学反应中易失去电子形成钠离子。(1)①将钠放入硫酸铜溶液中,形成蓝色絮状沉淀,而没有生成红色物质,则说明钠不能把铜从硫酸铜溶液中置换出来。②硫酸铜溶液中溶质是硫酸铜,溶剂是水,硫酸铜的化学式是CuSO4;钠由钠元素组成,硫酸铜由铜元素、硫元素、氧元素组成,水由氢元素和氧元素组成,根据反应前后元素种类不变,则反应后培养皿中所含元素有Na、Cu、H、O、S;蓝色絮状沉淀是一种碱,而碱由金属离子(或铵根离子)和氢氧根离子构成,则蓝色的碱是氢氧化铜。(2)①将钠放入滴有酚酞试液的蒸馏水中,烧杯外壁发烫则说明钠与水反应放热。②无色酚酞试液变红则说明反应后溶液显碱性;反应物是钠、水,结合质量守恒定律可以判断出生成的碱性物质是NaOH,生成的一种可燃性气体单质是氢气,据此可写出钠与水反应的化学方程式。
8.Zn+H2SO4ZnSO4+H2↑
[实验探究] 品红溶液褪色 二 蓝
[表达交流] (1)将装置A中生成的二氧化硫气体全部排出,使其被NaOH溶液充分吸收,防止污染空气 (2)2H2O
[反思拓展] (1)黑色固体变成红色,玻璃管内壁有水雾出现 (2)①②
[解析]锌与稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4ZnSO4+H2↑。
[反思拓展] (1)装置A中铜丝换成锌片,则锌与稀硫酸反应,生成氢气,装置D玻璃管中的氧化铜被还原,生成单质铜和水,看到的现象是黑色固体变成红色,玻璃管内壁有水雾出现。(2)①将锌、铜加入稀盐酸中,锌反应有气泡冒出,铜不反应,无现象,说明铜位于氢的后面,锌位于氢的前面,能证明锌和铜的活动性强弱,故能达到目的;②将锌放入硫酸铜溶液中,锌的表面置换出红色的铜,说明锌的活动性比铜强,故能达到目的;③将锌和铜分别放入氯化镁溶液中均无明显现象,无法比较锌和铜的金属活动性强弱,故不能达到目的。
8