- 887.08 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019年中考理综(化学部分)真题试题
可能用到的相对原子质量H-1 C-12 O-16 Na-23 Mg-24 A1-27 S-32 C1-35.5
注意事项:
1.本试卷分为试题卷(1-6页)和答题卡两部分。满分50分,与物理同堂,考试时间共120分钟。
2.考生答题前,请先将姓名、准考证号等信息用黑色墨迹签字笔填写在答题卡上的指定位置,待监考员粘贴条形码后,认真核对条形码上的姓名、准考证号与自己准考证上的信息是否一致。
3.请将选择题答案用2B铅笔填涂在答题卡上的相应位置,非选择题直接用黑色墨迹签字笔在答题卡上书写答案。超出答题区域书写的答案无效,在草稿纸、试题卷上答题无效。
4. 考试结束,监考员必须将参考学生和缺考学生的答题卡、试题卷一并收回。
一、选择题(每小题只有一个选项符合题意,请将正确选项填涂在答题卡上的相应位置。本题共12小题,每小题1.5分,共18分)
1、下列变化属于化学变化的是
A.冰雪融化 B.铜变成铜绿 C. 湿衣服晒干 D.胆矾研碎成粉末
2、下列物质属于纯净物的是
A.食盐水 B.豆浆 C.冰水混合物 D.水泥砂浆
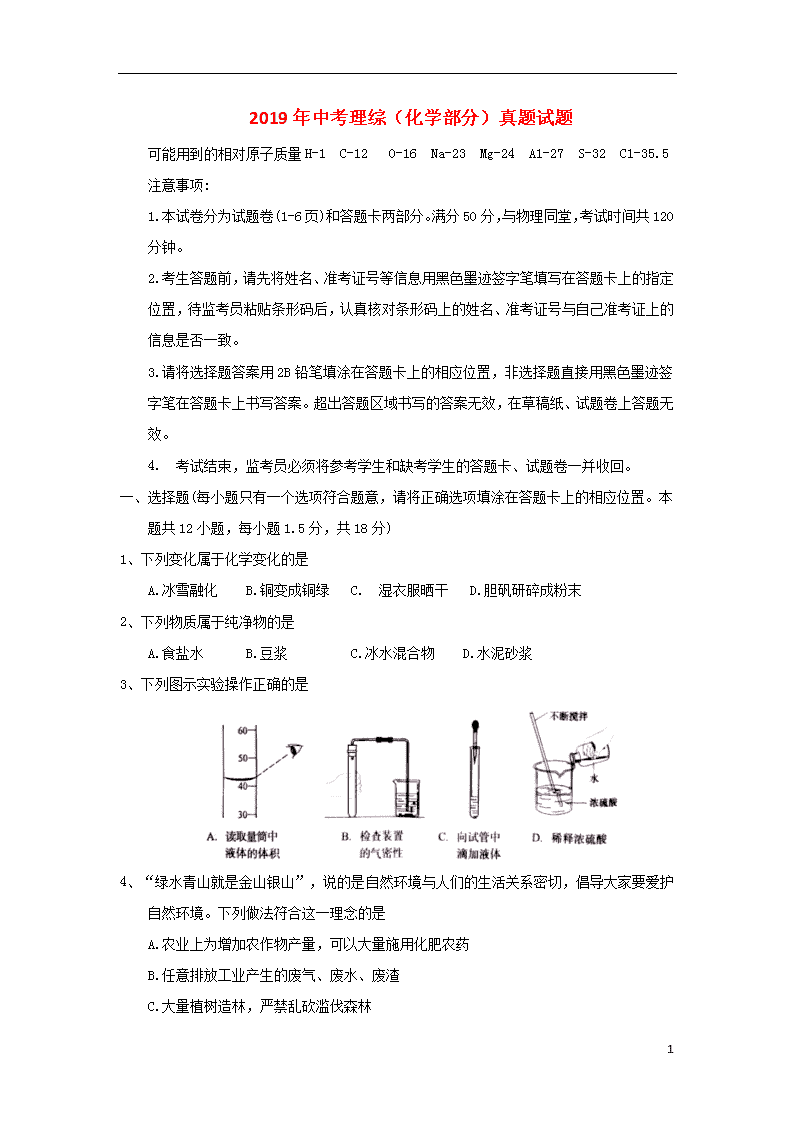
3、下列图示实验操作正确的是
4、“绿水青山就是金山银山”,说的是自然环境与人们的生活关系密切,倡导大家要爱护自然环境。下列做法符合这一理念的是
A.农业上为增加农作物产量,可以大量施用化肥农药
B.任意排放工业产生的废气、废水、废渣
C.大量植树造林,严禁乱砍滥伐森林
9
D.采取就地掩埋的方法来处理各种生活垃圾
5、下列关于物质的应用及原因分析正确的是
选项
应用
原因分析
A
6000L氧气可加压装入40L钢瓶中
氧分子变小了
B
自来水的净化过程中用活性炭除去异味
活性炭具有吸附性
C
一氧化碳与氧化铁反应炼铁
一氧化碳具有氧化性
D
用飞机在云层中撒布干冰,实施人工降雨
干冰升华放热
6、下列说法正确的是
A. 化学反应伴随着能量变化
B. 用水灭火的原理是降低了可燃物的着火点
C. 甲烷是最理想的清洁、高能燃料
D. 在煤炉上放一壶水能防止一氧化碳中毒
7、一些食物的近似pH如下:
食物
葡萄汁
苹果汁
牛奶
鸡蛋清
pH
35~4.5
2.9~3.3
6.3-6.6
7.6~ 8.0
下列说法正确的是
A.鸡蛋清和牛奶显碱性 B. 要补充维生索可以多吃鸡蛋清
C.苹果汁的酸性比葡萄汁弱 D. 胃酸过多的人应少饮葡萄汁和苹果汁
8、植物的光合作用可表示为: 6n CO2+ 5n H2O淀粉+6nO2根据该信息,下列说法正确的是
A.淀粉属于有机物 B.淀粉中含有碳、氢、氧、氮元素
C.淀粉的相对分子质量为162g D.淀粉中碳、氧原子的个数比为6:5
9、我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合加热至800℃,得到一种外形似金子的锌铜合金(俗称黄铜)。下列说法正确的是
A. Cu2O中铜的化合价为+2价 B.黄铜熔点比铜与锌的熔点都低
C.该变化过程中有化合反应 D.通过观察颜色可鉴别金子与黄铜
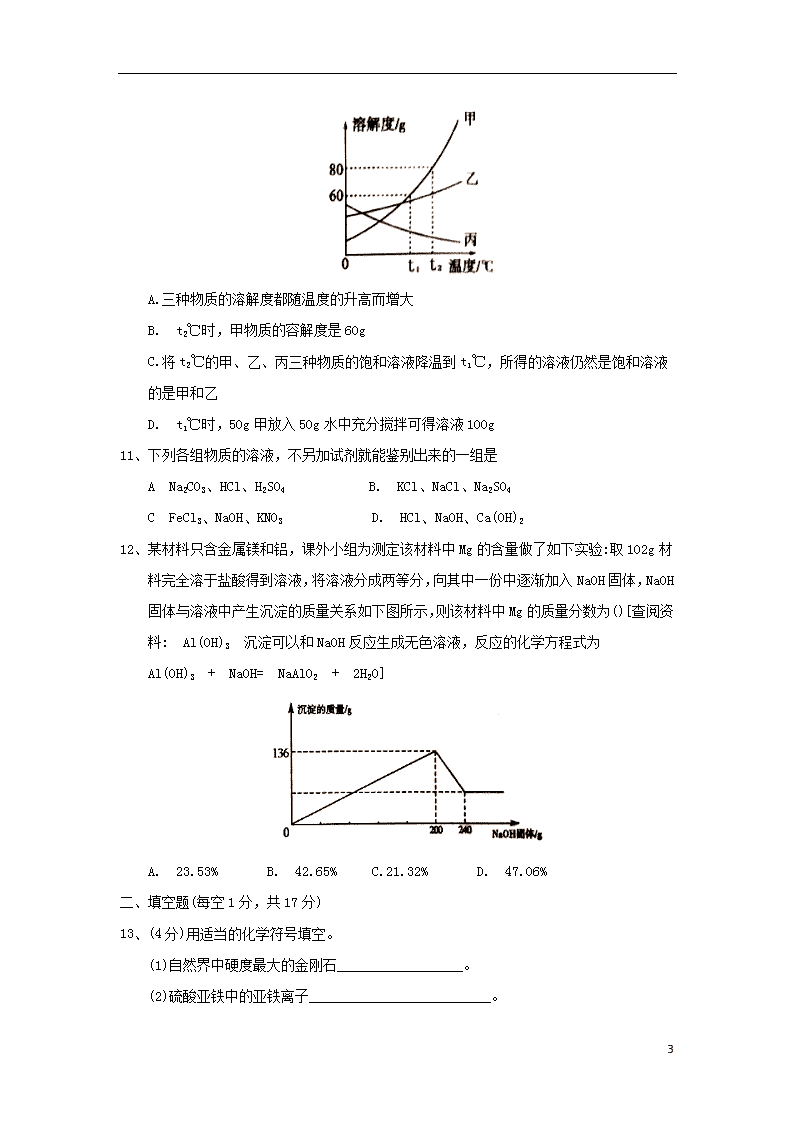
10、如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法正确的是
9
A.三种物质的溶解度都随温度的升高而增大
B. t2℃时,甲物质的容解度是60g
C.将t2℃的甲、乙、丙三种物质的饱和溶液降温到t1℃,所得的溶液仍然是饱和溶液的是甲和乙
D. t1℃时,50g甲放入50g水中充分搅拌可得溶液100g
11、下列各组物质的溶液,不另加试剂就能鉴别出来的一组是
A Na2CO3、HCl、H2SO4 B. KCl、NaCl、Na2SO4
C FeCl3、NaOH、KNO3 D. HCl、NaOH、Ca(OH)2
12、某材料只含金属镁和铝,课外小组为测定该材料中Mg的含量做了如下实验:取102g材料完全溶于盐酸得到溶液,将溶液分成两等分,向其中一份中逐渐加入NaOH固体,NaOH固体与溶液中产生沉淀的质量关系如下图所示,则该材料中Mg的质量分数为()[查阅资料: Al(OH)3 沉淀可以和NaOH反应生成无色溶液,反应的化学方程式为Al(OH)3 + NaOH= NaAlO2 + 2H2O]
A. 23.53% B. 42.65% C.21.32% D. 47.06%
二、填空题(每空1分,共17分)
13、(4分)用适当的化学符号填空。
(1)自然界中硬度最大的金刚石__________________。
(2)硫酸亚铁中的亚铁离子__________________________。
9
(3)使无色酚酞试剂变为红色的离子__________________________。
(4)保持氢气化学性质的最小微粒_______________________________。
14、(4分)化学与人类生活息息相关,联系学过的化学知识,按要求完成下列各题。
(1)在一些地方, 用抽取的地下水洗衣服时,肥皂不易起泡沫且产生浮渣,其可能的原因是该地下水是___________ (填“硬水”或“软水”)。
(2)化石能源煤燃烧时会排放大量气体,这些气体中不会造成空气污染的是
A. CO B. CO2 C. SO2 D. NO2
(3)材料的发展与应用,极大地方便了人们的生活,下列材料属于金属材料的是
A.木材家具 B.食品塑料袋 C.铝合金门窗 D.化纤布料
(4)“芯片”是智能化电器设备的核心部件,制作材料主要是高纯度的单质硅。制备高纯度硅的过程较为复杂,其中一个化学反应是: SiO2+ 2CSi+2CO↑该反应前后化合价发生改变的元素有_______________________。
15、(4分)通常情况下,氨气(NH3)是有刺激性气味的无色气体,密度比空气小,极易溶于水,水溶液叫氨水(NH3· H2O)呈碱性,氨气与氯化氢气体相遇产生白烟,生成氯化铵。氨气在化学工业中有着广泛的用途,如制造化肥、纯碱等。根据有关信息,回答下列问题:
(1)写出氨气的物理性质(任写一点)_______________________________________________。
(2)“氨气与氯化氢气体相遇产生白烟”的化学方程式为___________________________。
(3)化工厂发生大量氨气泄漏,可用洒水的方法来吸收,原因是____________________。
(4)某研究性学习小组用 装置来收集氨气,判断氨气已收集满的方法是____________________________________________________________________。
16、(5分)A、B、C、D、E分别是硫酸铜、氢氧化钠、镁、氧化镁、盐酸中的一种物质。C物质水溶液呈蓝色,它们之间的反应和转化关系如图所示(“____”表示两物质能发生化学反应,“→”表示一种物质经一步反应可转化为另一种物质)。回答下列问题。
9
(1)敞放的氢氧化钠固体易潮解和变质,因此氢氧化钠要_____________保存。
(2)写出物质E的一种用途____________________________________________。
(3)该“反应和转化关系”图中共有_____ 个是复分解反应。
(4)写出C与D反应的化学方程式_________________________________。
(5)能比较两种金属活动性强弱的反应是(填数字序号)__________。
三、计算题(5分)
17、某工厂化险室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸(该产品中其它物质不与NaOH反应),消耗氢氧化钠溶液的质量与反应过程中溶液的pH值关系如图所示。
(1)图中A点表示的意义是______________________________________。
(2) A点消耗氢氧化钠溶液的溶质的质量为___________g。
(3)求石油产品中残余硫酸的质量(写出计算过程)。
四、实验与探究题(每空1分,共10分)
18、(5分)下图是实验室制取与收集气体的装置图,据此回答有关问题。
(1)仪器①的名称是___________________________。
9
(2)实验室用石灰石与稀盐酸制取二氧化碳气体,应选用的发生装置和收集装置的组合是(填序号)_____,反应的化学方程式为___________________________________;该组合装置还可以用来制取氧气,其化学方程式为__________________________________________。
(3)实验室利用F装置收集氢气时,气体应从______端(填“a”或“b)通入。
19、(5 分)某实验小组在做“用澄清石灰水检验二氧化碳” 的实验时,发现一个有趣的实验现象:
试管中浑浊现象为何消失?实验小组的同学对此实验进行了下列探究活动:
(1)根据已学知识,实验小组对CO2使澄清石灰水变浑浊的现象作出了合理的解释,其化学方程式为________________________________。
(2)【查阅资料】
①碳酸盐一般不溶于水。 如碳酸钙不溶于水。
②碳酸钙能与二氧化碳、水反应生成碳酸氢钙[Ca(HCO3)2],碳酸氢钙易溶于水。
③碳酸氢钙受热易分解,生成碳酸钙、二氧化碳、水。
从物质组成角度分类,碳酸氢钙应属于( )。
A. 氧化物 B. 酸 C.碱 D.盐
写出碳酸氢钙受热分解的化学方程式__________________________。
(3)【提出问题】碳酸氢钙能与哪些物质反应呢?
(4)【假设与猜想】猜想I:能与盐酸反应
猜想lI:能与氢氧化钠反应
……………
(5)【设计实验并验证】
实验步骤
实验现象
结论
实验一:取丙中少量液体于试管中,滴加稀盐酸
有_________生成
猜想I成立
有白色沉淀生成
猜想II成立
9
实验二:取丙中少量液体于试管中,滴加氢氧化钠溶液
实验三:取丙中少量液体于试管中,加热
澄清液体又变浑浊
验证了资料描述
根据验证实验写出碳酸氢钙与盐酸反应的化学方程式_______________________________。
(6)【讨论与反思】
该实验小组在实验中发现问题,并对问题进行不断探究。他们不但发现了新的物质,还了解了它的一些性质,并对生活中煮沸可以降低水的硬度、水垢的形成以及自然界中溶洞与钟乳石的形成有了更进一步的认识。
9
参考答案
一、选择题(每小题1.5分,共18分)
1-6:BCBCBA 7-12:DABCCD
二、填空题(每空1分,共17分)
13、(1) C (2) Fe2+ (3) OH- (4) H2
14、(1)硬水 (2) B (3) C
(4)Si、C (或“硅元素、碳元素”;只写对1个得0.5分,见错不给分)
15、(1)有刺激性气味;无色;气体;密度比空气小;极易溶于水(任写一点)
(2) NH3+HCl==NH4Cl
(3)氨气极易溶于水
(4)将湿润的红色石蕊试纸放在n端,若试纸变蓝色,说明氨气已经收集满(其他合理答案均可给分)
16、(1)密封
(2)除去金属表面的铁锈(或“制造药物”、“帮助消化”等答对关键词均可给分)
(3) 3 (4) CuSO4+2NaOH== Cu(OH)2 ↓+Na2SO4 (5)④
三、计算题(共5分)
17、(1)酸碱恰好中和(或“溶液呈中性”答对意思均可给分) (1分)
(2) 4 (1分)
(3)解:设石油产品中残余硫酸质量为x
H2SO4+2NaOH ==Na2SO4+2H2O (1分)
98 80
X 40g×10%
98/80=x/40g×10% (1分)
x=4.9g (1分)
答:石油产品中残余硫酸质量为4.9g。
四、实验与探究题(每空1分,共10分)
18、(1)试管
(2) AC (A、C顺序可以交换,只写对1个得0.5分,见错不给分)
CaCO3 + 2HCl==CaCl2 +H2O+CO2↑ 2H2O22H2O+O2↑
9
(3) b
19、(1) CO2+ Ca(OH)2==CaCO3↓+H2O
(2) D Ca(HCO3)2 CaCO3↓+H2O+CO2↑
(3)气泡 Ca(HCO3)2+ 2HCl==CaCl2+ 2H2O+2CO2↑
9