- 267.30 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2014年上海市化学中考真题
1.属于化学变化的是( )
A.酒精挥发 B.西瓜榨汁 C.木炭燃烧 D.糯米磨粉
2.高钙奶粉中的“钙”一般是指( )
A.原子 B.分子 C.单质 D.元素
3.进行焰色反应时,火焰呈黄色的物质是( )
A. B. C. D.
4.加入足量水充分搅拌,能形成溶液的是( )
A.泥沙 B.蔗糖 C.植物油 D.大理石
5.属于有机物的是( )
A.碳酸钙 B.甲烷 C.碳酸 D.二氧化碳
6.不属于碳元素的同素异形体的是( )
A.金刚石 B.石墨 C.碳60 D.一氧化碳
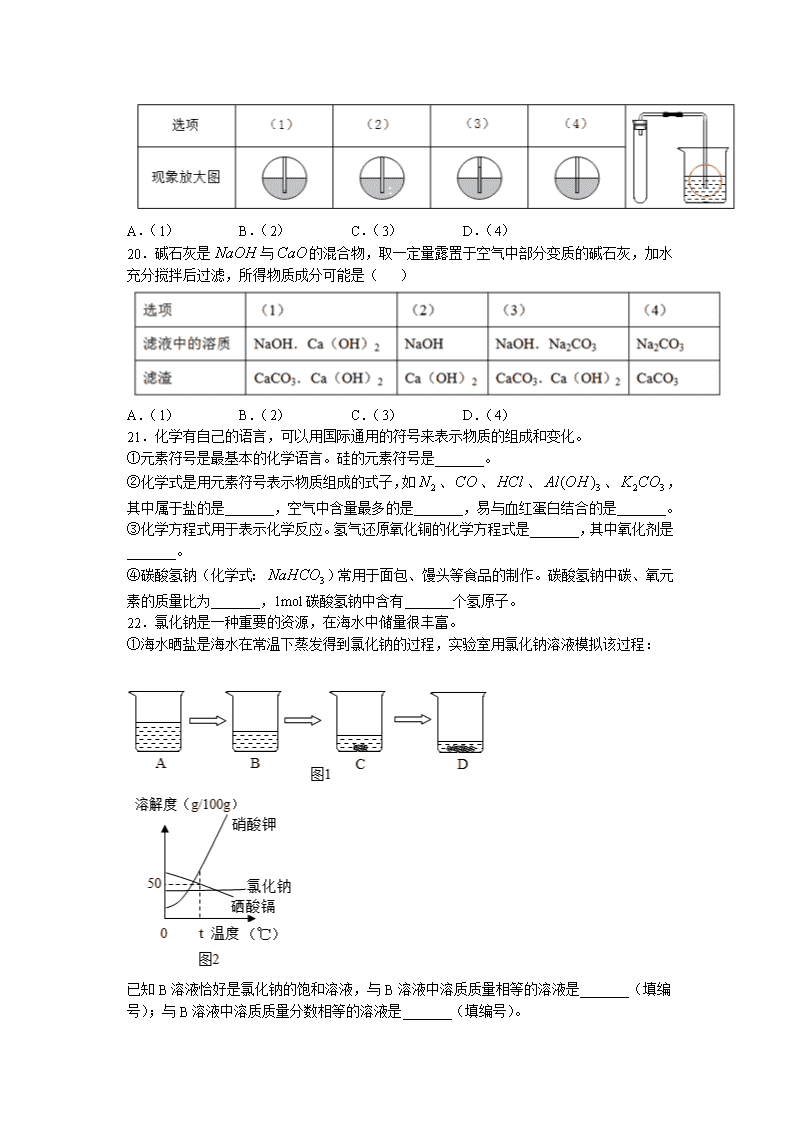
7.含氟牙膏中常添加氟化钠,中元素的化合价是( )
A.+1 B.0 C.-1 D.-2
8.不含原子团的物质是( )
A. B. C. D.
9.粗盐提纯实验中,图示操作错误的是( )
A.B.C.D.
10.属于分解反应的是( )
A.
B.
C.
D.
11.X在氧气中燃烧,能生成具有刺激性气味的气体,X可能是( )
A.木炭 B.铁丝 C.氢气 D.硫粉
12.为比较X、Y、Z三种金属活动性大小,进行如下实验。实验结论正确的是( )
A.X>Y>Z B.Z>Y>X C.Y>X、Y>Z D.X>Y、Z>Y
13.物质所对应用途错误的是( )
A.氧化钙:作干燥剂 B.氢氧化钠:治疗胃酸过多
C.碳酸氢铵:作氮肥 D.稀盐酸:除铁锈
14.已知:“”、“”和“”表示不同元素的原子。某反应的微观示意图如下,关于乙的构成说法合理的是( )
A.只含和 B.含有和
C.只含 D.只含
15.工业上常把煤块粉碎后使其充分燃烧,其目的是( )
A.减少煤的浪费 B.减少氧气的消耗
C.减少二氧化碳的排放 D.减少酸雨的形成
16.河水净化的主要步骤如下图所示。有关说法错误的是( )
A.步骤I可出去难溶性杂质 B.X试剂可以是活性炭
C.步骤III可杀菌、消毒 D.净化后的水是纯净物
17.除去溶液中的少量杂质,试剂选择正确的是( )
A.(1) B.(2) C.(3) D.(4)
18.关于原子、分子叙述错误的是( )
A.分子都是由原子构成的
B.分子和原子都在不停运动
C.分子和原子在化学变化中都能够再分
D.分子和原子都是构成物质的微粒
19.如下图,为检查装置的气密性,保持装置内温度不变,将导管的末端深入装有水的烧杯中。若装置的气密性良好,烧杯内导管处的现象(画圈部分)是( )
A.(1) B.(2) C.(3) D.(4)
20.碱石灰是与的混合物,取一定量露置于空气中部分变质的碱石灰,加水充分搅拌后过滤,所得物质成分可能是( )
A.(1) B.(2) C.(3) D.(4)
21.化学有自己的语言,可以用国际通用的符号来表示物质的组成和变化。
①元素符号是最基本的化学语言。硅的元素符号是_______。
②化学式是用元素符号表示物质组成的式子,如、、、、,其中属于盐的是_______,空气中含量最多的是_______,易与血红蛋白结合的是_______。
③化学方程式用于表示化学反应。氢气还原氧化铜的化学方程式是_______,其中氧化剂是_______。
④碳酸氢钠(化学式:)常用于面包、馒头等食品的制作。碳酸氢钠中碳、氧元素的质量比为_______,1mol碳酸氢钠中含有_______个氢原子。
22.氯化钠是一种重要的资源,在海水中储量很丰富。
①海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室用氯化钠溶液模拟该过程:
已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是_______(填编号);与B溶液中溶质质量分数相等的溶液是_______(填编号)。
②氯化钠、硝酸钾、硒酸镉的溶解度曲线如图所示。
据图回答:
溶解度变化受温度影响最大的是_______。
tC时,溶解度最小的是_______。
tC时,将25g硒酸镉加入_______g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是_______。
③硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是_______。
23.为探究碱的性质,进行如下实验。
①如图(甲)所示,加入一定量的盐酸后,溶液红色褪去,溶液温度_______(填“升高”、“降低”或“不变”)。
②如图(乙和丙)所示,同时将两支充满的相同试管分别倒扣在等体积的水和溶液中,一段时间后,丙中液面高于乙,说明与发生了反应,该反应的化学方程式为_______,本实验中乙的作用是_______。
③实验结束后,进行废液处理。将丙所得溶液全部倒入一大烧杯中,再将甲所得溶液缓慢加入。全部加入后测得溶液pH为3,调节pH接近7,达到排放标准。
将甲所得溶液缓慢加入的过程中,大烧杯内可观察到的现象是_______。
24.下面是几种实验室制取气体的发生装置与收集装置。
①写出仪器名称I_______,II_______。
②实验室可用二氧化锰与双氧水制取氧气。若要较好地控制产生氧气的速度,应选用装置_______(填编号)。
实验室还可以用氯酸钾和二氧化锰制氧气,反应的化学方程式为_______。
③D装置收集氧气,操作的正确顺序为_______(填编号)。
a.将导管深入集气瓶口,气体进入瓶中
b.将装满水的集气瓶倒置在水槽中
c.当气体收集满时,用毛玻璃片盖上瓶口,将集气瓶移出水面放置
若用E装置进行排空气法收集氧气,气体应从_______(填“a”或“b”)端通入。
25.7.0g
含杂质的铁粉样品与足量稀硫酸反应,产生氢气的物质的量与时间关系如图甲所示(杂质不与酸、碱、盐发生反应)。
①计算样品中所含铁的物质的量(根据化学方程式列式计算)。_______
样品中铁的质量分数为_______。
②另外a g该铁粉样品与足量硫酸铜溶液反应,产生铜的物质的量与时间关系如图乙所示。
则a为_______g。
26.实验室可利用碱式碳酸铜(化学式:)制备氧化铜,并进行碳粉还原氧化铜的实验。
①制备氧化铜并检验产物,装置如下图所示(省略夹持仪器):
步骤一:连接A和B,打开活塞,通入空气。
步骤二:关闭活塞,连上C和D,开始加热。
步骤三:在加热过程中,记录在B中固体质量变化如下表,在时停止加热。
B中发生反应的化学方程式为:++
请在中填入配平后的系数_______。
C中试剂是_______。A的作用是吸收空气中的_______,防止对产物检验造成干扰。选择时停止加热的理由是_______。
②一定量碳粉还原①中制得的氧化铜并检验产物,装置如下图所示:
实验过程中,观察到F中溶液变浑浊,E中的现象是_______。
反应完全后,若仅撤走酒精喷灯停止加热,可能导致的后果是_______。
③分析:若①中省略步骤三,对②中反应产物判断可能产生的影响及其原因_______。
参考答案
1、C 2、D 3、D 4、B 5、B 6、D 7、C 8、A 9、C 10、A
11、D 12、A 13、B 14、B 15、A 16、D 17、B 18、C 19、A 20、A
21、(1)(2);;(3);(4) 1:4;
22、(1) A; CD
(2)硝酸钾;氯化钠;50;降低温度并加入硒酸镉; 降温结晶(或冷却热饱和溶液)
23、(1) 升高
(2);进行对照实验,证明与发生反应(3)溶液先变红后褪色,并有气泡产生
24、(1)试管;锥形瓶
(2)C;
(3)bac;b
25、(1) 设样品中铁的物质的量为x mol
x=0.1mol
(2) 7.0
26、(1) 1、2、1、1; 无水硫酸铜;水蒸气和二氧化碳; 固体质量不再减少,证明碱式碳酸铜已经完全分解
(2) 黑色粉末变成红色; F中液体通过导管倒流入E中,造成试管炸裂
(3)不能确定炭粉还原氧化铜的生成物中是否有二氧化碳。
因为可能有①中未分解的碱式碳酸铜在实验②中分解,产生二氧化碳气体,干扰对炭粉还原氧化铜反应生成物的判断。