- 202.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
基本概念填空
1、纯净物:由 物质组成
2、混合物:由 纯净物组成,各物质都保持原来的性质
区别:在化学变化中,是否可以再分
3、元素:具有相同 数(即质子数)的一类原子的总称
4、分子:构成物质的一种粒子,在化学变化中 分
5、原子:构成物质的另一种粒子,在化学变化中 再分
区别:看 是不是只有一种元素符号
如:O2是单质,CO2是化合物
6、单质:由 元素组成的纯净物
7、化合物:由 种元素组成的纯净物
8、氧化物:由 种元素组成的化合物中,其中有一种元素是 元素
9、化学式:用 符号来表示物质组成的式子
10、相对原子质量: 相对原子质量 ≈ 质子数 + 中子数 (因为原子的质量主要集中在原子核)
11、相对分子质量:化学式中各原子的 质量的总和
12、离子:带有电荷的 或
13、原子的结构:
原子核
原子
(—)
中子(0)
质子(+)
注:在原子里,核 数= 数=核外电子数
离子
离子
原子
得e
失e
失e
得e
原子、离子的关系: 注:在离子里,核电荷数 = 质子数 ≠ 核外电子数
14、四种化学反应基本类型:
①化合反应: 由 或 以上物质生成一种物质的反应如:A + B = AB
②分解反应:由 物质生成两种或两种以上其它物质的反应如:AB = A + B
③置换反应:由一种 和一种 起反应,生成另一种 和另一种 的反应如:A + BC = AC + B
④复分解反应:由两种 相互交换成分,生成另外两种 的反应如:AB + CD = AD + CB
15、催化剂:在化学变化里能改变其它物质的化学反应 ,而本身的 和化学 在化学变化前后都没有变化的物质(注:2H2O2 === 2H2O + O2 ↑ 此反应MnO2是催化剂)
16、质量守恒定律:参加化学反应的各物质的 总和,等于反应后生成物质的 总和。
(反应的前后,原子的 、 、 都不变;元素的种类也不变)
17、溶液:一种或几种物质 到另一种物质里,形成 的、 的混合物
溶液由溶 和溶 组成。(溶质可以是固体、液体或气体;固、气溶于液体时,固、气是溶质,液体是溶剂;两种液体互相溶解时,量多的一种是溶剂,量少的是溶质;当溶液中有水存在时,不论水的量有多少,我们习惯上都把水当成溶剂,其它为溶质。)
18、固体溶解度:在一定温度下,某固态物质在 克溶剂里达到 时所溶解的质量,就叫做这种物质在这种溶剂里的溶解度
19、酸: +酸根
碱: 金属+ OH
盐: + 的化合物
20、燃烧:可燃物跟 发生的一种发光发热的剧烈的 反应
燃烧的条件:① 物;②与 接触;③可燃物的温度要达到 。
生活中的化学物质:
1、空气的成分:氮气占 , 氧气占 , 稀有气体占0.94%,
二氧化碳占0.03%,其它气体与杂质占0.03%
2、主要的空气污染物: 、 、 、 等物质
3、其它常见气体的化学式:NH3( )、CO( )、CO2( )、CH4( )、
SO2( )、SO3( )、HCl( )
4、常见的酸根或离子:SO42- )、NO3-( )、CO32- )、
Cl-( )、OH-( )、NH4+( )、
各元素或原子团的化合价与上面离子的电荷数相对应:
一价钾钠氢和银,二价钙镁钡和锌;
一二铜汞二三铁,三价铝来四价硅。(氧-2,氯化物中的氯为 -1,氟-1,溴为-1)
(单质中,元素的化合价为 ;在化合物里,各元素的化合价的代数和为 )
5、化学式和化合价:
(1)化学式的意义:①宏观意义:a.表示一种 ;
b.表示该物质的 组成;
②微观意义:a.表示该物质的一个 ;
b.表示该物质的分子 ;
可计算出的量:a.物质的一个分子中各 个数比;
b.组成物质的各元素 比。
读:直接读其元素名称
(稀有气体的可加多个
“气”字或不加也可)
(2)单质化学式的读写
直接由原子构成的单质
①直接用元素符号表示的:a.金属 。如:钾 铜 银Ag 等;
b. 非金属。如:碳 硫 磷P 等
c. 气体。如:氦(气) 氖(气)Ne 氩(气)Ar等
②多原子构成分子的单质:其分子由几个同种原子构成的就在元素符号右下角写几。
读:气体单质在其元素
名称后加多个“气”
如:每个氧气分子是由2个氧原子构成,则氧气的化学式为
双原子分子单质化学式:O2( )、N2( ) 、H2( )
F2(氟气)、Cl2(氯气)、Br2(液态溴)
多原子分子单质化学式:臭氧O3等
(3)化合物化学式的读写:先读的后写,后写的先读
①两种元素组成的化合物:读成“某化某”,如:MgO( )、NaCl( )
②酸根与金属元素组成的化合物:读成“某酸某”,如:KMnO4( )、K2MnO4( )
MgSO4( )、CaCO3( )
(4)根据化学式判断元素化合价,根据元素化合价写出化合物的化学式:
①判断元素化合价的依据是:化合物中正负化合价代数和为 。
②根据元素化合价写化学式的步骤:
a.按元素化合价正 负 写出元素符号并标出化合价;
b.看元素化合价是否有约数,并约成最简比;
c.交叉对调把已约成最简比的化合价写在元素符号的右下角。
6、核外电子排布:1-20号元素(能说出原子结构示意图的意义)
元素的化学性质取决于最外层电子数
金属元素
稳定结构:
①最外层 电子②第一层为最外 层 电子
原子的最外层电子数 4,易失电子,化学性质活泼。
非金属元素
原子的最外层电子数 4,易得电子,化学性质活泼。
稀有气体元素
原子的最外层有 个电子(He有2个),结构稳定,性质稳定。
7、书写化学方程式的原则:①以 为依据; ②遵循 定律
书写化学方程式的步骤:“写”、“配”、“注”“等”。
8、酸碱度的表示方法——PH值
说明:(1)pH值 7,溶液呈中性;pH值 7,溶液呈酸性;pH值 7,溶液呈碱性。
(2)pH值越接近0,酸性越强;pH值越接近14,碱性越强;pH值越接近7,溶液的酸、碱性就越弱,越接近中性。
(饮用水中因溶解有二氧化碳而略显酸性)
K、Ca、Na、 、 、 、 、Sn、Pb、(H)、 、Hg、Ag、Pt、Au
金属活动性由强逐渐减弱
9、金属活动性顺序表:
(钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金)
说明:(1)越左金属活动性就越 ,靠前的金属可以从靠后金属的盐溶液中 出该金属出来
(2)排在 左边的金属,可以从酸中置换出 ;排在氢右边的则不能。
(3)钾、钙、钠三种金属比较活泼,它们直接跟溶液中的水发生反应置换出氢气
10、化学符号的意义及书写:
(1)化学符号的意义:a.元素符号:①表示一种 ;②表示该元素的一个 。
b.离子符号:表示离子及离子所带的 数。
c.化合价符号:表示元素或原子团的 。
符号前有数字时符号所表示的粒子
元素符号:原子
化学式:分子
离子符号:离子
如:5CO2 只表示
如:4Mg2+ 只表示
如:3S 只表示 ;
(2)化学符号的书写:a.原子的表示方法:用元素符号表示如: 氢原子:H
b.分子的表示方法:用化学式表示如: 二氧化碳分子:CO2
c.离子的表示方法:用离子符号表示如: 钙离子:Ca2+
+2
d.化合价的表示方法:用化合价符号表示如正二价的镁元素:Hg
如:两个氧原子:2O(而不是O2,O2是分子); 7个二氧化碳分子:7CO2; 两个钙离子:2Ca2+
注:原子、分子、离子三种粒子个数不只“1”时,只能在符号的前面加,不能在其它地方加。
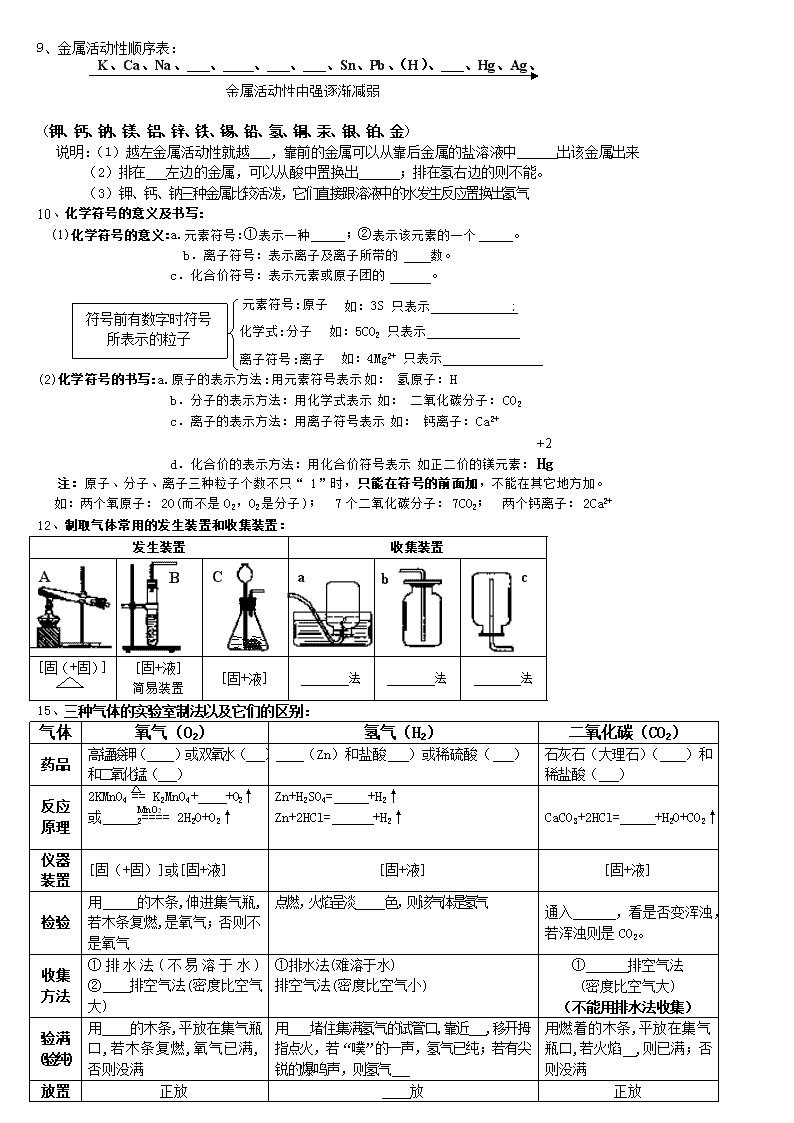
12、制取气体常用的发生装置和收集装置:
C
A
B
a
b
c
发生装置
收集装置
[固(+固)]
[固+液]
简易装置
[固+液]
法
法
法
15、三种气体的实验室制法以及它们的区别:
气体
氧气(O2)
氢气(H2)
二氧化碳(CO2)
药品
高锰酸钾( )或双氧水( )和二氧化锰( )
(Zn)和盐酸 )或稀硫酸( )
石灰石(大理石)( )和稀盐酸( )
反应原理
2KMnO4 == K2MnO4+
MnO2
+O2↑
或 2==== 2H2O+O2↑
Zn+H2SO4= +H2↑
Zn+2HCl= +H2↑
CaCO3+2HCl= +H2O+CO2↑
仪器装置
[固(+固)]或[固+液]
[固+液]
[固+液]
检验
用 的木条,伸进集气瓶,若木条复燃,是氧气;否则不是氧气
点燃,火焰呈淡 色,则该气体是氢气
通入 ,看是否变浑浊,若浑浊则是CO2。
收集方法
①排水法(不易溶于水) ② 排空气法(密度比空气大)
①排水法(难溶于水) ② 排空气法(密度比空气小)
① 排空气法
(密度比空气大)
(不能用排水法收集)
验满
(验纯)
用 的木条,平放在集气瓶口,若木条复燃,氧气已满,否则没满
用 堵住集满氢气的试管口,靠近 ,移开拇指点火,若“噗”的一声,氢气已纯;若有尖锐的爆鸣声,则氢气
用燃着的木条,平放在集气瓶口,若火焰 ,则已满;否则没满
放置
正放
放
正放
注意事项
①检查装置的 性
(当用第一种药品制取时以下要注意)
②试管口要略向 倾斜(防止凝结在 口的小水珠倒流入试管底部使试管 )
③加热时应先使试管均匀 ,再集中在药品部位加热。
④排水法收集完氧气后,
先 后撤 (防止水槽中的水倒流,使试管破裂)
①检查装置的 性
②长颈漏斗的 要插入液面下;
③点燃氢气前,一定要检验氢气的 (空气中,氢气的体积达到总体积的4%—74.2%点燃会爆炸。)
①检查装置的 性
②长颈漏斗的管口要插
入 下;
③不能用排水法收集
16、一些重要常见气体的性质(物理性质和化学性质)
物质
物理性质
(通常状况下)
化学性质
用途
氧气
(O2)
无色无味的气体,不易溶于水,密度比空气
点燃
点燃
①C + O2==CO2(发出 光,放出热量)
1、 呼吸
2、 炼钢
3、 气焊
(注:O2具有助燃性,但不具有可燃性,不能燃烧。)
②S + O2 ==SO2 (空气中— 色火
点燃
焰;氧气中—紫蓝色火焰)
点燃
③4P + 5O2 == 2P2O5 (产生 ,生成 固体P2O5)
④3Fe + 2O2 == Fe3O4 (剧烈燃烧, ,放出大量的热,生成 )
⑤蜡烛在氧气中燃烧,发出白光,放出热量
氢气
(H2)
无色无味的气体,难溶于水,密度比空气 ,是最轻的气体。
点燃
① 可燃性:
点燃
2H2 + O2 ====
H2 + Cl2 ==== 2HCl
1、填充气、飞舰(密度比空气小)
2、合成氨、制盐酸
3、气焊、气割(可燃性)4、提炼金属(还原性)
② 还原性:
H2 + CuO === Cu +
3H2 + WO3 === W + 3H2O
3H2 + Fe2O3 == 2Fe + 3H2O
二氧化碳(CO2)
无色无味的气体,密度比空气 ,能溶于水,固体的CO2叫“ ”。
CO2 + H2O ==H2CO3(酸性)
(H2CO3 === H2O + )(不稳定)
1、用于 (应用其不可燃烧,也不支持燃烧的性质)
2、制饮料、化肥和纯碱
CO2 + Ca(OH)2 == +H2O(鉴别CO2)
CO2 +2NaOH= + H2O
CaCO3 = + CO2↑(工业制CO2)
一氧化碳(CO)
无色无味气体,密度比空气 ,难溶于水,有 气体
①可燃性:2CO + O2 ==
(火焰呈 色,放出大量的热,可作气体燃料)
1、 作 料
2、 冶炼
②还原性:(重点)
CO + CuO == + CO2 高温
3CO + Fe2O3 ==2Fe +
(跟血液中 结合,破坏血液输氧的能力)
解题技巧和说明:
1、解计算题:①有关 分数(元素和溶质)的计算
②根据化学 进行计算
③由①和②两种类型混合在一起计算
质量
质量
(一)、溶液溶质质量分数的计算
溶质质量分数 = ╳ 100%
某元素 质量╳原子个数
化合物的
(二)、纯净物中某元素质量分数的计算
某元素质量分数= ╳ 100%
化合物
混合物
(三)、混合物中某化合物的质量分数计算
化合物的质量分数= ╳ 100%
元素质量
混合物质量
(四)、混合物中某元素质量分数的计算
某元素质量分数= ╳ 100%
或:某元素质量分数= 的质量分数 ╳ 该元素在化合物中的质量分数
2、解实验题:
(一)、实验用到的气体要求是比较纯净,除去常见杂质具体方法:
1. 除水蒸气可用:浓 、 固体、碱 (氢氧化钠和生石灰混合物)、 灰等
2.除CO2可用:足量 溶液、
3.验CO2可用:澄清石灰水
除气体杂质的原则:用某物质吸收杂质或跟杂质反应,但不能吸收或跟 成份反应,或者生成新的杂质。
(二)、实验注意的地方:
①防 炸:点燃可燃性气体(如H2、CO、CH4)或用CO、H2还原CuO、Fe2O3之前,要检验气体 。
②防 沸:稀释浓硫酸时,将 倒入 中,不能把 倒入 中。
③防 毒:进行有关有毒气体(如:CO、SO2、NO2)的性质实验时,在通风厨中进行;并要注意 的处理:CO点燃烧掉;SO2、NO2用 液吸收。
④防 吸:加热法制取并用排水法收集气体,要注意 顺序。
(三)、常见意外事故的处理:
浓硫酸沾到皮肤或衣物上:先用 冲洗,再用3 - 5% 冲洗;
氢氧化钠固体沾到皮肤或衣物上:用水冲洗,再涂上 ;
(四)、实验室制取三大气体中常见的要除的杂质:
1、制O2要除的杂质: 气(H2O)
2、用盐酸和锌粒制H2要除的杂质:水蒸气( )、氯化氢气体( ,盐酸酸雾)(用稀硫酸没此杂质)
3、制CO2要除的杂质:水蒸气(H2O)、 气体(HCl)
(五)、常用实验方法来验证混合气体里含有某种气体
1、有CO的验证方法:(先验证混合气体中是否有CO2,有则先除掉)
将混合气体通入灼热的 ,再将经过灼热的CuO的混合气体通入 。现象:黑色CuO变成 色,且澄清石灰水要变 。
2、有H2的验证方法:(先验证混合气体中是否有水份,有则先除掉将混合气体通入灼热的 ,再将经过灼热的CuO的混合气体通入盛有 酸中。现象:黑色CuO变成红色,浓硫酸 增加。
3、有CO2的验证方法:将混合气体通入 水。现象:澄清石灰水变 。
基本概念
1、纯净物:由一种物质组成
2、混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质
区别:在化学变化中,是否可以再分
3、元素:具有相同核电荷数(即质子数)的一类原子的总称
4、分子:构成物质的一种粒子,在化学变化中可再分
5、原子:构成物质的另一种粒子,在化学变化中不可以再分
区别:看化学式是不是只有一种元素符号
如:O2是单质,CO2是化合物
6、、单质:由同种元素组成的纯净物
7、化合物:由不同种元素组成的纯净物
8、氧化物:由两种元素组成的化合物中,其中有一种元素是氧元素
9、化学式:用元素符号来表示物质组成的式子
10、相对原子质量: 相对原子质量 ≈ 质子数 + 中子数 (因为原子的质量主要集中在原子核)
11、相对分子质量:化学式中各原子的相对原子质量的总和
原子核
原子
核外电子(—)
中子(0)
质子(+)
注:在原子里,核电荷数=质子数=核外电子数
阳离子
阴离子
原子
得e
失e
失e
得e
12、离子:带有电荷的原子或原子团
13、原子的结构:
原子、离子的关系:
注:在离子里,核电荷数 = 质子数 ≠ 核外电子数
14、四种化学反应基本类型:
①化合反应: 由两种或两种以上物质生成一种物质的反应如:A + B = AB
②分解反应:由一种物质生成两种或两种以上其它物质的反应如:AB = A + B
③置换反应:由一种单质和一种化合物起反应,生成另一种单质和另一种化合物的反应如:A + BC = AC + B
④复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应如:AB + CD = AD + CB
15、催化剂:在化学变化里能改变其它物质的化学反应速率,而本身的质量和化学性在化学变化前后都没有变化的物质(注:2H2O2 === 2H2O + O2 ↑ 此反应MnO2是催化剂)
16、质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成物质的质量总和。
(反应的前后,原子的数目、种类、质量都不变;元素的种类也不变)
17、溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物
溶液的组成:溶剂和溶质。(溶质可以是固体、液体或气体;固、气溶于液体时,固、气是溶质,液体是溶剂;两种液体互相溶解时,量多的一种是溶剂,量少的是溶质;当溶液中有水存在时,不论水的量有多少,我们习惯上都把水当成溶剂,其它为溶质。)
18、固体溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,就叫做这种物质在这种溶剂里的溶解度
19、酸:H+酸根
碱:金属+OH
盐:金属+酸根的化合物
20、燃烧:可燃物跟氧气发生的一种发光发热的剧烈的氧化反应
燃烧的条件:①可燃物;②与氧气接触;③可燃物的温度要达到着火点。
生活中的化学物质:
1、其它常见气体的化学式:NH3(氨气)、CO(一氧化碳)、CO2(二氧化碳)、CH4(甲烷)、
SO2(二氧化硫)、SO3(三氧化硫)、HCl(氯化氢)
2、常见的酸根或离子:SO42-(硫酸根)、NO3-(硝酸根)、CO32-(碳酸根)、
Cl-(氯离子)、OH-(氢氧根)、NH4+(铵根或铵离子)、
各元素或原子团的化合价与上面离子的电荷数相对应:
一价钾钠氢和银,二价钙镁钡和锌;
一二铜汞二三铁,三价铝来四价硅。(氧-2,氯化物中的氯为 -1,氟-1,溴为-1)
(单质中,元素的化合价为0 ;在化合物里,各元素的化合价的代数和为0)
3、化学式和化合价:
(1)化学式的意义:①宏观意义:a.表示一种物质;
b.表示该物质的元素组成;
②微观意义:a.表示该物质的一个分子;
b.表示该物质的分子构成;
可计算出的量:a.物质的一个分子中各原子个数比;
b.组成物质的各元素质量比。
读:直接读其元素名称
(稀有气体的可加多个
“气”字或不加也可)
(2)单质化学式的读写
直接由原子构成的单质
①直接用元素符号表示的:a.金属单质。如:钾K 铜Cu 银Ag 等;
b.固态非金属。如:碳C 硫S 磷P 等
c.稀有气体。如:氦(气)He 氖(气)Ne 氩(气)Ar等
②多原子构成分子的单质:其分子由几个同种原子构成的就在元素符号右下角写几。
读:气体单质在其元素
名称后加多个“气”
如:每个氧气分子是由2个氧原子构成,则氧气的化学式为O2
双原子分子单质化学式:O2(氧气)、N2(氮气) 、H2(氢气)
F2(氟气)、Cl2(氯气)、Br2(液态溴)
多原子分子单质化学式:臭氧O3等
(3)化合物化学式的读写:先读的后写,后写的先读
①两种元素组成的化合物:读成“某化某”,如:MgO(氧化镁)、NaCl(氯化钠)
②酸根与金属元素组成的化合物:读成“某酸某”,如:KMnO4(高锰酸钾)、K2MnO4(锰酸钾)
MgSO4(硫酸镁)、CaCO3(碳酸钙)
(4)根据化学式判断元素化合价,根据元素化合价写出化合物的化学式:
①判断元素化合价的依据是:化合物中正负化合价代数和为零。
②根据元素化合价写化学式的步骤:
a.按元素化合价正左负右写出元素符号并标出化合价;
b.看元素化合价是否有约数,并约成最简比;
c.交叉对调把已约成最简比的化合价写在元素符号的右下角。
4、核外电子排布:1-20号元素(能说出原子结构示意图的意义)
元素的化学性质取决于最外层电子数
金属元素
稳定结构:
①最外层8电子②第一层为最外 层2电子
原子的最外层电子数< 4,易失电子,化学性质活泼。
非金属元素
原子的最外层电子数≥ 4,易得电子,化学性质活泼。
稀有气体元素
原子的最外层有8个电子(He有2个),结构稳定,性质稳定。
7、书写化学方程式的原则:①以客观事实为依据; ②遵循质量守恒定律
书写化学方程式的步骤:“写”、“配”、“注”“等”。
8、酸碱度的表示方法——PH值
说明:(1)pH值=7,溶液呈中性;pH值<7,溶液呈酸性;pH值>7,溶液呈碱性。
(2)pH值越接近0,酸性越强;pH值越接近14,碱性越强;pH值越接近7,溶液的酸、碱性就越弱,越接近中性。
(饮用水中因溶解有二氧化碳而略显酸性)
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
金属活动性由强逐渐减弱
9、金属活动性顺序表:
(钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金)
说明:(1)越左金属活动性就越强,左边的金属可以从右边金属的盐溶液中置换出该金属出来
(2)排在氢左边的金属,可以从酸中置换出氢气;排在氢右边的则不能。
(3)钾、钙、钠三种金属比较活泼,它们直接跟溶液中的水发生反应置换出氢气
10、化学符号的意义及书写:
(1)化学符号的意义:a.元素符号:①表示一种元素;②表示该元素的一个原子。
b.化学式:本知识点的第5点第(1)小点
c.离子符号:表示离子及离子所带的电荷数。
d.化合价符号:表示元素或原子团的化合价。
符号前有数字时符号所表示的粒子
元素符号:原子
化学式:分子
离子符号:离子
如:5CO2 只表示5个二氧化碳分子
如:4Mg2+ 只表示4个镁离子
如:3S 只表示3个硫原子
当符号前面有数字(化合价符号没有数字)时,此时组成符号的意义只表示该种粒子的个数。
如: 钙离子:Ca2+
如: 氢原子:H
如: 二氧化碳分子:CO2
如正二价的镁元素:Hg
+2
(2)化学符号的书写:a.原子的表示方法:用元素符号表示
b.分子的表示方法:用化学式表示
c.离子的表示方法:用离子符号表示
d.化合价的表示方法:用化合价符号表示
如:两个氧原子:2O(而不是O2,O2是分子); 7个二氧化碳分子:7CO2; 两个钙离子:2Ca2+
注:原子、分子、离子三种粒子个数不只“1”时,只能在符号的前面加,不能在其它地方加。
先写出粒子的符号,再在符号前面标出粒子的个数!
14、制取气体常用的发生装置和收集装置:
C
A
B
a
b
c
发生装置
收集装置
[固(+固)]
[固+液]
简易装置
[固+液]
排水法
向上
排空气法
向下
排空气法
15、三种气体的实验室制法以及它们的区别:
气体
氧气(O2)
氢气(H2)
二氧化碳(CO2)
药品
高锰酸钾(KMnO4)或双氧水(H2O2)和二氧化锰(MnO2)
锌粒(Zn)和盐酸(HCl)或稀硫酸(H2SO4)
石灰石(大理石)(CaCO3)和稀盐酸(HCl)
反应原理
2KMnO4 == K2MnO4+MnO2
MnO2
+O2↑
或2H2O2==== 2H2O+O2↑
Zn+H2SO4=ZnSO4+H2↑
Zn+2HCl=ZnCl2+H2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
仪器装置
[固(+固)]或[固+液]
[固+液]
[固+液]
检验
用带火星的木条,伸进集气瓶,若木条复燃,是氧气;否则不是氧气
点燃木条,伸入瓶内,木条上的火焰熄灭,瓶口火焰呈淡蓝色,则该气体是氢气
通入澄清的石灰水,看是否变浑浊,若浑浊则是CO2。
收集方法
①排水法(不易溶于水) ②瓶口向上排空气法(密度比空气大)
①排水法(难溶于水) ②瓶口向下排空气法(密度比空气小)
①瓶口向上排空气法
(密度比空气大)
(不能用排水法收集)
验满
(验纯)
用带火星的木条,平放在集气瓶口,若木条复燃,氧气已满,否则没满
<1>用拇指堵住集满氢气的试管口;<2>靠近火焰,移开拇指点火,若“噗”的一声,氢气已纯;若有尖锐的爆鸣声,则氢气不纯
用燃着的木条,平放在集气瓶口,若火焰熄灭,则已满;否则没满
放置
正放
倒放
正放
注意事项
①检查装置的气密性
(当用第一种药品制取时以下要注意)
②试管口要略向下倾斜(防止凝结在试管口的小水珠倒流入试管底部使试管破裂)
③加热时应先使试管均匀受热,再集中在药品部位加热。
④排水法收集完氧气后,先撤导管后撤酒精灯(防止水槽中的水倒流,使试管破裂)
①检查装置的气密性
②长颈漏斗的管口要插入液面下;
③点燃氢气前,一定要检验氢气的纯度(空气中,氢气的体积达到总体积的4%—74.2%点燃会爆炸。)
①检查装置的气密性
②长颈漏斗的管口要插入液面下;
③不能用排水法收集
16、一些重要常见气体的性质(物理性质和化学性质)
物质
物理性质
(通常状况下)
化学性质
用途
氧气
(O2)
无色无味的气体,不易溶于水,密度比空气略大
点燃
点燃
①C + O2==CO2(发出白光,放出热量)
1、 供呼吸
2、 炼钢
3、 气焊
(注:O2具有助燃性,但不具有可燃性,不能燃烧。)
②S + O2 ==SO2 (空气中—淡蓝色火
点燃
焰;氧气中—紫蓝色火焰)
点燃
③4P + 5O2 == 2P2O5 (产生白烟,生成白色固体P2O5)
④3Fe + 2O2 == Fe3O4 (剧烈燃烧,火星四射,放出大量的热,生成黑色固体)
⑤蜡烛在氧气中燃烧,发出白光,放出热量
氢气
(H2)
无色无味的气体,难溶于水,密度比空气小,是最轻的气体。
点燃
① 可燃性:
点燃
2H2 + O2 ==== 2H2O
H2 + Cl2 ==== 2HCl
1、填充气、飞舰(密度比空气小)
2、合成氨、制盐酸
3、气焊、气割(可燃性)4、提炼金属(还原性)
② 还原性:(不考)
H2 + CuO === Cu + H2O
3H2 + WO3 === W + 3H2O
3H2 + Fe2O3 == 2Fe + 3H2O
二氧化碳(CO2)
无色无味的气体,密度大于空气,能溶于水,固体的CO2叫“干冰”。
CO2 + H2O ==H2CO3(酸性)
(H2CO3 === H2O + CO2↑)(不稳定)
1、用于灭火(应用其不可燃烧,也不支持燃烧的性质)
2、制饮料、化肥和纯碱
CO2 + Ca(OH)2 ==CaCO3↓+H2O(鉴别CO2)
CO2 +2NaOH==Na2CO3 + H2O
CaCO3 == CaO + CO2↑(工业制CO2)
一氧化碳(CO)
无色无味气体,密度比空气略小,难溶于水,有毒气体
①可燃性:2CO + O2 == 2CO2
(火焰呈蓝色,放出大量的热,可作气体燃料)
1、 作燃料
2、 冶炼金属
②还原性:(重点)
CO + CuO === Cu + CO2
3CO + Fe2O3 ==高温2Fe + 3CO2
(跟血液中血红蛋白结合,破坏血液输氧的能力)
17、解实验题:看清题目要求是什么,要做的是什么,这样做的目的是什么。
(一)、实验用到的气体要求是比较纯净,除去常见杂质具体方法:
1. 除水蒸气可用:浓流酸、氢氧化钠固体、碱石灰(氢氧化钠和生石灰混合物)、生石灰等
2.除CO2可用:足量澄清石灰水(可检验出杂质中有无CO2)、NaOH溶液、
3.验CO2可用:澄清石灰水 除HCl气体,(见题目给的信息)
除气体杂质的原则:用某物质吸收杂质或跟杂质反应,但不能吸收或跟有效成份反应,或者生成新的杂质。
(二)、实验注意的地方:
①防爆炸:点燃可燃性气体(如H2、CO、CH4)或用CO、H2还原CuO、Fe2O3之前,要检验气体纯度。
②防暴沸:稀释浓硫酸时,将浓硫酸倒入水中,不能把水倒入浓硫酸中。
③防中毒:进行有关有毒气体(如:CO、SO2、NO2)的性质实验时,在通风厨中进行;并要注意尾气的处理:CO点燃烧掉;SO2、NO2用碱液吸收。
④防倒吸:加热法制取并用排水法收集气体,要注意熄灯顺序。
(三)、常见意外事故的处理:
浓硫酸沾到皮肤或衣物上:先用水冲洗,再用3 - 5% NaHCO3冲洗;
氢氧化钠固体沾到皮肤或衣物上:用水冲洗,再涂上硼酸;
(四)、实验室制取三大气体中常见的要除的杂质:
1、制O2要除的杂质:水蒸气(H2O)
2、用盐酸和锌粒制H2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl,盐酸酸雾)(用稀硫酸没此杂质)
3、制CO2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl)
(五)、常用实验方法来验证混合气体里含有某种气体
1、有CO的验证方法:(先验证混合气体中是否有CO2,有则先除掉)
将混合气体通入灼热的CuO,再将经过灼热的CuO的混合气体通入澄清石灰水。现象:黑色CuO变成红色,且澄清石灰水要变浑浊。
2、有H2的验证方法:(先验证混合气体中是否有水份,有则先除掉)将混合气体通入灼热的CuO,再将经过灼热的CuO的混合气体通入盛有浓硫酸中。现象:黑色CuO变成红色,浓硫酸质量增加。
3、有CO2的验证方法:将混合气体通入澄清石灰水。现象:澄清石灰水变浑浊。
18.解计算题:
计算题的类型有:①有关质量分数(元素和溶质)的计算
②根据化学方程式进行计算
③由①和②两种类型混合在一起计算
溶质质量
溶液质量
(一)、溶液中溶质质量分数的计算
溶质质量分数 = ╳ 100%
某元素相对原子质量╳原子个数
化合物的相对分子质量
(二)、化合物(纯净物)中某元素质量分数的计算
某元素质量分数= ╳ 100%
化合物质量
混合物质量
(三)、混合物中某化合物的质量分数计算
化合物的质量分数= ╳ 100%
元素质量
混合物质量
(四)、混合物中某元素质量分数的计算
某元素质量分数= ╳ 100%
或:某元素质量分数= 化合物的质量分数 ╳ 该元素在化合物中的质量分数