- 4.03 MB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
镇江索普实验学校2012学年九年级化学中考模拟试题⑨
制 卷:吴长顺 时 间: 2013年5月24日
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
答案
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Ca-40 Fe-56 S-32 Ag-108 Cl -35.5
一、单项选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1. 下列变化中属化学变化的是 A.水分蒸发 B、水煮沸 C、水蒸馏 D、水电解
2. 下列关于铁的自我介绍中,属于描述其物理性质的是( )
A.我是能与盐酸反应的银白色金属 B.我具有良好的延展性 C.我能在氧气中燃烧 D.我能与稀硫酸反应
3.下列说法正确的是
A.打开盛硫酸的瓶盖子过会就变质 B.提倡大量使用塑料超薄袋
C.亚硝酸钠有咸味,可以代替食盐作调味品 D.可以用甲醛溶液浸泡标本
4.石油是一种没有固定沸点的油状物,经过汽化、冷凝分离后可得到汽油、煤油等产品。由此可以判定石油属于( )A.混合物 B.纯净物 C.化合物 D.单质
5.水泥属于( )A.非金属材料 B.金属材料 C.有机合成材料 D.复合材料
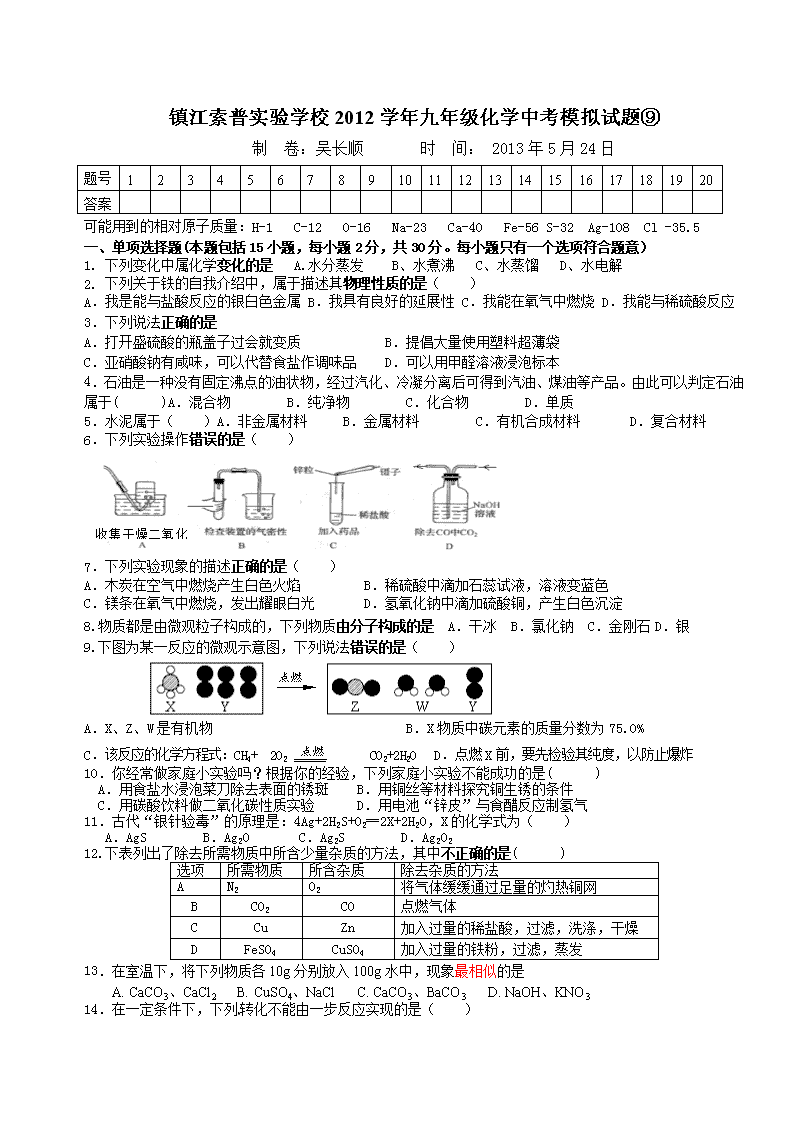
6.下列实验操作错误的是( )
收集干燥二氧化碳
7.下列实验现象的描述正确的是( )
A.木炭在空气中燃烧产生白色火焰 B.稀硫酸中滴加石蕊试液,溶液变蓝色
C.镁条在氧气中燃烧,发出耀眼白光 D.氢氧化钠中滴加硫酸铜,产生白色沉淀
8.物质都是由微观粒子构成的,下列物质由分子构成的是 A.干冰 B.氯化钠 C.金刚石D.银
9.下图为某一反应的微观示意图,下列说法错误的是( )
点燃
A.X、Z、W是有机物 B.X物质中碳元素的质量分数为75.0%
点燃
C.该反应的化学方程式:CH4+ 2O2 CO2+2H2O D.点燃X前,要先检验其纯度,以防止爆炸
10.你经常做家庭小实验吗?根据你的经验,下列家庭小实验不能成功的是( )
A.用食盐水浸泡菜刀除去表面的锈斑 B.用铜丝等材料探究铜生锈的条件
C.用碳酸饮料做二氧化碳性质实验 D.用电池“锌皮”与食醋反应制氢气
11.古代“银针验毒”的原理是:4Ag+2H2S+O2═2X+2H2O,X的化学式为( )
A.AgS B.Ag2O C.Ag2S D.Ag2O2
12.下表列出了除去所需物质中所含少量杂质的方法,其中不正确的是( )
选项
所需物质
所含杂质
除去杂质的方法
A
N2
O2
将气体缓缓通过足量的灼热铜网
B
CO2
CO
点燃气体
C
Cu
Zn
加入过量的稀盐酸,过滤,洗涤,干燥
D
FeSO4
CuSO4
加入过量的铁粉,过滤,蒸发
13.在室温下,将下列物质各10g分别放入100g水中,现象最相似的是
A. CaCO3、CaCl2 B. CuSO4、NaCl C. CaCO3、BaCO3 D. NaOH、KNO3
14.在一定条件下,下列转化不能由一步反应实现的是( )
A.H2CO3→CO2 B.Fe2O3→Fe C.CO2→CaO D.H2SO4→MgSO4
15.原煤(含硫元素)在氧气中不完全燃烧会生成CO、CO2 和SO2。若测得CO、CO2、和SO2的混合气体中碳元素的质量分数为24%,则其中SO2的质量分数不可能是 A.15% B.30% C.20% D.70%
二、不定项选择题(每小题有1~2个正确选项,错选、多选不给分。)
16.食品安全关系到人体健康,下列说法正确的是( )
A.霉变的米中含有黄曲霉素能食用 B.应在国家标准规定的范围内使用食品添加剂
C.用甲醛浸泡水产品,延长保质期 D.将地沟油回收作为食用油
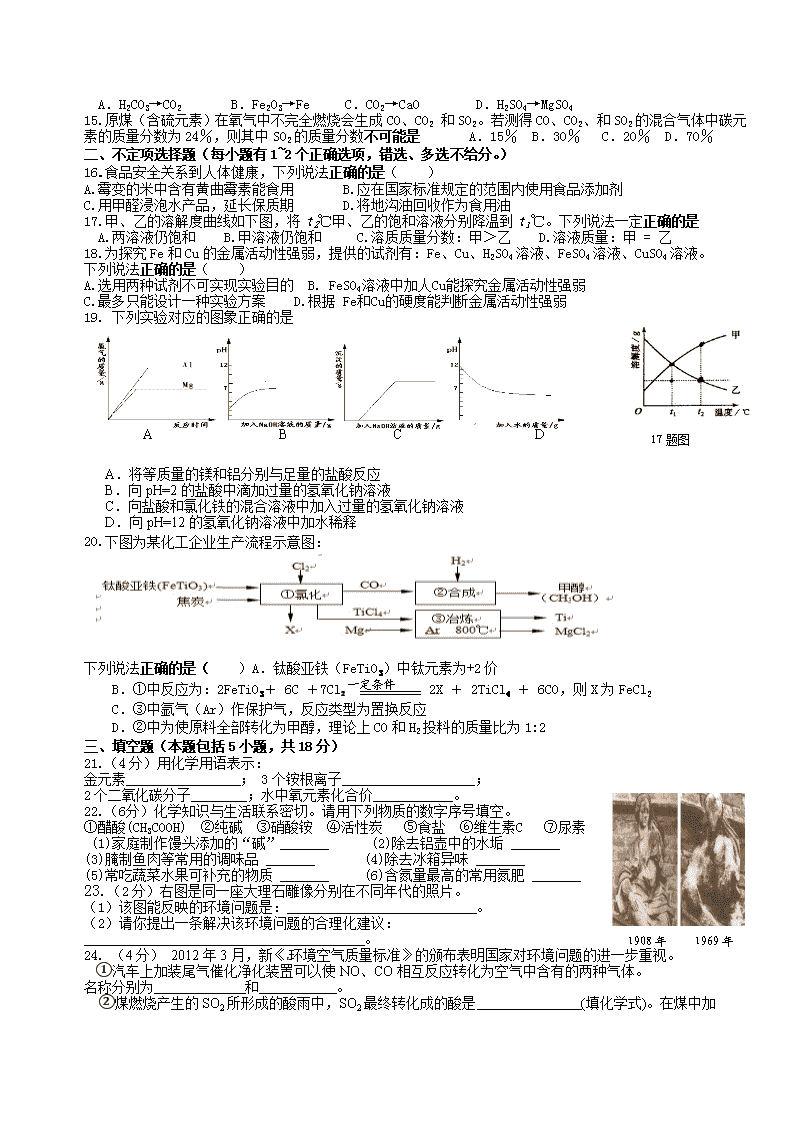
17.甲、乙的溶解度曲线如下图,将t2℃甲、乙的饱和溶液分别降温到t1℃。下列说法一定正确的是
A.两溶液仍饱和 B.甲溶液仍饱和 C.溶质质量分数:甲>乙 D.溶液质量:甲 = 乙
18.为探究Fe和Cu的金属活动性强弱,提供的试剂有:Fe、Cu、H2SO4溶液、FeSO4溶液、CuSO4溶液。
下列说法正确的是( )
A.选用两种试剂不可实现实验目的 B. FeSO4溶液中加人Cu能探究金属活动性强弱
C.最多只能设计一种实验方案 D.根据 Fe和Cu的硬度能判断金属活动性强弱
19. 下列实验对应的图象正确的是
A B C D
17题图
A.将等质量的镁和铝分别与足量的盐酸反应
B.向pH=2的盐酸中滴加过量的氢氧化钠溶液
C.向盐酸和氯化铁的混合溶液中加入过量的氢氧化钠溶液
D.向pH=12的氢氧化钠溶液中加水稀释
20.下图为某化工企业生产流程示意图:
下列说法正确的是( )一定条件
A.钛酸亚铁(FeTiO3)中钛元素为+2价
B.①中反应为:2FeTiO3+ 6C +7Cl2 2X + 2TiCl4 + 6CO,则X为FeCl2
C.③中氩气(Ar)作保护气,反应类型为置换反应
D.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2
三、填空题(本题包括5小题,共18分)
21.(4分)用化学用语表示:
金元素 ; 3个铵根离子 ;
1908年 1969年
2个二氧化碳分子 ;水中氧元素化合价 。
22.(6分)化学知识与生活联系密切。请用下列物质的数字序号填空。
①醋酸(CH3COOH) ②纯碱 ③硝酸铵 ④活性炭 ⑤食盐 ⑥维生素C ⑦尿素
(1)家庭制作馒头添加的“碱”_______ (2)除去铝壶中的水垢 _______
(3)腌制鱼肉等常用的调味品 _______ (4)除去冰箱异味 _______
(5)常吃蔬菜水果可补充的物质 _______ (6)含氮量最高的常用氮肥 _______
23.(2分)右图是同一座大理石雕像分别在不同年代的照片。
(1)该图能反映的环境问题是: 。
(2)请你提出一条解决该环境问题的合理化建议:
。
24. (4分) 2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视。
[来源:Zxx①汽车上加装尾气催化净化装置可以使NO、CO相互反应转化为空气中含有的两种气体。
名称分别为 和 。
②煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是 (填化学式)。在煤中加
入适量石灰石,在氧气的共同作用下,可以与煤燃烧产生的SO2反应生成硫酸钙和二氧化碳气体,发生反应的化学方程式为 。
25. (2分)草酸与硫酸钙反应的化学方程式为H2C2O4十CaSO4=CaC2O4↓十H2SO4请写出草酸钾与硫酸钙反应的化学方程式 。
四、实验题(本题包括2小题,共19分)
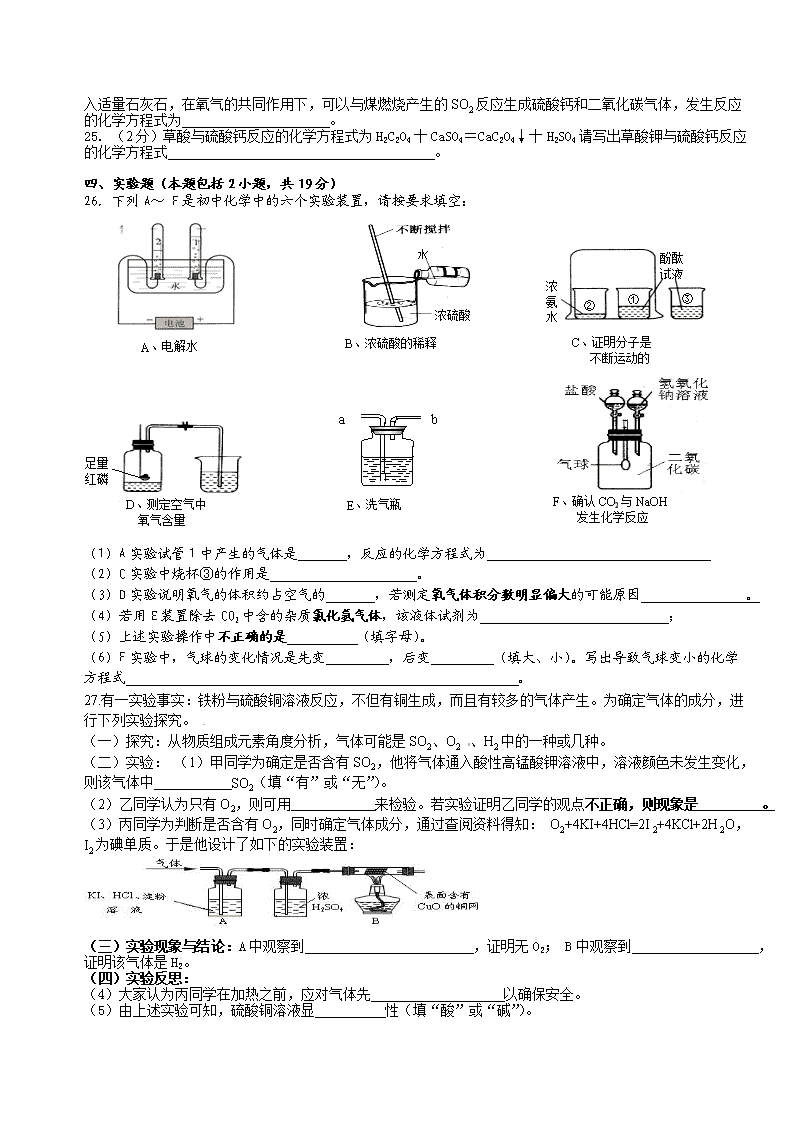
26. 下列A~ F是初中化学中的六个实验装置,请按要求填空:
D、测定空气中
氧气含量
足量
红磷
F、确认CO2与NaOH
发生化学反应
B、浓硫酸的稀释
浓硫酸
水
C、证明分子是
不断运动的
酚酞
试液
浓氨水
①
②
③
A、电解水
E、洗气瓶
a
b
(1)A实验试管1中产生的气体是 ,反应的化学方程式为
(2)C实验中烧杯③的作用是 。
(3)D实验说明氧气的体积约占空气的 ,若测定氧气体积分数明显偏大的可能原因 。
(4)若用E装置除去CO2中含的杂质氯化氢气体,该液体试剂为 ;
(5)上述实验操作中不正确的是 (填字母)。
(6)F实验中,气球的变化情况是先变 ,后变 (填大、小)。写出导致气球变小的化学方程式 。
27.有一实验事实:铁粉与硫酸铜溶液反应,不但有铜生成,而且有较多的气体产生。为确定气体的成分,进行下列实验探究。
(一)探究:从物质组成元素角度分析,气体可能是SO2、O2 、H2中的一种或几种。
(二)实验: (1)甲同学为确定是否含有SO2,他将气体通入酸性高锰酸钾溶液中,溶液颜色未发生变化,则该气体中 SO2(填“有”或“无”)。
(2)乙同学认为只有O2,则可用 来检验。若实验证明乙同学的观点不正确,则现象是 。
(3)丙同学为判断是否含有O2,同时确定气体成分,通过查阅资料得知: O2+4KI+4HCl=2I2+4KCl+2H2O,I2为碘单质。于是他设计了如下的实验装置:
(三)实验现象与结论:A中观察到 ,证明无O2; B中观察到 ,证明该气体是H2。
(四)实验反思:
(4)大家认为丙同学在加热之前,应对气体先 以确保安全。
(5)由上述实验可知,硫酸铜溶液显 性(填“酸”或“碱”)。
五、推断题(本题包括2小题,共10分)
28.现有一包白色固体粉末,可能含有CuSO4、Na2SO4、Na2CO3、BaCl2、KCl中的一种或几种。现做如下实验:(1)取少量白色固体加足量的水溶解,过滤得固体和无色溶液。
(2)向所得固体中加入足量的稀盐酸,固体部分溶解,并有气体产生。根据上述实验现象判断:
①白色固体中一定不含 ,一定含有 ,可能含有 。
②写出(2)中固体部分溶解的反应化学方程式 。
29.某银白色金属M在日常生产和生活中应用最广泛,M的某合金材料是建筑工程中不可缺少的建材,M在右图所示的反应中,可得到A、B、C、D四种产物,A为黑色固体,D的组成中M与Cl的原子个数比为1:3。
⑴A的化学式为(用M的真实元素符号表示,后同) ,A在物质分类中属于 (选填代号字母)。a.单质 b.酸 c.碱 d.盐 e.有机物 f.氧化物 h.混合物
⑵物质B的化学式为 ;M与Cu、(H)三者在金属活动性顺序中由强到弱的排序为: ;
⑶写出下列指定反应的化学方程式:
反应③: ;
反应④: 。
六、综合题(本题共13分)
30.某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑),这种工业成为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究.
I.定性探究
【提出问题】烧碱样品中含有哪些杂质?
【猜想】猜想一:可能含有Na2CO3,作出此猜想的依据是 (用化学方程式表示)。
猜想二:可能含有NaCl,作出此猜想的依据是 ( 用简洁的文字表述)。
【设计实验】
实验步骤
实验现象
解释或结论
①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁
试管外壁发热
原因是
②向①所得的溶液中逐渐加入稀硝酸至过量
一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的气体
样品中含有的杂质是
③向②所得的溶液中滴加几滴硝酸银溶液
产生白色沉淀
样品中还含有的杂质是________
【交流与讨论】
小明同学提出:“上述实验中稀硝酸也可以用稀盐酸代替”,你认为他的观点 (填“正确”或“不正确”),请说明理由 (若上问回答“正确”则不作答。)
II.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程).
【交流与反思】小强同学认为小婉同学设计的探究方案不够严密,其理由是:
(1)探究方案中没考虑 。
(2)探究方案中因缺少_________(填操作名称),导致测得的氯化钠的质量分数偏大。