- 369.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1单元 《走进化学世界》(默写一)
一.绪言
1、元素周期律和元素周期表:
(1)发现人: (俄国)
(2)物质是由元素组成的。如碳酸钙是由 、 、 三种元素组成的。
二.物质的变化和性质
1、物质的变化
物理变化和化学变化的本质区别是是否有 (判断依据)。
火山爆发 房屋倒塌 山体雪崩 融雪洪水 酒精挥发 酒精燃烧 纸张燃烧 矿石粉碎 汽油挥发
铁丝弯曲 冰雪融化 木柴燃烧
石蜡熔化 蜡烛燃烧 湿衣晾干
2、物质的性质
吸附性 助燃性 可燃性
稳定性 导热性 导电性
延展性
三.化学是一门以实验为基础的学科(默写二)
1、吸入空气与呼出气体的比较
结论:与吸入空气相比,呼出气体中 的量减少, 和 的量增多
(吸入空气与呼出气体成分是相同的)
2、检验气体:
(1)鉴别氧气的方法是:用 的木条伸到瓶 ,木条 ,证明是 (氧气越多,木条燃烧越剧烈)
(2)鉴别二氧化碳的方法是:把气体通入 石灰水,石灰水变 ,证明是 (石灰水中越浑浊,气体中二氧化碳的含量越高)
四.走进化学实验室
A、固体药品的取用
①粉末状及小粒状药品:用 ②块状及条状药品:用 夹取
B、液体药品的取用
①液体试剂的倾注法: 取下瓶盖, 在桌上,(以免药品被污染)。标签应 ,(以免残留液流下而腐蚀标签)。拿起试剂瓶,将瓶口 试管口边缘,缓缓地注入试剂,倾注完毕,盖上瓶盖,标签 ,放回原处。
第二单元《我们周围的空气》(默写三)
一、空气
1、 空气的成分和组成
空气成分
O2
N2
CO2
稀有气体
其它气体和杂质
体积分数
%
%
%
%
%
(1)空气中氧气含量的测定
a、现象:有大量 产生,冷却至室温后,打开止水夹,有水流进瓶中, 。
b、结论:N2约占4/5,不支持 ,也不能 ,不易溶于水
c、探究: ①液面上升小于1/5原因: 气, 量不足,瓶内气体未冷却至室温,导气管中还剩余小部分的水。
②能否用铁、铝代替红磷? 原因:
能否用碳、硫代替红磷? 原因:
(2)空气的污染及防治:对空气造成污染的主要是有害气体( 、 、 )和 等
(3)目前环境污染问题:
臭氧层破坏( 、 等) 温室效应( 、 等)
酸雨( 、 等) 白色污染( 等)
2、空气中各成分的性质和用途
(1)氧气: (如潜水、医疗急救)
(如燃料燃烧、炼钢、气焊)
(2)氮气:惰性保护气(化性不活泼)、重要原料(硝酸、化肥)、液氮
氮气的化学性质:稳定性等,重要用途: 、氮肥等
(3)稀有气体(He、Ne、Ar、Kr、Xe等的总称)的化学性质:
重要用途:作保护气、作电光源、霓虹灯等
二.氧气(默写四)
1、氧气与下列物质反应现象
物质
现象
碳
磷
硫
铁
*硫燃烧要在集气瓶底部放少量水的目的:
*铁燃烧要在集气瓶底部放少量水或细砂的目的:
三.氧气的制取(默写五)
1、实验室制备氧气的药品:过氧化氢溶液与二氧化锰、高锰酸钾(含有氧元素的化合物)
2、氧气的制备:
工业制氧气—分离液态空气(原理:氮气和氧气的 不同物理变化)
实验室制氧气原理 (固液常温型)
(方程式) (固固加热型)
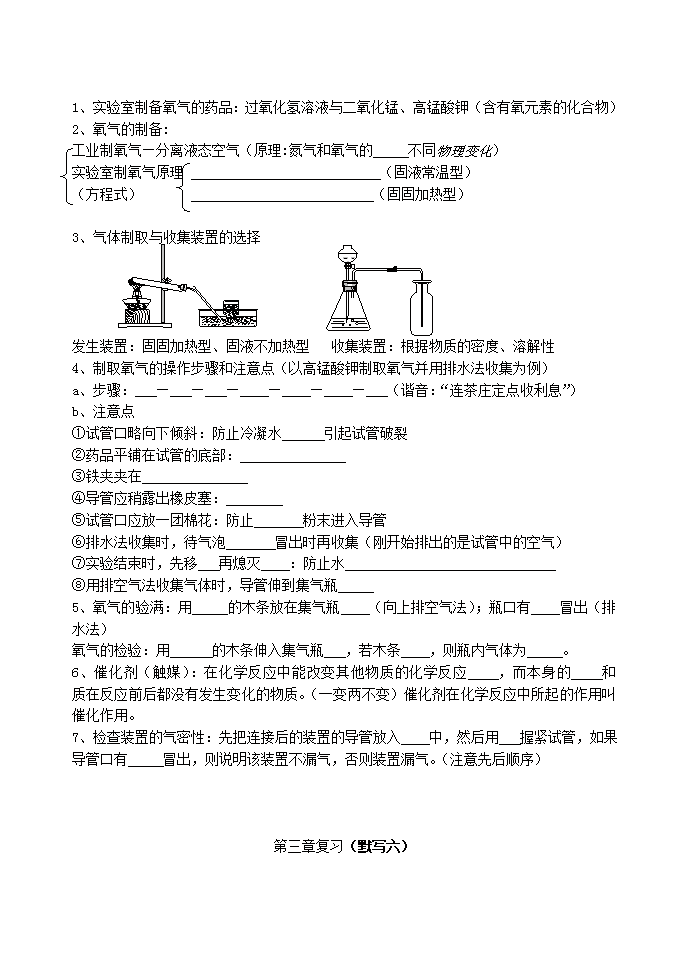
3、气体制取与收集装置的选择
发生装置:固固加热型、固液不加热型 收集装置:根据物质的密度、溶解性
4、制取氧气的操作步骤和注意点(以高锰酸钾制取氧气并用排水法收集为例)
a、步骤: — — — — — — (谐音:“连茶庄定点收利息”)
b、注意点
①试管口略向下倾斜:防止冷凝水 引起试管破裂
②药品平铺在试管的底部:
③铁夹夹在
④导管应稍露出橡皮塞:
⑤试管口应放一团棉花:防止 粉末进入导管
⑥排水法收集时,待气泡 冒出时再收集(刚开始排出的是试管中的空气)
⑦实验结束时,先移 再熄灭 :防止水
⑧用排空气法收集气体时,导管伸到集气瓶
5、氧气的验满:用 的木条放在集气瓶 (向上排空气法);瓶口有 冒出(排水法)
氧气的检验:用 的木条伸入集气瓶 ,若木条 ,则瓶内气体为 。
6、催化剂(触媒):在化学反应中能改变其他物质的化学反应 ,而本身的 和 质在反应前后都没有发生变化的物质。(一变两不变)催化剂在化学反应中所起的作用叫催化作用。
7、检查装置的气密性:先把连接后的装置的导管放入 中,然后用 握紧试管,如果导管口有 冒出,则说明该装置不漏气,否则装置漏气。(注意先后顺序)
第三章复习(默写六)
一、分子与原子
1、分子的性质:________、______、________
2、_________是保持物质化学性质最小的微粒。分子和原子的本质区别________________
3、化学反应的实质:_________________________________________________________
二、原子的构成
1、原子是由________和__________构成的,质量集中到_____________上。
2、在原子里的两个等式:①_________=_ = = 。
② _______________≈__________+_________
三、元素
1、地壳中含量列前五位的元素 、 、 、 、 。
2、元素的种类决定于 元素的化学性质决定于
3、元素的分类 金属元素: 最外层电子数
非金属元素: 最外层电子数
稀有气体: 最外层电子数
4、元素周期表
16 S
硫
32.06
四、离子(默写七)
1、原子、阳离子、阴离子的判断:
① 原子:质子数=核外电子数 不显电性
② 阴离子:质子数<核外电子数 带 电
③ 阳离子:质子数>核外电子数 带 电
五 物质的构成
原子:_______、_______、_________:Fe、C、P、He等。
物质构成 分子(①非金属单质、②非金属+非金属(或酸根)组成的物质):________
离子(金属(或铵根)+非金属元素(或酸根)组成的物质):________
六、化学式与化合价
1、常见元素和原子团的化合价
一价 ;二价
原子团:负一 、负二 、正一价 。
2、化合物中各元素 为零,单质中元素化合价为
3、化学式的计算:NH4NO3中,N、H和O原子的个数比________;
N、H和O元素的质量比________; N元素的质量分数______________
七、写出下列符号的意义(默写八)
O 、 2O
H2O 、 、 、 2H2O
O2-: 、 2 O2-: 、 。
写出负二价的氧元素: 以上符号中,只具有微观意义的符号是______________。
第四章复习
一、水的组成
电解水实验:正极气体: 负极气体: 正负极气体体积比: 质量比:
结论:水是由 组成的。
该反应的方程式:
二、水的净化
1、按净化程度由低到高的顺序,净化水的方法是 、 、 、
2、用来分离固体和液体的方法是_________。活性炭的作用是 。
3、过滤操作中使用的玻璃仪器有:
玻璃棒的作用是
4、区别硬水与软水用 ;硬水软化生活中用 实验室用
三、物质的分类(填定义)
单质___________________化合物___________________氧化物
第五单元 质量守恒定律(默写九)
1、内容: 的物质的质量总和等于 各物质的质量总和。
2、守恒的微观原因:
3、在化学反应前后,
六不变:1.___________2.____________ 3.__________ 4._________5._________6._______
两个一定变:1. ________________ 2.______________
两个可能变:1. ________________ 2.______________
4、基本反应类型(举例)
(1)化合反应:
(2)分解反应:
(3)置换反应:
碳和碳的氧化物(默写十)
一、 一氧化碳的化学性质:
1、一氧化碳的毒性:原因_____________
2、一氧化碳燃烧,现象_____________________ 方程式_____________________
3、一氧化碳还原氧化铜或氧化铁
2.1、一氧化碳还原氧化铜,现象:_______________________________,
方程式____________________________________
2.2、一氧化碳还原氧化铁,现象:_______________________________,
方程式____________________________________
2.3、实验开始时要先通一氧化碳一段时间,再开始加热,原因是____________________。实验结束时要先停止加热,继续通一氧化碳至冷却到室温。原因是____________________。
2.4、上述装置的不足之处是____________________。
二、二氧化碳的物理性质和化学性质(默写十一)
1. 二氧化碳的物理性质
二氧化碳的密度比空气_____,_____溶于水,固态的二氧化碳俗称为________。
2. 二氧化碳的化学性质
2.1二氧化碳的两不____________________________
右图所示实验的现象:________________________
原因:_______________________________________
2.2 二氧化碳与___________的反应
上述四个反应:_____有明显的实验现象,原因是______________________________
2.3二氧化碳与___________反应
2.3.1 二氧化碳与氢氧化钙溶液反应的方程式:________________________________
2.3.2 二氧化碳与氢氧化钠溶液反应的方程式:_______________________________
三、气体的制取:(默写十二)
选择合适的装置填入表格
发生
装置
收集装置
及原因
检验
验满
二氧化碳
氧气
1、制取气体前必须对装置进行___________________操作。
2、A装置中长颈漏斗必须伸入液面以下,原因是_____________。
3、写出制取二氧化碳的反应方程式_______________________________。写出制取氧气的反应方程式______________________________或______________________________。
4、写出检验二氧化碳的反应方程式______________________________________。
四 、性质与用途(默写十三)
碳的单质
碳的氧化物
C60
石墨
金刚石
一氧化碳
二氧化碳
物理性质
深灰色金属光泽,质软,导电
无色透明,最坚硬
无色无味,密度___于空气,___溶于水
无色无味,密度___于空气,___溶于水
化学性质
常温稳定,
可燃性,还原性
、 、
不供给呼吸,不支持燃烧,溶于水显___性
用途
写出标序号的反应的方程式(默写十四)
1
2
3
4
5
6
7
8
金属和金属材料(默写十五)
一、金属的物理性质:
有金属光泽,能导电导热,有延展性
常温下为银白色(_____是紫红色),固体(_____为液态),密度较大
合金:有更好的性能,熔点____于组成它的金属,硬度____于组成它的金属。
金属的活动性顺序:
K Ca Na __ __ __ __ Sn Pb (H) __ Hg __ Pt Au
二、金属的化学性质:
1、与氧气反应
1.1、_______在空气中迅速氧化,生成致密氧化层,可防止生锈。
1.2、活动性________的金属一般更容易与氧气反应。绝大部分金属在自然界中以化合物形式存在,除了__________等几种活动性很弱的金属。
1.3、铁生锈通常是铁与_________和__________共同作用的结果。_____________,_____________,____________可以有效防止金属锈蚀。
2、______的金属可置换出盐酸、稀硫酸中的氢元素。金属的活动性越强,则反应越_______。
3、______的金属能把_______的金属从其化合物溶液中置换出来.例如,Al_____(填“可以”或“不能”,下同)与CuSO4反应置换出铜,Cu_______与AlCl3反应置换出铝。
7单元:(默写十六)
1、燃烧的条件: 、 、
2、CO2灭火的原理:
水灭火的原理:
3、燃料充分燃烧的两个条件: 、
4、一切可燃性气体在点燃前要 。
5、三大化石燃料: 、 、 。
6、 、 的排放会引起酸雨
7、甲烷燃烧方程式 ;
绿色可再生能源乙醇燃烧方程式:
最清洁的高能能源氢气燃烧方程式:
8、人类需要的大部分能量都是通过化学反应得到的。化学反应一定伴随着能量的变化,通常表现为热量的变化。吸热反应: ;放热反应有 ; 。
12单元:(默写十七)
1、六大营养素: 、 、 、 、
其中能提供能量的是 ;
属于有机物的是 。
2、缺乏VA: 缺乏VC:
3、缺铁会引起 ,缺锌会引起: ,
缺钙会引起: ,缺碘会引起:
4、三大有机合成材料:
有机物一定含有 元素,除了 。
有机高分子的相对分子质量非常大,通常情况下为
5、瘦肉、牛奶、鱼类、鸡蛋富含的营养素是 ;馒头、米饭富含的营养素是 ;水果、蔬菜富含的营养素是 ;植物油、肥肉富含的营养素是 ;
1.实验室制备二氧化碳 ______________________________________________
2.加热高锰酸钾制取氧气 __________________________________________
3.铜与硝酸银溶液反应____________________________________
4.一氧化碳还原氧化铁____________________________________
5. CO2通入澄清石灰水 _____________________________________________
6.过氧化氢溶液中加入二氧化锰______________________________________