- 457.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
中考专题复习 金 属
一.合金
1.(厦门) 夏天防雷电,远离金属。这是国为金属具有( )
A.导电性 B.导热性 C.延展性 D.光泽
2. (宜昌) 下列物质中,不属于合金的是( )
A.不锈钢 B.氧化汞 C.黄铜 D.生铁
3.(2015•株洲)下列有关金属及合金的说法中正确的是( )
A. 合金是由两种或两种以上金属熔合而成的具有金属特性的物质
B. 在日常生活中,大量使用的常常不是纯金属,而是它们的合金
C.“真金不怕火炼”说明黄金的硬度非常 大 D. 铜的化学性质不活泼,所以铜制品不会生锈
二.炼铁原理
4. (襄阳)钢铁在生产、生活中有着广泛的用途。请回答:
(1)炼铁厂常以焦炭、赤铁矿石(主要成分是Fe2O3)、空气等为主要原料炼铁,请写出一氧化碳与氧化铁在高温下反应的化学方程式: 。
(2)每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失。请你写出一种防止铁锅生锈的方法: 。
5.(2015•莱芜)利用化学变化可以制备新物质.CO是一种无色、无臭的气体,密度比空气略小,难溶于水,易于血红蛋白结合,具有可燃性.请结合所学知识和CO的相关信息回答下列问题:
(1)下列两个反应都能生成CO,从实验室制备气体的思路分析,实验室制备CO选择反应②而不用①的理由是 (任选一个角度回答)①炽热的焦炭和水蒸气反应:C+H2OCO↑+H2↑
②草酸晶体和浓硫酸H2C2O4CO2↑+CO↑+H2O
(2)某同学设计下列装置制备、提纯CO,并用CO来还原氧化铁.请根据如图回答:
①写出一氧化碳还原氧化铁的化学反应方程式 .
②该同学的设计存在的一处明显缺陷是 .用改进后装置进行实验,在点燃E处酒精灯之前,必须进行的一项操作是 (从实验安全角度考虑).
③装置B的作用是 ,B中发生反应的化学方程式为 .
④证明一氧化碳能还原氧化铁的实验现象是:装置E中固体颜色的变化为 ,C中 ,F中 .
三.金属与酸的反应
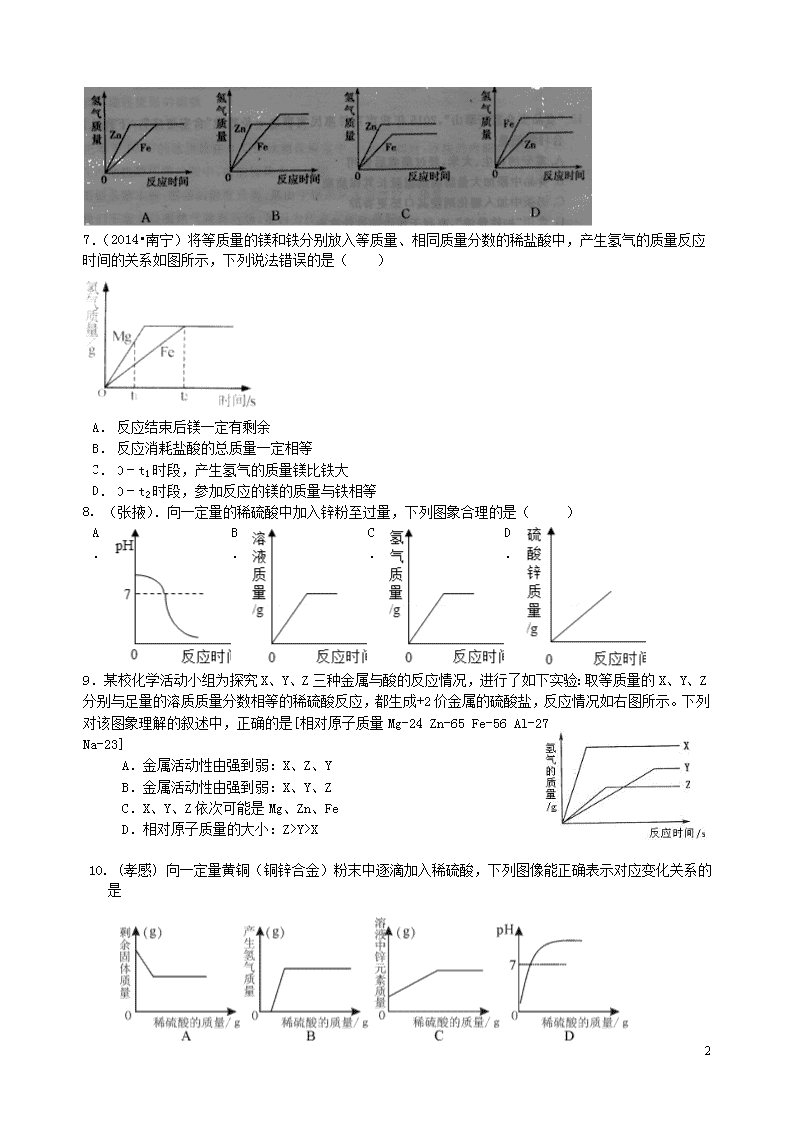
6.向等质量的锌粉和铁粉中分别加入足量稀硫酸,下列图像描述正确的是( )
7
7.(2014•南宁)将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量反应时间的关系如图所示,下列说法错误的是( )
A.
反应结束后镁一定有剩余
B.
反应消耗盐酸的总质量一定相等
C.
0﹣t1时段,产生氢气的质量镁比铁大
D.
0﹣t2时段,参加反应的镁的质量与铁相等
8. (张掖).向一定量的稀硫酸中加入锌粉至过量,下列图象合理的是( )
A.
B.
C.
D.
9.某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如右图所示。下列对该图象理解的叙述中,正确的是[相对原子质量Mg-24 Zn-65 Fe-56 Al-27 Na-23]
A.金属活动性由强到弱:X、Z、Y
B.金属活动性由强到弱:X、Y、Z
C.X、Y、Z依次可能是Mg、Zn、Fe
D.相对原子质量的大小:Z>Y>X
10. (孝感) 向一定量黄铜(铜锌合金)粉末中逐滴加入稀硫酸,下列图像能正确表示对应变化关系的是
7
11. (呼和浩特)下列四个图像分别对应四个变化过程,其中正确的是
A.一定量的饱和石灰水中加入氧化钙
B.常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
C.等体积,等浓度的双氧水制取氧气
D.服用胃舒平[主要成分Al(OH)3]治疗胃酸过多,胃液pH的变化
四.金属与盐溶液的反应
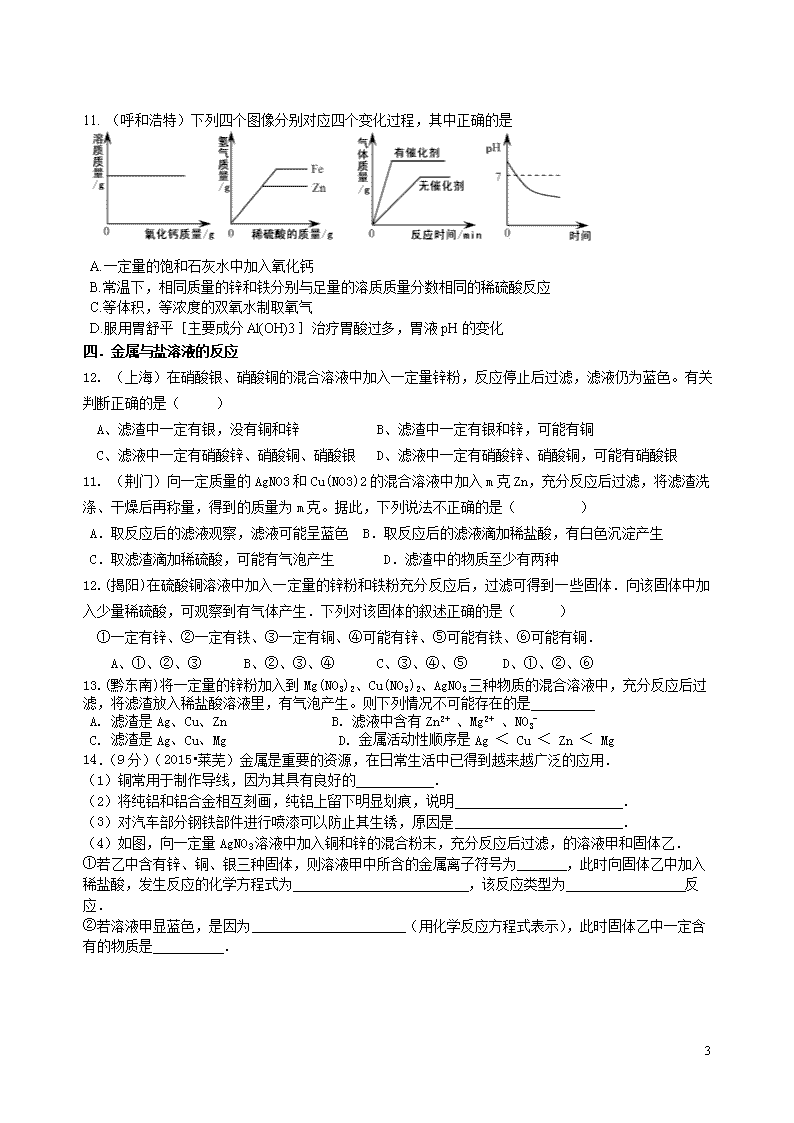
12. (上海)在硝酸银、硝酸铜的混合溶液中加入一定量锌粉,反应停止后过滤,滤液仍为蓝色。有关判断正确的是( )
A、滤渣中一定有银,没有铜和锌 B、滤渣中一定有银和锌,可能有铜
C、滤液中一定有硝酸锌、硝酸铜、硝酸银 D、滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
11. (荆门)向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入m克Zn,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的质量为m克。据此,下列说法不正确的是( )
A.取反应后的滤液观察,滤液可能呈蓝色 B.取反应后的滤液滴加稀盐酸,有白色沉淀产生
C.取滤渣滴加稀硫酸,可能有气泡产生 D.滤渣中的物质至少有两种
12.(揭阳)在硫酸铜溶液中加入一定量的锌粉和铁粉充分反应后,过滤可得到一些固体.向该固体中加入少量稀硫酸,可观察到有气体产生.下列对该固体的叙述正确的是( )
①一定有锌、②一定有铁、③一定有铜、④可能有锌、⑤可能有铁、⑥可能有铜.
A、①、②、③ B、②、③、④ C、③、④、⑤ D、①、②、⑥
13.(黔东南)将一定量的锌粉加入到Mg(NO3)2、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,将滤渣放入稀盐酸溶液里,有气泡产生。则下列情况不可能存在的是
A. 滤渣是Ag、Cu、Zn B. 滤液中含有Zn2+ 、Mg2+ 、NO3-
C. 滤渣是Ag、Cu、Mg D. 金属活动性顺序是Ag < Cu < Zn < Mg
14.(9分)(2015•莱芜)金属是重要的资源,在日常生活中已得到越来越广泛的应用.
(1)铜常用于制作导线,因为其具有良好的 .
(2)将纯铝和铝合金相互刻画,纯铝上留下明显划痕,说明 .
(3)对汽车部分钢铁部件进行喷漆可以防止其生锈,原因是 .
(4)如图,向一定量AgNO3溶液中加入铜和锌的混合粉末,充分反应后过滤,的溶液甲和固体乙.
①若乙中含有锌、铜、银三种固体,则溶液甲中所含的金属离子符号为 ,此时向固体乙中加入稀盐酸,发生反应的化学方程式为 ,该反应类型为 反应.
②若溶液甲显蓝色,是因为 (用化学反应方程式表示),此时固体乙中一定含有的物质是 .
7
15.(2015•青岛)某化工厂的废液中含有硝酸银、硝酸亚铁和硝酸锌.某同学取适量的上述废液样品,将一定质量的镁粉加入样品中,充分反应后过滤,得到滤液和滤渣.请填空:
(1)若得到的滤液为浅绿色,则滤液中的溶质一定含有 (填写化学式,下同),可能含有 .
(2)若得到的滤液为无色,则滤渣中至少含有 种金属.
(3)反应后得到滤渣的质量 (选填“小于”、“大于”或“等于”)反应前加入镁粉的质量.
五.判断金属活动性强弱
16.(郴州)下列可用于验证 Fe、Cu、Ag 三种金属的活动性顺序的一组药品是
A.Fe、Cu、H2SO4 溶液 B.Cu、Ag、FeSO4 溶液
C.Fe、Ag、CuSO4 溶液 D.Ag、FeSO4 溶液、CuSO4 溶液
17.(娄底)现将X、Y两种金属片分别插入硫酸铜溶液中,X无明显变化,Y表面有铜析出,则X、Y、Cu三种金属的活动性由强到弱的顺序是
A.X > Y > Cu B. Cu > X > Y
C. Y > Cu > X D. X > Cu > Y
18. (宜昌) 把X、Y、Z三种金属分别放入稀盐酸中,X、Y溶解并有气泡产生,Z不反应,取过量X放入Y(NO3)2和Z(NO3)2的混合溶液中充分反应后过滤,经检验,滤渣中只有X、Z。则X、Y、Z三种金属的活动性由强到弱的顺序是
A.X>Y>Z B.Y>Z>X C.Y>X>Z D.X>Z>Y
19.(海南)小明为了比较X、Y、Z、W 四种金属的活动性顺序,利用这四种金属单质、稀盐酸、Z的硝酸盐溶液和W 的硝酸盐溶液,进行有关实验,结果如下表(“√”表示能反应,“—”表示不能反应,“空白”表示未做该实验)。请你判断四种金属的活动性顺序为:
A. Y>Z>X>W B. X>Y>W>Z C. X>W>Y>Z D. W>X>Y>Z
20. (天津)金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是 (填字母)
A. 铂金饰品 B. 铁锅 C. 铝导线
(2)为了验证铝、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是
①将铝、银分别浸入到硫酸铜溶液中 ②将银分别浸入到硫酸铝、硫酸铜溶液中
③将铜、银分别浸入到硫酸铝溶液中 ④将铜分别浸入到硫酸铝、硝酸银溶液中
(3)在氯化铜和氯化亚铁的混合溶液中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。①滤液中一定含有的溶质是 (填化学式);②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是 (填化学式)。
六.铁生锈
21.(2015•株洲)下列措施不能在一定程度上防止金属生锈的是( )
7
A. 在金属表面涂油或刷漆 B. 在金属表面镀上一层耐腐蚀的铬
C. 制成耐腐蚀的合金 D. 用砂纸擦去铝制品表面的氧化膜
22. (眉山) 某化学兴趣小组进行铁生锈的实验探究活动。
[探究一] 铁生锈的条件
(1)该兴趣小组将洁净无锈的铁钉分别置于上图所示装置中,经过一段时间观察 ,(填装置序号)装置中出现了明显的锈迹。他们的结论:铁生锈是因为铁与空气中的 等发生了化学反应。
(2)甲同学提出了疑问:空气中的氮气、二氧化碳没有参与铁的生锈过程吗?请设计实验为甲同学释疑。 ,观察并记录现象即可证明。
[探究二] 影响铁生锈速率快慢的因素
乙同学说:妈妈常说菜刀沾有盐水生锈更快。这种说法对吗?同学广泛查阅资料。
资料一:导电性强的溶液都可加速铁的生锈。
资料二:海上航行的轮船在与海水接触的部分镶嵌一锌块,能有效降低钢材被腐蚀的速率。
(3)将上述A装置中的蒸馏水改为下列液体中的 ,可使铁生锈的速率加快。
a、硫酸钠溶液 b、无水乙醇 C、蔗糖溶液
(4)一些铁制品表面覆盖了某些涂层。不同的涂层被破坏后,铁生锈的速率不同。你认为下列 涂层破坏后,铁生锈的速率较快。 a、镀锌铁 b、镀锡铁
(5)一些建筑的大门刷上了一层银白色的金属,你认为该金属可能是 。
a、银粉 b、铜粉 c、镁粉
[交流与思考]
(6)写出一种防止铁生锈的方法 。
七.综合性题目
23.实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:
请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是 ;固体B的化学式为 。
(2)写出步骤①其中一个反应的化学方程式 ;
7
步骤④发生反应的化学方程式为 。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是 。
(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量 (填大于、小于或等于)原废液中硫酸锌的质量。
24. (宜宾)黄铜是Zn以主要添加元素的铜合金。黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
已知:ZnO+H2SO4=ZnSO4+H2O; CuO+H2SO4=CuSO4+H2O
(1) 步骤Ⅰ中产生气体的化学方成式为 。
(2) 溶液A中的金属阳离子有 (填化学式)
(3) 步骤Ⅰ、Ⅱ中均包含的操作名称为 ,此操作和步骤Ⅲ中的蒸发操作
都要用到的玻璃仪器是 。
(4)溶液A (填“大于”、“小于”或“等于”)溶液C的质量。
25. (黄冈)王老师在某工厂废水处理池中提取一瓶含有AgNO3、Cu(NO3)2和Al(NO3)3的工业废水样品带回实验室。静置,取上层清液,加入锌粉,充分反应后过滤,得到滤液甲和滤渣乙。请你和你的化学小组完成以下探究(不考虑杂质干扰)。
【提出问题】滤渣乙是什么?
【做出猜想】小明认为滤渣乙是银,小东认为滤渣乙是银和铜,小华认为滤渣乙是银、铜和铝,你认为滤渣乙还可能是______________。
【交流讨论】大家经过讨论后,认为小华的猜想错误,理由是_______________________。
【实验探究】设计实验探究滤渣乙的成分,请填写下列空白:
实验步骤
现象
结论
实验1:取滤渣乙加入盐酸
无气体产生
滤渣乙可能是___________
实验2:取滤液甲加入_____
无蓝色沉淀
滤渣乙一定是___________
【反思交流】通过交流,大家认为在滤液甲中加入稀盐酸,当观察到______________,也能得出实验1的结论。
八.计算题
26. (张掖) 某同学为探究铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应),实验数据如下表:根据该同学的实验,试回答以下问题:
第一次
第二次
第三次
第四次
所取合金的质量∕g
10
10
20
30
所加稀硫酸的质量∕g
100
120
80
X
生成氢气的质量∕g
0.2
0.2
0.2
Y
(1)上表第四次实验中合金里的铁恰好与稀硫酸完全反应,则其中X= Y= .
(2)该铜铁合金中铁的质量分数是多少?
(3)所加稀硫酸溶质质量分数为多少?(结果保留至0.1%).
7
27.(鄂州)为测定某Cu-Zn合金中铜的质量分数,某同学将10g该合金放入到盛有40g足量稀硫酸的烧杯中,充分反应后,测得烧杯中剩余物的质量为49.9g。
(1)生成氢气的质量为_______;
(2)计算原合金中铜的质量分数。
7