- 1.11 MB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2010年全国中考化学单元汇编之溶液
(10哈尔滨11).右图是a、b两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是( )
A.b的溶解度大于a的溶解度
B.t1℃时,将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等
C.将t2℃时的b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液
D.t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数
(10武汉27).(3分)有些金属的氢氧化物有相似的化学性质,但物理性质却有所不同,如Ca(OH)2,Ba(OH)2的溶解度就存在一定的差异,如下表所示:
温度/℃
0
40
80
溶解度/g
Ca(OH)2
0.187
0.141
0.094
Ba(OH)2
1.67
8.22
101.4
根据以上信息回答下列问题。
(1) 下图中,表示Ca(OH)2溶解度曲线的是 ( 填“A”或“B”)。
(2) 如果要将Ca(OH)2的不饱和溶液转为饱和溶液,可采取的方法是 (只举一种)
(3) 现有常温时含Ca(OH)2,Ba(OH)2两种溶质的某饱和溶液,若要得到较纯净的Ba(OH)2溶液,采取的物理方法为 。
答案:27.(1)B
(2)升高温度(或恒温蒸发溶剂、加溶液质、加氢氧化钙、加熟石灰、加消石灰、加Ca(OH)2,加生石灰、加CaO等)
(3)加热后趁热过滤(或升高温度后立即过滤;降温结晶、过滤,再将晶体溶于蒸馏水)
19(10红河21)如右图是a、b、c三种物质的(均不含结晶水)的
溶解度曲线,请回答:
(1)0°C时,a、b、c三中物质的溶解度由大到小排列顺序是
c b a 。
(2)要从a溶液中得到a,通常采用 降温结晶(冷去热饱和溶液)
的方法。
(3)t2°C时,将30ga物质加入到50g水中充分溶解,所形成
溶液的质量为 75 g。
(4)将t2°C的a、b、c三中物质的饱和溶液降温至t1°C时,
所得溶液中溶质质量分数最小的是 c 。
1.(10娄底16)物质在溶解时,常常会使溶液的温度发生改变。下列物质溶于水时,温度无明显变化的是
A.浓硫酸 B.氢氧化钠固体 C.硝酸铵固体 D.食盐
2.(10茂名2)下列说法不正确的是
A、石油属于混合物 B、二氧化锰属于氧化物
C、水结成冰时,水分子的质量变小 D、硝酸铵固体溶于水时会吸收热量
3.(10日照2)将下列四种物质分别放入水中,能形成溶液的是
A.泥土 B.氢气 C.蔗糖 D.汽油
4. (10日照6)下列物质加入水中,吸收热量的是
A.硝酸铵 B.氢氧化钠 C.浓硫酸 D.生石灰
5.(10邵阳4)下列物质属于溶液的是
A.矿泉水 B.油水 C.泥水 D.蒸馏水
6. (10内江14)下列物质属于纯净物的是
A.液化空气 B.石油 C.蒸馏水 D.碘酒
1.(10邵阳27)小华在实验室帮老师整理药品时,发现一瓶失去标签的白色固体,老师告知是NaOH、CuSO4、NaCl、CaCO3中的一种。小华思考片刻后,认为取少量白色固体放入水中就能确定其成分,她的理由是:
(1)若不溶于水,则是_________。
(2)若溶于水形成蓝色溶液,则是__________。
(3)若溶于水溶液温度升高,则是_________。
(4)若溶于水溶液温度基本不变,则是__________。
(1)CaCO3 (2)CuSO4 (3)NaOH (4)NaCl
1.(10茂名10)右图为A、B两种不带结晶水的固体物质溶解度曲线。下列说法不正确的是
A、30℃时,A物质的溶解度为20g
B、20℃时,A和B的溶解度相同
C、10℃时,等质量的A和B的饱和溶液中,B的溶剂最少
D、等质量的A和B的饱和溶液从30℃降低到20℃,B析出的晶体最多
2.(10邵阳13)右图表示的是a、b两种固体物质的溶解度曲线,下列叙述正确的是
A.a的溶解度大于b的溶解度
B.a、b两物质的溶解度受温度影响都很小
C.在t℃时,a、b两物质的饱和溶液中溶质质量分数相等
D.当b中含少量a时,可用冷却热饱和溶液的方法提纯b
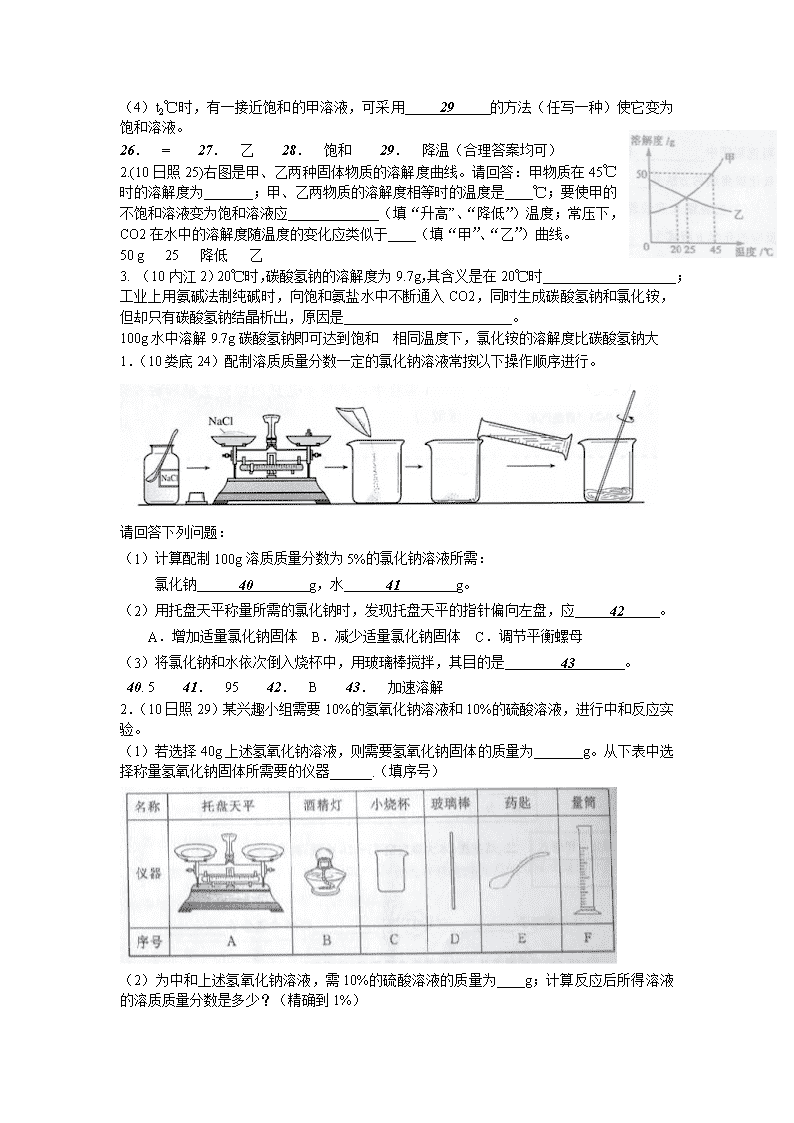
1.(10娄底21)右图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
甲
乙
0 t1 t2 温度/℃
溶解度/g
80
(1)t1℃时,甲物质的溶解度 26 乙物质的溶解
度(填“>”、“=”或“<”)。
(2)甲、乙两种物质的溶解度受温度影响较小的是 27
物质。
(3)t2℃时,把100g乙物质放入100g水中,充分搅拌,
所得溶液是 28 溶液(填“饱和”或“不饱和”)。
(4)t2℃时,有一接近饱和的甲溶液,可采用 29 的方法(任写一种)使它变为饱和溶液。
26. = 27. 乙 28. 饱和 29. 降温(合理答案均可)
2.(10日照25)右图是甲、乙两种固体物质的溶解度曲线。请回答:甲物质在45℃时的溶解度为_______;甲、乙两物质的溶解度相等时的温度是____℃;要使甲的不饱和溶液变为饱和溶液应_____________(填“升高”、“降低”)温度;常压下,CO2在水中的溶解度随温度的变化应类似于____(填“甲”、“乙”)曲线。
50 g 25 降低 乙
3. (10内江2)20℃时,碳酸氢钠的溶解度为9.7g,其含义是在20℃时___________________;工业上用氨碱法制纯碱时,向饱和氨盐水中不断通入CO2,同时生成碳酸氢钠和氯化铵,但却只有碳酸氢钠结晶析出,原因是________________________。
100g水中溶解9.7g碳酸氢钠即可达到饱和 相同温度下,氯化铵的溶解度比碳酸氢钠大
1.(10娄底24)配制溶质质量分数一定的氯化钠溶液常按以下操作顺序进行。
请回答下列问题:
(1)计算配制100g溶质质量分数为5%的氯化钠溶液所需:
氯化钠 40 g,水 41 g。
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 42 。
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 43 。
40. 5 41. 95 42. B 43. 加速溶解
2.(10日照29)某兴趣小组需要10%的氢氧化钠溶液和10%的硫酸溶液,进行中和反应实验。
(1)若选择40g上述氢氧化钠溶液,则需要氢氧化钠固体的质量为_______g。从下表中选择称量氢氧化钠固体所需要的仪器______.(填序号)
(2)为中和上述氢氧化钠溶液,需10%的硫酸溶液的质量为____g;计算反应后所得溶液的溶质质量分数是多少?(精确到1%)
(1)4 A C E (2)49 8%
3.(10邵阳25)实验室配制溶质质量分数一定的溶液时,可能涉及以下操作:A.称量 B.计算 C.溶解 D.装瓶贴标签。回答下列问题:
(1)用氯化钠固体和蒸馏水配制50g6%的氯化钠溶液时,其操作顺序是___________(填序号)。
(2)配制上述溶液需要用到的玻璃仪器有量筒、玻璃棒和________,其中玻璃棒在该实验中所起的作用是______________。
(1)BACD (2)烧杯 搅拌,加速溶解
4. (10内江3)农业上经常用16%的食盐溶液来选种,如果溶液太浓或太稀都会使优种筛出。小明准备配制500g这种食盐溶液帮家里选种,他应该称量________g食盐,在用量筒量取所需水的过程中,小明俯视读数,这样配得的溶液浓度会________(填“偏高”、“偏低”、或“无影响”)。
80 偏高
1.(福建南安14.)右图是甲、乙两种物质的溶解度曲线,下列说法正确的是
A.甲的溶解度受温度影响比乙小
B.15℃时甲、乙的溶解度相等
C.30℃时乙的溶解度为30g
D.升高温度可使接近饱和的甲溶液变为饱和
1.(福建南安22.)(4分)2010年4月14日,青海省玉树县发生大地震,某护士为在帐篷里的一位病人滴注500mL的生理盐水(NaCl的质量分数为0.9%,溶液的密度约为1g/mL)。计算500mL的生理盐水中NaCl的质量为 g,水的质量为 g。
4.5 495.5 (各2分,共4分)
1.(福建省福州15.)(5分)请根据图7中A、B两种固体物质的溶解度曲线,回答下列问题。
(l)在____℃时,A、B两种物质溶解度相同。
(2) t2℃时,100g水中溶解_ gA物质恰好达到饱和,该饱和溶液中溶质的质量分数为_ ___,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 g。
(3)将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是___ _。
(1)t1 (2)25 20% 125 (3)B
24.(5分) 右图为A、B、C三种物质的溶解度曲线,据图回答:
A
B
C
0 t1 20 t2 温度/℃
g
40
溶解度
⑴ t20C时,A、B、C三种物质的溶解度由大到小
顺序是 A>B>C 。
⑵ 将t20C时三种物质等质量的饱和溶液分别降
温到00C时,析出溶质最多的是 A ,
无溶质析出的是 C 。
⑶ 20℃时,将30g A物质放入50g水中,充分搅拌,所得溶液的质量是 70 g。
⑷ 若将t10C三种物质的饱和溶液分别升温到t20C时,则三种溶液中溶质的质量分
数由大到小的顺序是 B>A>C 。
(10株洲中考)26.(4分)右图是A、B两种物质的溶解度曲线,请回答:
(1)t3℃时,把46g固体A放入100g水中,充分溶解后可得到A的 溶液(填“饱和”或“不饱和”)。
(2)t1℃时,A、B两种物质溶解度的大小关系为A B(填“>”、“<”或“=”,下同)。
(3)在其他条件不变的情况下,若把tl℃时A、B
的饱和溶液分别升温至t2℃,此时两种溶液中溶质的质量分数的大小关系为A B:若把t3℃时A、B的饱和溶液分别降温至t2℃,此时两种溶液中溶质的质量分数的大小关系为A B。
26、(1)不饱和,(2)﹤,(3)﹤,=:
(2010扬州18.)甲、乙的溶解度曲线如图,将t2℃甲、乙的饱和溶液分别降温到t1℃。下列说法一定正确的是(BC)
A.两溶液仍饱和 B.甲溶液仍饱和
C.溶质质量分数:甲>乙 D.溶液质量:甲 = 乙
1.(10广州15)配制2000g生理盐水(溶质质量分数为0.9%),需要称取氯化钠的质量为( B )
A 9g B18g C 90g D180g
(2010·山东莱芜,9)下图为氯化铵和硫酸钠的溶解度曲线。下列说法中不正确的是
A.30℃时,氯化铵、硫酸钠的溶解度相同
B.氯化铵的溶解度随温度的升高而增大
C.将50℃时硫酸钠的饱和溶液降低温度,始终有晶体析
D.将60℃时硫酸钠的饱和溶液降温至40℃,溶质的质量分数不变
(2010·遵义,9) t1 ℃ 时,分别将20g甲、乙两种晶体(不含结晶水)加入盛有100g水的两个烧杯中,恰好完全溶解,升温到t2时出现甲、乙烧杯中所示的现象。根据上述实验,结合下图中甲、乙两物质的溶解度曲线,判断下列说法正确的是
A t1℃时烧杯中甲、乙两物质形成的溶液是不饱和溶液
B t1℃时烧杯中甲、乙两物质形成的溶液溶质质量分数约为16 .7%
C. t2℃时烧杯中甲物质溶液的质量是110g
D. t2℃时乙物质的溶解度是130g
(2010·辽宁鞍山,15)小明同学绘制了如右图所示A、B两种固体物质的溶液度曲线:
(1)当温度为 ℃时,A物质与B物质的溶解度相等。
(2)若将B物质从溶液中结晶析出,宜采用的方法是 。
(3)我国有许多盐碱湖,湖中溶有大量的NaCl和Na2CO3,那
里的人们“冬天捞碱,夏天晒盐。”据此你认为图中 (填
“A”或“B”)物质的溶解度曲线与纯碱的相似。
15.(3分)(1)40 (2)加热蒸发 (3)A
(2010·辽宁鞍山,16)甲、乙两种固体物质的溶解度曲线如下图所示。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量浓硫酸。
(1)50℃时,甲物质的溶解度是 。
(2)30℃时,甲、乙两种物质的溶解度大小顺序是 。
(3)烧杯中加入浓硫酸后,甲、乙两试管中固体量的变化是 。除了加浓硫酸外,还可以加 物质,也会发生这样的变化。
16.(4分)(1)40g (2)甲>乙 (3)甲减少,乙增多 NaOH(或CaO)
(2010·甘肃兰州,34)右图是某实验小组的同学绘制的两种固体物质的溶解度曲线图。请你根据图示回答问题:
(1)t1℃时,a物质的溶解度 b 物质的溶解度
(填“>”、“<”或“=”)。
(2)将t2℃时a、b两种物质相同质量的饱和溶液,分别
冷却到t1℃,析出晶体最多的是 物质。
(3)溶解度曲线图中的任何一点都表示溶液的一种特定状
态。图中A、B两个状态中,溶液属于不饱和状态的
是 ,状态最不稳定的是 。
34.(每空1分,共4分)
(1)< (2)a (3)B A
(2010·甘肃兰州,20)实验室用密度为1.84g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制500g 质量分数为20%的稀硫酸。需要用多少mL的量筒量取多少mL的浓硫酸?
A.100mL 54.35mL B.100mL 55.5mL
C.250mL 54.35mL D.250mL 55.5mL
1、(10重庆綦江4)下列物质中不属于溶液的是……………………………………( )
A.碘酒 B.啤酒 C.蒸馏水 D.眼药水
二、填空题
1.(山东烟台3. )下列有关溶液性质的说法中错误的是
(A)溶液一定是无色、透明的混合物
(B)溶液加水稀释前后溶质的质量不变
(C)食盐水能导电是因为食盐水中含有较多自由移动的离子
(D)海水是盐溶液,所以冬天海水不易结冰
1.(10云南楚雄8)下列物质发生的变化与空气的成分无关的是( )
A.钢铁在空气中生锈
B.在晾干的咸菜表面出现食盐晶体
C.熟石灰在空气中变质
D.浓硫酸敞口放置在空气中质量增重
(10河北7)图3所示的四个图象,能正确反映对应变化关系的是
KNO3的质量/g
④
0
溶
质
质
量
分
数
0
时间/s
二氧化碳
质
量
0
时间/s
氧气质量
②
③
图3
0
时间/s
生成气体质量
t
1
2
H2
O2
①
g
g
g
A.①水的电解
B.②木炭在密闭的容器内燃烧
C.③加热一定量的高锰酸钾制氧气
D.④20 ℃时,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体
(10河南13).右图是某固体物质的溶解度曲线。
(1)30℃时,该物质的溶解度为 g。
(2)50℃时,将40g该物质加入到l00g水中,搅拌后得到的
是 (填“饱和"或“不饱和”)溶液;将该溶液降温到
20℃时可析出晶体 g
答案:13.(1)40 (2)不饱和 10
(10宜昌18).(3分)运用溶解度表与溶解度曲线回答下列问题:
⑴B是 的溶解度曲线。
⑵60℃时,100g水中加入100g硝酸钾,所得溶液是 (填“饱和”或“不饱和”)溶液,当60℃的该溶液降温到30℃时,析出晶体的质量为 g。
答案:18.(3分)⑴氯化钠或NaCl;⑵不饱和;54.2
(10河北30).小明要用100 g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”。图12是他配制氢氧化钠溶液的实验操作示意图。
NaOH
NaOH
图12
⑤
④
③
②
①
(1)量取所需要的水应选择 (选填“10 mL”、“50 mL”或“100 mL”)量筒。
(2)指出图中的一处操作错误: 。
(3)用上述图示的序号表示配制溶液的操作顺序: 。
(4)配制好的氢氧化钠溶液要密封保存,其原因是:
。
2.(10云南楚雄19)(4分)学习化学能使我们更好地认识生活中的有关现象,更合理地解决实际问题。
(1)铝和铜常用于制造电线,是用到了铝和铜的________________性。
(2)衣服上沾上了较多的油污时,可用汽油洗去的原因是________________________。
(3)防止铁锅生锈的方法是(写一条)______________________________________。
(4)25m3的石油气在加压的情况下可装入容积0.024m3的钢瓶中,原因是___________。
2.(1)导电(2)油污易溶于汽油(3)保持铁锅干燥、清洁(其他合理答案也可)(4)压强增大时,气体分子间的空隙变得很小(其他合理答案也可)
1.(10济宁17)室温下,称取氯化钠和碳酸钠各309放入同一烧杯中,加入lOOg水充分搅拌后静置,得到二者的混合溶液。请参照氯化钠、碳酸钠两物质的溶解度表判断,以下结论不正确的是
A.20℃时,氯化钠的溶解度大于碳酸钠的溶解度
B.20℃时,未溶解固体是氯化钠和碳酸钠的混合物
C.30℃时,溶液中氯化钠和碳酸钠的质量分数相同
D.30℃时,溶液为氯化钠和碳酸钠的不饱和溶液
2.(10云南楚雄20)(4分)如图是甲、乙两种物质的溶解度曲线,回答下列问题:
(1)从甲物质的溶解度曲线可以得到哪些信息(请写出其中的一条)___________________________。
(2)t1℃时,甲、乙两种物质的溶解度较大的是___________。
(3)t1℃时,将20g甲物质放入50g水中,充分搅拌能否全部溶解____________(填“能”、“不能”或“无法判断”)。
(4)将一定量t2℃时甲物质的饱和溶液降温到t1℃时,该过程中没有发生改变的是___________(填序号)
A.溶质质量 B.溶液质量 C.溶剂质量 D.溶质的质量分数
2.(1)甲的溶解度随着温度的升高而变大(其他合理答案也可)(2)乙(3)不能(4)C
1.(10长沙6)将70℃的硝酸钠饱和溶液降温到10℃,有晶体析出(晶体中不含水),下列各量没有发生变化的是( )
A.硝酸钠的溶解度 B.溶液中溶质的质量C.溶液中溶剂的质量 D.溶液中溶质的质量分数
2.(10山西23)在初中化学中,我们学习了溶液的有关知识。右图是KNO3的溶解度曲线。
(1)从右图溶解度曲线可以得到的信息是(写一条)___________________________。
(2)小明参照右图在常温20℃时进行了如下实验:
小明观察到A中所加固体全部溶解,则B中的现象是___________________。
上述实验过程中属于不饱和溶液的是(填字母)________________。
D中溶液的溶质质量分数是_________________。
2.(1)20℃时,KNO3的溶解度是31.6g(2)固体部分溶解 A、C、D 37.5%
1.(山东烟台25.)(8分)海洋是地球上最大的储水库,浩瀚的海洋蕴含着丰富的化学资源。我市具有较长的海岸线,海洋资源开发前景广阔。
(1)目前海水淡化普遍采用的方法是 ,证明得到的水是淡水的方法是 。
(2)海底不仅蕴藏着大量的煤、石油、天然气等常规化石燃料,人们还在海底发现了一种新型矿产资源是 ,被科学家誉为"21世纪能源”。
(3)海水晒盐能够得到粗盐和卤水。
①卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线。t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是 。将t1℃的MgCl2、KCl和MgSO4三种物质的饱和溶液加热到t2℃
以上时,会析出 晶体(填名称)。
②将粗盐提纯可以得到纯净的NaCl。欲用纯净的NaCl配制100g0.9%的生理盐水,需要NaCl的质量为 克。配制该溶液时需要的玻璃仪器有
。如果配制的溶液的溶质质量分数低于0.9%,你认为可能的原因是 (任写一个)。(1)多级闪急蒸馏法(或蒸馏法) 加热蒸发后无残留物(或液体不导电、加入硝酸银溶液无沉淀产生等其它合理答案也可)。 (2)可燃冰(或天然气水合物)
(3)①MgCl2 硫酸镁 ②0.9 烧杯、量筒、玻璃棒、胶头滴管(答出前三种即可)
称量氯化钠时操作错误,如左盘放了纸片右盘未放纸片等;用量筒量取水时错误,如取水时仰视读数等;氯化钠中混有杂质等(其它合理答案也可)
1、(10四川达州13)海水是一种重要的自然资源(海水中含NaCl、MgCl2等物质),被誉为“国防金属”的镁主要是从海水中提取的,下面是从海水中提取金属镁的简单流程。
海水
溶液
Mg(OH)2
MgCl2溶液
无水MgCl2
Mg
试剂A
试剂B
通电
⑴从海水中获得淡水,常用的方法是蒸馏。
⑵从海水中获得粗盐,可将海水进行蒸发结晶。
⑶试剂A最好选用熟石灰或氢氧化钙或Ca(OH)2。
1、(10四川达州5) 甲、乙两物质的溶解度曲线如图所示,下列说法正确的是
50-
40-
30-
20-
10-
甲
乙
温度/℃
t1
t2
0
溶解度/g
A.甲和乙的饱和溶液,从t1℃升温到t2℃,仍是饱和溶液
B.t1℃时,甲和乙的溶解度相等
C.t1℃时,甲和乙各30g分别加入80g水中,均能恰好完全溶解
D.t2℃时,在100g水中放入60g甲,形成不饱和溶液
2、(10苏州24)下列有关溶液的说法正确的是
A.盐水的沸点比水低 B.无色澄清液体一定是溶液
C.只有固体能作溶质 D.溶液的各部分性质均相同
3、(10苏州30)根据下列几种物质溶解度曲线图,得到的结论正确的是
A.硝酸钾中混有少量氯化钠,采用蒸发结晶进行提纯
B.氢氧化钙饱和溶液降低温度后有晶体析出
C.80℃时,氯化钾与硫酸镁的溶解度相等
D.所有物质的溶解度均随温度的升高丽增大或随温度的降低而减小
1、(10广东省18)溶
解
度
/g
50
20
0
P
a
b
c
t1
t2
温度/℃
右图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据下图回答:
(1)t2℃时30g a物质加入到50g水中不断搅拌,形成的溶液中
溶质的质量分数是__33.3% _______.
(2)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列
是___ c < b < a ___(填写物质序号).
(3)在t2℃时,将等质量的a、b、c三种物质的饱和溶液同时
降温至t1℃时,析出晶体最多的是___ a ______.
2、(10重庆綦江20)甲、乙两种固体物质的溶解度曲线如右图所示。
(1)李青同学要配制甲、乙两种物质的饱和溶液,而且溶质的质量分数相同,他应该将温度控制在 20 ℃。
(2)40℃时50g乙物质加到100g水中,充分搅拌后,还有 10 g固体未溶解,如果要使其溶解,你的方法是 升高温度(或加入溶剂) 。
计算题
1、(10苏州34)根据图示情景和范例,编写计算题,并完成相关内容。
【情景1】要配制一定质量分数、一定质量的氯化钾溶液,应该怎么操作?
(1)编题范例 配制10%的氯化钾溶液50g,分别需氯化钾固体和水各多少?
(2)配制该溶液的操作步骤
①计算: m(KCl)=50g×10%=5g m(H2O)=50g-5g=45g V(H2O)=45ml
②称量:用托盘天平称取所需固体,再用 50 mL的量筒量取所需的水;
③溶解:将称得的氯化钾固体放入烧杯中,再倒入量取的水,用玻璃棒充分搅拌;
④装瓶:将配制的溶液倒入试剂瓶,并贴上标签。
【情景2】已知一定质量分数、一定质量的氢氧化钾溶液与一定质量的盐酸反应,得到只有一种溶质的溶液,求算反应后溶液的溶质质量分数。
(1)编写题目 56g10%的氢氧化钾溶液与18.5g某浓度的盐酸恰好完全反应,计算反应后所得溶液中溶质的质量分数。
(2)计算过程 反应后所得溶液中溶质的质量分数是10%。
1.(10梧州31).配制溶液时最常用的溶剂是
A.水 B.汽油 C.酒精 D.花生油
2.(10梧州35).将下列物质加入水中会放出热量的是
A.NaCl B.KNO3 C.浓H2SO4 D.NH4NO3
3.(10咸宁6).下列物质不属于溶液的是
A.生理盐水 B.“雪碧”汽水 C.碘酒 D.冰、水混合物
4.(10咸宁9).如图所示,打开止水夹,将液体A滴入试管②中与固体B接触。若试管①中的导管口有较多气泡产生,则液体A和固体B的组合不可能是
A.双氧水和二氧化锰
B.水和生石灰
C.水和氢氧化钠
D.水和硝酸铵
1.(10广安14).右图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.乙的不饱和溶液降温可变成饱和溶液
C.20oC时,甲、乙两种物质的溶解度相等
D.50oC时,甲的饱和溶液中溶质的质量分数为40%
2.(10张家界21)、甲、乙物质在不同温度下的溶解度如右图所示。请根据溶解度曲线回答下列问题:
(1)40℃乙物质的溶解度是 。(40克)
(2)现有一瓶接近饱和的甲物质水溶液,列举出两种能使它变成饱和溶液的方法 、 。降温 加入固体甲
(3)20℃时,向装有100g水的烧杯中加入45g乙物质,充分搅拌后静置,所得的溶液是该温度下乙物质的 溶液(填“饱和”或“不饱和”),这种溶液中乙物质的质量分数是 (精确到0.1%)饱和 23.1%
3.(10本溪19).(8分)下表列出了固体物质A在不同温度时的溶解度:
温度/℃
0
10
20
30
40
50
60
70
80
90
溶解废/g
36
35
34
33
32
31
30
29
28
27
(1)70℃时,向盛有100g水的烧杯中加入30g固体A,充分溶解形成的是
(填“饱和”或“不饱和”)溶液,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂
的质量比为 (填最简整数比);
(2)通过对上表数据的分析,物质A的溶解度曲线
应是右图中的 (填“甲”或“乙”);
(3)80℃时,配制一定量甲物质的溶液,将其降温
到60℃,是否有固体析出? (填“有”、
“没有”或“不确定”)。
19.(1)饱和(2分) 3︰10(2分)
(2)乙(2分)
(3)不确定(2分)
1.(10梧州44).图17是小明配制100g质量分数为18.5%的蔗糖溶液的实验操作示意图:
蔗糖
蔗糖
图17
① ② ③ ④ ⑤
(1)配制上述溶液,小明要称取蔗糖 g。
(2)上图①、②、④中相同的仪器名称是 。
(3)用上图所示的序号表示正确配制该溶液的操作顺序为 → → → → 。
(4)若上图③中砝码的质量为15 g,游码的读数为3.5 g,则小明称得的蔗糖质量实际为 g。
44.(1)18.5 (2)烧杯 (3) ⑤ ③ ① ④ ② (4)11.5
2.(10咸宁34).(5分)现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是34.4g,将杯内剩余物质过滤、洗涤、干燥后得滤渣2g。计算:
(1)生成氧气的质量。
(2)瓶内过氧化氢溶液中溶质的质量分数。
34.解:(1)根据质量守恒定律,生成氧气质量为34g-(34.4g-2g)=1.6g(1分)
MnO2
(2)设反应前溶液中含溶质过氧化氢质量为
2H2O2 O2↑+2H2O (1分)
68 32
1.6g
(1分)
解得g (1分)
反应前过氧化氢溶液中溶质质量分数==10% (1分)
答:略。
3.(10本溪26).(5分)生产烧碱的工厂,常用便宜的原料纯碱和熟石灰制得成品。为模拟该生产过程,同学们取20gNa2CO3溶液与一定质量的饱和石灰水混合,恰好完全反应,得到4g白色沉淀。求Na2CO3溶液中溶质的质量分数。
(10,娄底16)物质在溶解时,常常会使溶液的温度发生改变。下列物质溶于水时,温度
无明显变化的是
A.浓硫酸 B.氢氧化钠固体 C.硝酸铵固体 D.食盐
(10,绵阳6)在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是(C )
A.将20g硝酸钾饱和溶液蒸发掉10g水
B.将20g硝酸钾不饱和溶液蒸发掉10g水
C. .在10g10﹪的硝酸钾溶液中,加入5g40﹪的硝酸钾溶液
D. 将10g硝酸钾不饱和溶液中加入10g硝酸钾固体
(10,浙江衢州14.)在一定温度下,向盛有100克蔗糖溶液的烧杯中再加入5克蔗糖,充分搅拌后,一定保持不变的是
A.溶质的质量 B.溶液的质量 C.溶质的质量分数 D.蔗糖的溶解度
(10,娄底21)甲
乙
0 t1 t2 温度/℃
溶解度/g
80
右图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
(1)t1℃时,甲物质的溶解度 26 乙物质的溶解
度(填“>”、“=”或“<”)。
(2)甲、乙两种物质的溶解度受温度影响较小的是 27
物质。
(3)t2℃时,把100g乙物质放入100g水中,充分搅拌,
所得溶液是 28 溶液(填“饱和”或“不饱和”)。
(4)t2℃时,有一接近饱和的甲溶液,可采用 29 的方法(任写一种)使它变为饱和溶液。
21题: 26. = 27. 乙 28. 饱和 29. 降温(合理答案均可)
(10,浙江衢州14.)在一定温度下,向盛有100克蔗糖溶液的烧杯中再加入5克蔗糖,充分搅拌后,一定保持不变的是
A.溶质的质量 B.溶液的质量 C.溶质的质量分数 D.蔗糖的溶解度
(10,娄底24)24.配制溶质质量分数一定的氯化钠溶液常按以下操作顺序进行。
请回答下列问题:
(1)计算配制100g溶质质量分数为5%的氯化钠溶液所需:
氯化钠 40 g,水 41 g。
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 42 。
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 43 。
24题: 40. 5 41. 95 42. B 43. 加速溶解
(10,绵阳29)质量分数不同的硫酸溶液其密度不相同,对照表如下:
质量分数
10%
20%
30%
40%
50%
60%
70%
80%
90%
98%
密度(g/mL)
1.07
1.14
1.22
1.30
1.40
1.50
1.61
1.73
1.81
1.84
将10mL98%浓硫酸中加水稀释至100ml,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
(1)10mL98%的浓硫酸中含18 gH2SO4。
(2)列式计算消耗金属锌的质量。
解:设10mL稀硫酸与锌完全反应消耗锌的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 98
65×18.0g×
X 18.0g×
X=
98
=1.2g
答:略
(3)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是 质量分数越大密度越大 。10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在 % 至 b% 之间。
(10,威海7)下列关于溶液的说法中,不正确的是
A.溶液中各部分性质相同,是一种高级混合物
B.氢氧化钠溶液能导电,是因为溶液中含有自由移动的离子
C.接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态
D.20℃,氯化钠的溶解度为36g,则20℃时100g氯化钠饱和溶液中含有氯化钠36g
(10龙岩市13).野炊过程实际上是运用化学知识分析、解决问题的过程,因为该项活动过程中涉及许多化学知识的运用。某次野炊活动中,同学们携带了铁锅、牛肉、面条、西红柿、食用油、食盐、味精、食醋、去污粉(有效成份为碳酸钠)等物品。
(1)携带过程中,不慎将装食盐、去污粉的瓶子混淆了。若要将它们区分开来,适宜选用___________(填所携带的物品名称)。
(2)在“灶”上悬挂野炊锅时,小明生火后小心调节野炊锅到合适的高度。这样做的原因可能是 。
A. 使用焰心加热 B. 使用内焰加热 C. 使用外焰加热
(3)烹煮牛肉西红柿汤时,为了解汤的盐味是否适宜,小春同学取锅中少量汤品尝。取少量汤进行品尝就可知道整锅汤盐味如何,是因为溶液具有______________(填一条性质)。
(4)野炊结束时,小辉用干布抹去铁锅表面的水珠。这样做的目的是_____________。
答案:
(10龙岩市10).右图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是
A.甲的溶解度随温度变化比乙小
B.t2℃时甲的饱和溶液的溶质质量分数小于30%
C.t1℃时,甲、乙饱和溶液的溶质质量分数不相等
D.可采用降低温度的方法使乙的饱和溶液变为不饱和溶液
【10湖北十堰】4.下列关于生理盐水的说法中,错误的是:
A.生理盐水的溶剂是水 B.各种分一样咸体现了溶液成分的均一性
C.引用生理盐水可以为人体补充无机盐 D.水分子是保持NaC1性质的最小微粒
【10桂林28.】(5分)A、B、C三种固体物质的溶解度曲线如右图所示。
(1)t1℃时,A、B、C的溶解度大小关系是(用“>”、“<”或
“=”表示) ,它们的饱和溶液中,溶质质量分
数最大的物质是 。
(2)t2℃时,将A、B、C各25 g分别放入100g水中,能形成饱
和溶液的物质是 ,将其转化为不饱和溶液的两种
方法有 、 。
28.(5分)(1)B>A=C (或A=C<B) B
(2)C 降低温度 增加溶剂 (后两空不规定顺序)
14.(10泸州13).25℃时,将a g碳酸钠(化学式为Na2CO3)溶解于100g水中恰好形成饱和溶液。所得溶液的溶质质量分数为 ×100% ,此温度下碳酸钠的溶解度为 a g 。
15.(10泸州21).医院使用的生理盐水是溶质质量分数为0.8%的NaCl溶液。若将80g溶质质量分数为10%的NaCl溶液配成生理盐水,需要加入蒸馏水 920 g,溶液的pH值 = 7 。
【10福建宁德】14.(16分)图1是甲、乙、两三种固体物质的溶解的溶解度曲线。根据图1、图2回答:
(1)50℃时,甲、乙、丙三种固体物质的溶解度由大到小的顺序是 。
(2)图2中,试管里预先装有少量生石灰,当往试管中加入适量水时,反应放出的热量使烧杯中某饱和溶液析出固体(不考虑水分蒸发)。请判断:该饱和溶液中溶质是
(填甲或乙或丙)。
(3)从图1中,你还能得到哪些信息? (任写一条)
14.(1)甲>乙>丙(或甲乙丙) (2)丙 (3)40℃时甲乙溶解度相等。
【10湖北十堰】16.有关A、B两物质溶解度曲线如图(图见试卷第7页),据图回答:
(1)t1℃时,A、B两物质的饱和溶液溶质质量分数的关系为a b.
(填“>”或“<”或“=”)
(2)t2℃时,A、B形成的两中溶液均不饱和,通过方法“①”或“②”填空:
A溶液采用 方法;B溶液采用 方法。
方法①:由t2降温至t1
方法②:由t2升温至t3
16.(1)< (2)① ②
【10新疆】3.请回答下列有关溶液的问题。
(1)把面粉与酒精分别加入蒸馏水中,能形成溶液的是 。
(2)右图是a、b两种固体物质的溶解度曲线。
①当温度高于20℃,溶解度:a b。(填“>”“<”或“=”)
②20℃,将等质量的两种物质的饱和溶液降温至0℃时,析出晶体的质量是a b。(填“>”“<”或“=”)
3.(1)酒精(2)① > ② <
【10桂林24.】t℃时,向10 g水中逐渐加入硝酸钾晶体至饱和,则此过程中该溶液满足下图a、b两个变量的变化关系的是
A.a -溶解度,b-溶质质量
B.a -溶质的质量分数,b-溶质质量
C.a -溶质质量,b-溶剂质量
D.a -溶解度,b-溶剂质量
【10桂林11】用固体氯化钠配制100 g 10%的氯化钠溶液,不需要使用的仪器是
A.玻璃棒 B.石棉网 C.烧杯 D.量筒
【10桂林21】下列说法正确的是
A.钠离子的电子数多于钠原子的电子数
B.氢氧化钠能去除油污,可直接用做厨房的清洁剂
C.把100g12%的硫酸配制成6%的硫酸,需加水100g
D.100g16%硫酸铜溶液与100g8%的氢氧化钠溶液反应,所得溶液质量为200g
(10天津市7).厨房中的下列物质与水充分混合后,不能形成溶液的是
A.花生油 B.白糖 C.纯碱 D.食盐
(10天津市23).请根据下列实验和溶解度曲线回答问题:
(已知水的密度约为1g/cm3)
实验操作
实验结果
取100ml水,加入25g硝酸钾,搅拌,恢复至20℃
全部溶解,得溶液①
再加wg硝酸钾,搅拌,恢复到20℃
恰好饱和,得溶液②
再加25g硝酸钾,搅拌,恢复到20℃
得溶液③
加热
全部溶解,得溶液④
冷却至20℃
析出晶体,得溶液⑤
(1)③中溶液的质量为______g;一定属于不饱和溶液的是_________(填序号,下同);溶质的质量分数一定相等的是_________。
(2)析出晶体的质量为__________。
A.25g B.(w+25)g C. (w+50)g
答案:(1)131.6g ① ②③⑤ (2)A
(10天津市27).某食品加工厂生产的酱油中氯化钠的质量分数为16%,该厂日产酱油15t。试计算该厂每月(按30天计)消耗氯化钠的质量。
答案:解:15t×16%=2.4t 2.4t×30=72t 答(略)
(2010.浙江杭州)26.(3分)右图为a、b两物质的溶解度曲线,据图回答:
(1)a、b两种饱和溶液的浓度相同时的温度是 ℃
(2)要从b物质的溶液中析出晶体,通常采用的方法是 。
(3)若要得到溶质质量分数为20%以上的a溶液,配制时的温度应不低于 ℃
答案:26.(1)65 (2)蒸发溶剂 (3)80
(2010.浙江绍兴)18.如图是A、B两种物质的溶解度曲线。在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2℃。下列说法正确的是( )
A.t1℃时,AB两物质的溶解度相等。两杯溶液均是不饱和溶液
B.t1℃时,AB两物质的溶解度相等,A溶液为饱和溶液,B溶液为不饱和溶液
C.t2℃时,A的溶解度比B的溶解度大,两杯溶液均是不饱和溶液
D.t2℃时,A的溶解度比B的溶解度大,A溶液为不饱和溶液,B溶液为饱和溶液
答案:D
(2010.浙江丽水)14.在一定温度下,向盛有100克蔗糖溶液的烧杯中再加入5克蔗糖,充分搅拌后,一定保持不变的是
A.溶质的质量 B.溶液的质量 C.溶质的质量分数 D.蔗糖的溶解度
答案:D
1.(10无锡7)将下列物质混合并充分搅拌后,能得到无色溶液的是
A.酒精与水 B.氧化铁与稀盐酸 C.植物油与水 D.奶粉与水
2.(10无锡13)生活离不开化学,下列认识错误的是
A.氦气可用于填充安全气球
B.用硬水洗涤衣物,既浪费肥皂也洗不净衣物
C.用洗涤剂除油污是因为洗涤剂能将油污溶解,形成溶液
D.在管道煤气中添加微量难闻气味的气体是为了及时发现煤气泄漏
3.(10无锡16)下列过程中,吸收热量的是
A.氢氧化钠固体溶于水 B.硝酸铵固体溶于水
C.生石灰和水反应 D.金属镁和稀盐酸反应
4.将下列物质分别放入足量水中,并充分搅拌,不能形成溶液的是
A.食盐 B.花生油 C.白糖 D.纯碱
1.(10徐州15)根据右图的溶解度曲线判断,下列说法错误的是
A 50℃时A物质的溶解度最大
B 升温可使C物质的不饱和溶液变饱和
C 50℃时把90gA物质放入100g水中能得到190g溶液
D 将50℃三种物质的饱和溶液分别降温到20℃时,B溶液最浓
甲
乙
丙
40
0
t1
t2
t3
溶解度/g
温度/℃
2.(10贵港12)右下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是 ( )
A.t2℃时,甲、乙两种物质的溶解度相等
B.甲的溶解度随温度的升高而增大
C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得
的三种溶液中溶质的质量分数大小关系是乙>甲>丙
D.t1℃时,丙的饱和溶液中溶质的质量分数为40%
3.(10成都11) 右图是a、b两种固体物质的溶解度曲线。从图中可获得的信息是( )
A. 固体物质的溶解度均随温度升高而增大
B.t℃,相同质量的a、b溶解时放出热量相同
C.升高温度,可使a或b的饱和溶液变为不饱和溶
液
D.将相同质量的a、b分别加入100g水中,所得溶液质量分数相同
4.(10连云港18)如图是甲、乙两种不含结晶水的固体物质的溶解度曲线,下列说法正确的是
A.甲、乙两物质的溶解度都随温度升高而增大
B. t1℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等
C. t2℃时,甲的溶解度比乙的溶解度小
D. t3℃时,甲、乙两物质各20g可分别完全溶解在100g水中
1.(10无锡30)右图AB两种固体物质的溶解度随温度变化的曲线。请回答
(1) ℃时,A、B两物质的溶解度相等
(2)20℃时,A物质的溶懈度 B物质的溶解度(填
“>”、“<”或“=”)。
(3)40℃时,将A、B各15 g分别加到均盛有50 g水的两只小
烧杯中,充分搅拌后, 物质有剩余(填“A”或“B”)。
(4)现有50℃时A物质的不饱和溶液在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是 (
填序号)。①降低温度 ②升高温度 ③加人A物质
答案:(1)30℃(2)<(3)B(4).
1.(10无锡29)右图是某医用“葡萄糖氯化钠注射液”的部分文字说明。
(1)该注射液中含有的阳离子的符号为 。
(2)葡萄糖的化学式为C6H12O6,则葡萄糖的相对
分子质量为 ,其中碳元素的质量分数
为
(3)在人体组织中,葡萄糖在酶的作用下经缓慢氧化转化成二氧化碳和水,同时放出能量
请写出该反应的化学方程式
(4)若该注射液的密度为1.o g/cm3,配制500 mL该注射渡需氯化钠 g。某同学欲在实验室中配制一定质量的该溶液,需用到的玻璃仪器有:烧杯、量筒、胶头滴管和 。
酶
答案:(1)Na+ (2)180 40% (3) 6O2+C6H12O6==6CO2 +6H20
1、(10乐山26)在25℃时,向不饱和氯化钾溶液加入少量氯化钾固体至溶液刚好饱和,在这一过程中,下列各量:① 溶液中水的质量,② 溶液中溶质的质量,③ 溶液中氯化钾的质量分数,④ 25℃时氯化钾的溶解度,⑤ 氯化钾溶液的质量。其中不变的是
A.①和④; B.②和③ C.③和④ D.④和⑤
2、(10汕头14)右图是NaCl、MgSO4的溶解度曲线。下列说法正确的是
A.只有在t1℃时,NaCl和MgSO4的溶解度才相等
B.t1℃~t3℃,MgSO4的溶解度随温度升高而增大
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出
1、(10汕头11)下列有关溶液的说法正确的是
A.将植物油与水混合,得到的是溶液
B.配制溶液时,搅拌溶液可以增大溶质的溶解度
C.将10%的KNO3,溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.将25 g KCl溶液蒸干得到5g KCl固体,则原溶液中溶质的质量分数为20%
1、(10江西14)小琪往右图所示的烧杯中加入一种物质,轻轻搅拌后,粘在烧杯上的塑料片脱落。加入的物质可能是
A.食盐 B.硝酸铵
C.氧化钙 D.
C 浓硫酸或固体氢氧化钠
1、(10茂名10)右图为A、B两种不带结晶水的固体物质溶解度曲线,下列说法不正确的是
A.30℃时,A物质的溶解度为20g
B.20℃时,A和B的溶解度相同
C.10℃时,等质量的A和B饱和溶液中,B的溶剂最少
D.等质量的A、B的饱和溶液从30℃降到20℃时,B析出的晶体最多
2、(10佛山15)甲、乙两种固体的溶解度曲线如右下图。将①②两试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里。升高温度后,下列有关说法正确的是( )
A. ①②两溶液的质量一定相等
B. ①②两溶液均变为不饱和溶液
C. ①溶液质量增加,②溶液质量减少
D. ①溶液中溶质的质量分数一定大于②溶液
3、(10江西20)(4分)甲、乙两种物质的溶解度曲线如右图。
(1)20℃时,甲物质的溶解度为 g;
(2) 40℃时,把40g甲物质放入100g水中,所得的溶液是
(选填“饱和”或“不饱和”);
(3)欲将40时℃乙物质的饱和溶液变为不饱和溶液,可采用的方法
是 ;
(4) 40℃时,将甲、乙两物质的饱和溶液各100g,分别降温到20℃,所得
甲物质溶液的质量 (选填“>”或“=”或“<”)乙物质溶液的质量。
(1) 40 (2) 不饱和 (3) 加水或降温(4)<
有关问题:
(1)计算:碳酸钠的质量为 g,水为 g。
(2)称量:用托盘天平称量, 碳酸钠应放在 (填“左盘”或“右盘”)。
(3)溶解:用量筒来量取所需的水(水的密度为1g/cm3),,量筒的规格是 (从下列中选用:10mL、25 mL、50 mL、100 mL);溶解碳酸钠要用到玻璃棒,其作用是
。
(4)反思:若称取的碳酸钠中喊有水分,则所配制的溶液的质量分数会 (填“偏大”、“偏小”或“无影响”)
(1)10.6 89.4 (2)左盘 (3)100mL 加快溶解 (4)偏小
2、(10江西29)(3分)欲配制10%的氯化钠溶液70g。
(1)甲同学用氯化钠固体配制。需称取氯化钠 g;
(2)乙同学用25%的氯化钠溶液配制。需25%的氯化钠溶液 g;配制时应选用 mL(选填“20”“50”“100”)的量筒量取蒸馏水。
(1)7 (2)28 50
(2010四川自贡50)(4分)某实验小组利用图1所示仪器进行“配置一定溶质质量分数的氯化钠溶液”的实验。
(1)图1中仪器a的名称是 ,按实验要求,图1中还缺少的玻璃仪器是(填名称) 。
(2)小王按图2的操作称取氯化钠,小张发现小王的操作有错误。你认为小王操作中错误是
;他称取的氯化钠实际质量为 g。
(10四川甘孜19) (7分)水是生命之源,通过化学学习,我们进一步认识到水的重要作用。
(1)自然界的水常常遭到人为污染,污染物中氮和磷含量过高会造成水中藻类过度繁殖,使水质恶化,这里的“氮和磷”是指 ;(填字母)
A.元素 B.原子 C.离子 D.分子
(2)自然界的水经过一系列净化处理后,成为比较清洁的自来水。自来水不是纯水,若要制取纯水,应采取的净化方法是 。碗碟上的油污用自来水很难洗净,往水中加少量的洗涤剂后,就容易洗洗净,说明洗涤剂具有 作用。
(3)20 ℃时,向两只试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到如图1所示的现象。20 ℃时, (填“甲”或“乙”)的溶液一定是饱和溶液。右图2中表示甲物质的溶解度曲线的是 (填“a”或“b”)要使试管中剩余的甲固体继续溶解可采用的方法是 。将10 ℃时a的饱和溶液升温到20 ℃(溶剂不蒸发),其溶质质量分数 (填“变大”、“变小”或“不变”)。
19. (7分)(1)A(2) 蒸馏 乳化(3)甲 b 增加溶剂水 不变
(10江苏泰州19)右图是甲、乙、丙三种物质的溶解度曲线.下列说法正确的是
A.在t1℃时,三种物质的溶解度由大到水的顺序是甲>乙>丙
B.在t2℃时,甲、乙两物质的溶解度相等
C.甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液
D.当乙的饱和溶液中混有少量丙时,可采用降温结晶的方法析出丙
(10海南28)右图是甲、乙两种固体物质的溶解度曲线。据此判断
下列说法不正确的是:
A.t2℃时,甲、乙的溶解度相等
B. t3℃时,将60g乙加入100g水中可得l60g溶液
C.乙的溶解度受温度影响很小
D.tl℃时,乙的溶解度大于甲的溶解度
(10湖北省襄樊市17)右图是甲、乙两种固体物质的溶解度曲线,请回答:
(1)在______℃时,甲、乙两物质的溶解度相等。
(2)在40℃
,等质量的甲、乙两种物质的饱和溶液,当温度降低到20℃时,析出晶休较多的是_______________(填甲或乙)
(1)40;(2)甲
(10海南36)配制一定溶质质量分数的氯化钠溶液,下列操作中有错误的是: A.取出NaCI B.称量NaCI C.量取水 D.溶解NaCI
(10湖北省襄樊市23)249.5g稀盐酸加入盛有50g碳酸钙的烧杯中,恰好完全反应。试计算:反应后所得溶液中溶质的质量分数。
解:设生成氯化钙的质量为X,二氧化碳的质量为Y
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 111 44
50g X Y
100:111=50g:X
X=55.5g
100:44=50g:Y
Y=22g
反应后所得溶液的质量分数=55.5g/(249.5g+50g-22g)=20% 答:(略)
盐酸(分析纯)
化学式Ha
质量分数36%
密度l.189/cm3
(10海南39)右图是浓盐酸试剂瓶上标签的部分内容。请回答:
(I)该浓盐酸的溶质是 (填化学式);
(2)现要配制3%的稀盐酸120g,需要这种浓盐酸 g;
(3)使用一段时间后,浓盐酸的溶质的质量分数小于36%,
原因是 ;
(4)盐酸等许多酸都能使紫色石蕊试液变红,是因为酸溶液中含有较多的 (用化学符号表示)。
(1)HCl
(2)10g
(3)浓盐酸有挥发性,HCl挥发后,质的质量分数必然变小
(4)H+
(2010四川宜宾11)(8分)按要求完成下列填空。
(1)地壳中含量最多元素的元素符号为 ;空气中体积含量最多的物质的化学式为 ;Mg2+中的“2”表示的意义为
。
(2)草木灰的主要成分是K2CO3,K2CO3属于 (填“酸”、“碱”、“盐”、“氧化物”),它的溶液的pH 7(填“<”,“>”或“=”)。
(3)右图是a、b两种物质的溶解度曲线。
①在t1℃到t2℃之间时,a、b能否配制成溶质质量分数相同的饱和溶液? (填“能”或“不能”)。理由是
。
②把t1℃时a的饱和溶液升温到t2℃,则溶液的溶质质量分数将 (填“变大”、“变小”或“不变”)。
(2010上海48)甲物质在水中的溶解度曲线如右图,a、b、c、d为图象中的四个点。
①t1℃时,甲物质的溶解度是 g/100g水。
②t2℃时,25g水中最多能溶解甲物质 g。
③要使甲物质的饱和溶液成为不饱和溶液,可采用的一种方法是 。
④甲物质的溶液分别处于a、b、c、d四点时,溶液中甲的质量分数大小关系正确的是 (选填下列编号)。
(10宁夏8).下列说法中正确的是……………………………………………………( )
A.溶液中可以含有多种溶质
B.析出晶体后的溶液是不饱和溶液
C.用汽油洗去衣服上的油渍是乳化作用的结果
D.增大空气与水的接触面积,可以增大氧气的溶解度
48.(9)30 (10)15 (11)加水(或升高温度) (12)Ⅲ
(2010四川自贡47)根据右图固体甲、乙的溶解度曲线,回答问题:
(1)要使60g甲完全溶解在100g水中,水温不能低于 ℃;
(2)要从乙的饱和溶液中获得大量的乙,可采用的方法是 ;
(2010上海51)在电解水的试验中,为了加快电解的速度,可先向水里加入少量
H2SO4,混匀后注入水电解装置。
①H2SO4的摩尔质量是 。
②若水电解装置中盛有4.82%的H2SO4溶液100g,通电一段时间后切断电源,水的质量减少了3.6g。(已知通电时H2SO4不发生变化,其他损失忽略不计。)
Ⅰ.计算生成的O2的物质的量(根据化学方程式列式计算)。
Ⅱ.此时溶液中溶质H2SO4的质量分数为 。
51.(4)98g/mol Ⅰ0.1mol Ⅱ5.00%
(2010四川自贡54)(7分)某化学兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行了如下实验。
Ⅰ.按照如图所示的装置,在锥形瓶中加入1.5g二氧化锰,从长颈漏斗注入34.0g过
氧化氢溶液。收集反应产生的气体。
Ⅱ.当锥形瓶内物质完全反应后,称量、计算得出锥形瓶内剩余物的质量为33.9g。
请根据以上信息计算出该过氧化氢溶液中溶质的质量分数,写出必要的计算过程。
(10大连35).下列物质中,不属于溶液的是 ( )
A.泥水 B.硬水 C.矿泉水 D.生理盐水
(10大连50).如图是A、B、C三种固体物质的溶解度曲线。
⑴随着温度的升高,溶解度减小的是( );
⑵t1℃时,B、C的( )相等;
⑶从B的饱和溶液中提取B晶体应采用的方法是( )
⑷t2℃时,要使接近饱和的A溶液变为饱和溶液,可采用的一种方法是( )
答案:⑴(C);⑵(溶解度)⑶(蒸发溶剂法)⑷(降温)
(2010·湖北省黄冈市,11)Fe
Zn
0 反应时间/s
氢气质量/g
0 加入水的质量/g
溶液pH
7
0 盐酸的质量/g
气体质量/g
0 蒸发水的质量/g
溶质质量分数
%
下列图①~④分别与相应的操作过程相对应,其中正确的是
① ② ③ ④
A.①在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分
B.②向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸
C.③向氢氧化钠溶液中不断加水稀释
D. ④相同质量的且过量的锌粉和铁粉,分别与质量和质量分数相同的稀盐酸反应
(10常州)3.下列物质加入水中,不能形成溶液的是
A.蔗糖 B.硝酸钾 C.植物油 D.高锰酸钾
(10盐城12.)12.右图甲、乙两种固体物质的溶解度曲线,下列叙述不正确的是
A.甲、乙两种物质均属于易溶物质
B.甲物质的溶液度受温度变化影响较大
C.在20时,甲、两种物质的饱和溶液中溶质的质量相等
D.当甲中含有少量的乙时,可用降温结晶法提纯甲
(10常州)24.(4分)甲、乙两种固体的溶解度曲线如右图所示。
(1) ▲ ℃时,甲和乙的溶解度相等;
(2)40℃时,若将40g乙(不含结晶水)放入160g水中充分溶解,所得溶液的溶质质量分数为 ▲ ,该溶液是 ▲ 溶液(填“饱和”或“不饱和”);
(3)40℃时,将甲、乙两物质的饱和溶液各100g降温至20℃,析出晶体(均不含结晶水)的质量关系是:
m(甲) ▲ m(乙) (填“﹥”、“﹦”或“﹤”)。
24.(4分)(1)20 (2)20% 不饱和 (3)>(各1分)
(10常州)19.稀释质量分数为98%(密度为1.84g/ mL)的浓硫酸配制500 mL质量分数为20%的稀硫酸(密度为1.14g/ mL),稀释时需用的水的体积约为
A.436.8 mL B.453.7mL C.456.0 mL D.458.3mL
(10湖北省黄石市19)已知A、B两种固体的溶解度曲线如图所示,试回答下列问题:
(1)在t1℃时,溶解度A B(填<、=、>)。
(2)将A的某溶液温度从t2℃降至t1℃,溶液 (填一定会、
可能会、一定不会)有晶体析出。
(3)欲使t1℃时B的饱和溶液变为不饱和溶液,可采取的措施是
。
(1)< (2)可能会 (3)降低温度或加入溶剂
(10湖北省恩施市9)要配制100g 溶质质量分数为10%的氯化钠溶液,下列操作中正确的是
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90ml水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签