- 975.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化工生产流程(1)
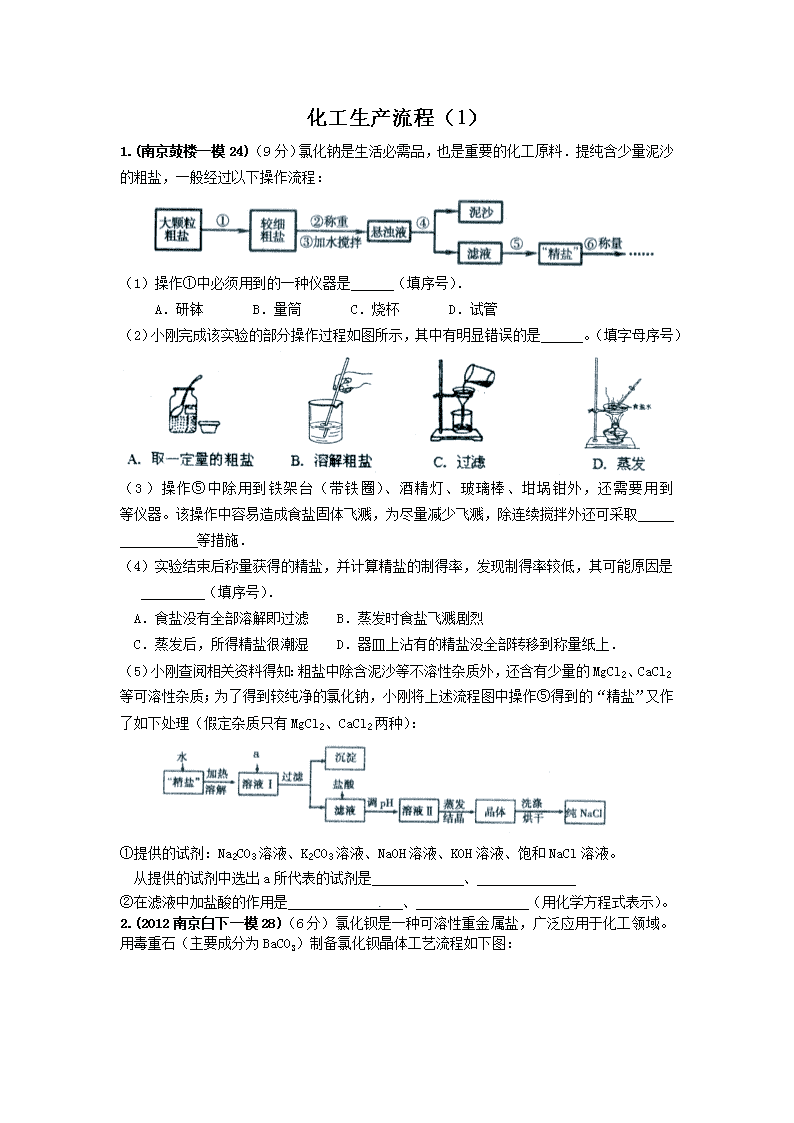
1.(南京鼓楼一模24)(9分)氯化钠是生活必需品,也是重要的化工原料.提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作①中必须用到的一种仪器是 (填序号).
A.研钵 B.量筒 C.烧杯 D.试管
(2)小刚完成该实验的部分操作过程如图所示,其中有明显错误的是 。(填字母序号)
(3)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到 等仪器。该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取
等措施.
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是
(填序号).
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上.
(5)小刚查阅相关资料得知:粗盐中除含泥沙等不溶性杂质外,还含有少量的MgCl2、CaCl2等可溶性杂质;为了得到较纯净的氯化钠,小刚将上述流程图中操作⑤得到的“精盐”又作了如下处理(假定杂质只有MgCl2、CaCl2两种):
①提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、KOH溶液、饱和NaCl溶液。
从提供的试剂中选出a所代表的试剂是 、
②在滤液中加盐酸的作用是 、 (用化学方程式表示)。
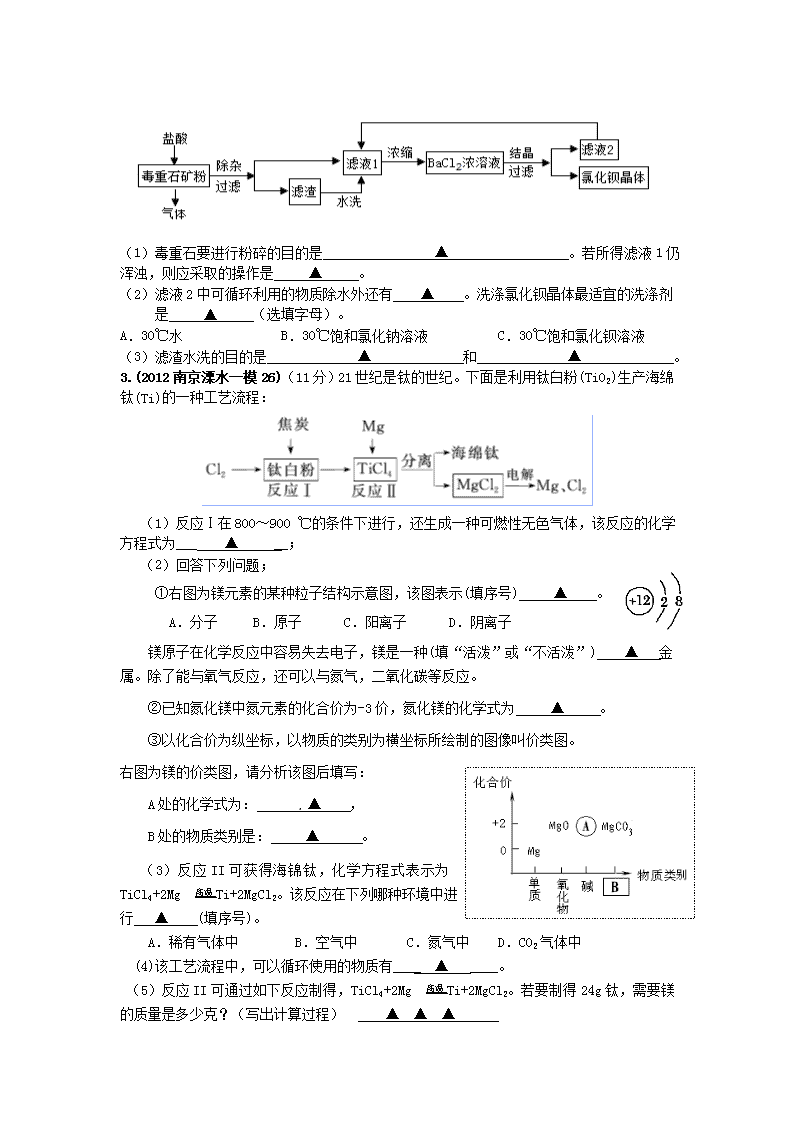
2.(2012南京白下一模28)(6分)氯化钡是一种可溶性重金属盐,广泛应用于化工领域。用毒重石(主要成分为BaCO3)制备氯化钡晶体工艺流程如下图:
(1)毒重石要进行粉碎的目的是 ▲ 。若所得滤液1仍浑浊,则应采取的操作是 ▲ 。
(2)滤液2中可循环利用的物质除水外还有 ▲ 。洗涤氯化钡晶体最适宜的洗涤剂是 ▲ (选填字母)。
A.30℃水 B.30℃饱和氯化钠溶液 C.30℃饱和氯化钡溶液
(3)滤渣水洗的目的是 ▲ 和 ▲ 。
3.(2012南京溧水一模26)(11分)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
(1)反应Ⅰ在800~900 ℃的条件下进行,还生成一种可燃性无色气体,该反应的化学方程式为___ ▲ __;
(2)回答下列问题;
①右图为镁元素的某种粒子结构示意图,该图表示(填序号) ▲ 。
A.分子 B.原子 C.阳离子 D.阴离子
镁原子在化学反应中容易失去电子,镁是一种(填“活泼”或“不活泼”) ▲ 金属。除了能与氧气反应,还可以与氮气,二氧化碳等反应。
②已知氮化镁中氮元素的化合价为-3价,氮化镁的化学式为 ▲ 。
③以化合价为纵坐标,以物质的类别为横坐标所绘制的图像叫价类图。
右图为镁的价类图,请分析该图后填写:
A处的化学式为: ▲ ,
B处的物质类别是: ▲ 。
(3)反应II可获得海锦钛,化学方程式表示为TiCl4+2Mg 高温Ti+2MgCl2。该反应在下列哪种环境中进行 ▲ (填序号)。
A.稀有气体中 B.空气中 C.氮气中 D.CO2气体中
(4)该工艺流程中,可以循环使用的物质有____ ▲ ____。
(5)反应II可通过如下反应制得,TiCl4+2Mg 高温Ti+2MgCl2。若要制得24g钛,需要镁的质量是多少克?(写出计算过程) ▲ ▲ ▲
…
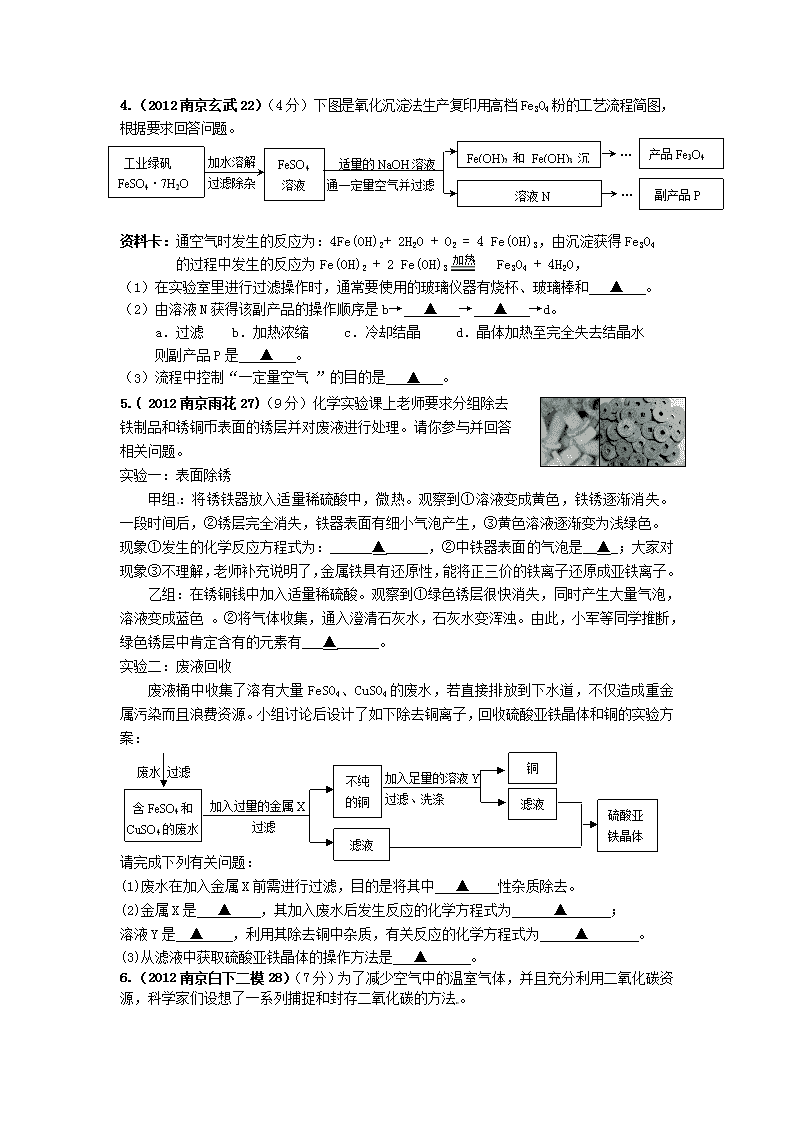
FeSO4
溶液
工业绿矾
FeSO4·7H2O
溶液N
产品Fe3O4
加水溶解
过滤除杂
适量的NaOH溶液
通一定量空气并过滤
Fe(OH)2和Fe(OH)3沉淀
副产品P
…
4.(2012南京玄武22)(4分)下图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题。
资料卡:通空气时发生的反应为:4Fe(OH)2+ 2H2O + O2 = 4 Fe(OH)3,由沉淀获得Fe3O4
加热
的过程中发生的反应为Fe(OH)2 + 2 Fe(OH)3 Fe3O4 + 4H2O,
(1)在实验室里进行过滤操作时,通常要使用的玻璃仪器有烧杯、玻璃棒和 ▲ 。
(2)由溶液N获得该副产品的操作顺序是b→ ▲ → ▲ →d。
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
则副产品P是 ▲ 。
(3)流程中控制“一定量空气 ”的目的是 ▲ 。
5.( 2012南京雨花27)(9分)化学实验课上老师要求分组除去
铁制品和锈铜币表面的锈层并对废液进行处理。请你参与并回答
相关问题。
实验一:表面除锈
甲组:将锈铁器放入适量稀硫酸中,微热。观察到①溶液变成黄色,铁锈逐渐消失。一段时间后,②锈层完全消失,铁器表面有细小气泡产生,③黄色溶液逐渐变为浅绿色。
现象①发生的化学反应方程式为:______▲______,②中铁器表面的气泡是__▲_;大家对现象③不理解,老师补充说明了,金属铁具有还原性,能将正三价的铁离子还原成亚铁离子。
乙组:在锈铜钱中加入适量稀硫酸。观察到①绿色锈层很快消失,同时产生大量气泡,溶液变成蓝色 。②将气体收集,通入澄清石灰水,石灰水变浑浊。由此,小军等同学推断,绿色锈层中肯定含有的元素有___▲______。
实验二:废液回收
废液桶中收集了溶有大量FeSO4、CuSO4的废水,若直接排放到下水道,不仅造成重金属污染而且浪费资源。小组讨论后设计了如下除去铜离子,回收硫酸亚铁晶体和铜的实验方案:
加入足量的溶液Y
过滤、洗涤
加入过量的金属X
过滤
含FeSO4和
CuSO4的废水
滤液
铜
不纯
的铜
滤液
硫酸亚
铁晶体
废水 过滤
请完成下列有关问题:
(1)废水在加入金属X前需进行过滤,目的是将其中 ▲ 性杂质除去。
(2)金属X是 ▲ ,其加入废水后发生反应的化学方程式为 ▲ ;
溶液Y是 ▲ ,利用其除去铜中杂质,有关反应的化学方程式为 ▲ 。
(3)从滤液中获取硫酸亚铁晶体的操作方法是 ▲ 。
6.(2012南京白下二模28)(7分)为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)生石灰捕捉和封存二氧化碳法(图1):
步骤一 以生石灰为原料捕捉空气中的CO2并将其封存在碳酸钙中;步骤二 将步骤一所捕捉和封存的CO2释放出来,得到的高纯度CO2是重要的化工生产原料。在整个流程中,循环利用的物质是 ▲ 。
(2)烧碱溶液捕捉和封存二氧化碳法(图2):
①喷雾反应器中,发生反应的化学方程式为 ▲ ,NaOH溶液喷成雾状的目的是 ▲ 。
②过滤环节中所得滤渣的主要成分是 ▲ ,请用化学方程式说明原因:
▲ , ▲ 。
③在整个流程中,循环利用的物质是 ▲ 。
7.(2012南京鼓楼二模26)(6分) 金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空中技术、航海、化工、医疗上不可缺少的材料。
工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去):
(1)电解MgCl2的化学方程式为 ▲ 。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3 ▲ 的不同。
(3)④反应的化学方程式为_______________▲_________________,该反应的基本反应类型是 ▲ ,该反应在氩气中进行的理由是__________▲_______________。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有__▲__。
8、用作牙膏摩擦剂的轻质碳酸钙可以用矿石A来制备,某化学兴趣小组设计了2种转化流程,如下图所示。
已知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应:
CO2+Ca(OH)2===CaCO3↓+H2O, CaCO3+ H2O + CO2===Ca(HCO3)2;
微热
b.碳酸氢钙溶于水,微热易分解:
Ca(HCO3)2===== CaCO3↓+H2O+ CO2↑;
c.生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆。
(1)小王主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单。
请写出反应①和④的化学方程式:
① ;④ ;
操作Ⅱ包括 等工序。
(2)制轻质碳酸钙时,D为 (选填“悬浊液”或“溶液”或“乳浊液”),
理由是: .
(3)小李认为流程①、②、③和操作I比小王的主张更好,其理由是:_______________
;操作I包括搅拌和微热等工序。
9、坐落于常熟的江苏常福电缆厂是一家以生产电缆类产品为主的企业.在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法.
甲同学根据已学知识,提出了一套回收方案:
乙同学在查阅资料后得知:在通入空气并加热的务件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O22CuSO4+2H2O),于是他提出了另一套方案:
(1)甲方案的②③三个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
② ;③ .
(2)从环保角度对两套方案的不同部分进行比较,你认为 (选填“甲”或“乙”)的方案更合理.理由是: .
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑.你认为丙这么说的道理是: .
丁又提出了疑问:“如果铁过量,剩余的铁会混在红色粉末中,该用什么化学方法
处理?”.请提出你的想法: .
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益.请写出使“绿矾”结晶的两种可能方法: 、 (“绿矾”溶解度随温度升高而增大).
10.
海水“制碱”。下图是海水“制碱”的部分简单流程。
步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、
。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为 。
(拓展)
△
已知有关物质重要反应的化学方程式如下:
2NH4Cl +X====2NH3↑+CaCl2+2H2O 、 NH4Cl ==== NH3↑+HCl↑
根据以上信息回答下列问题。
(1)盐水精制的过程是除去溶液中各种杂质的过程。为将盐水中含有的Ca2+、Mg2+等沉积,可以向中加入过量纯碱.此时将混合液中不溶物除去的方法是 ;溶液中多余的纯碱可以加 试剂来除去。
(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通人二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要加压条件的原因是:_______________ 。
(3)在氨碱工业的历史上.如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”.即在氯化铵溶液中加入物质X (填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化铵的 ,使氯化铵晶体单独析出得到另一种产品——氮肥.氯化钠溶液则可以循环利用。
(4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体?
答: 。
化学工艺流程参考答案
1.(9分,每空1分,(2)、(4)错选、多选均不给分,漏选给一半分。)
(1)A (2)AC (3)蒸发皿 来回移动酒精灯 (4)ABD
(5)① NaOH溶液 、 Na2CO3溶液 ② HCl+NaOH=NaCl+H2O 、 2HCl+Na2CO3=2NaCl+CO2↑+H2O
2.(6分)(1)增大反应物接触面积使反应更加充分 重新过滤 (2)BaCl2 C
(3)提高原料的利用率(或提高产率) 减少可溶性重金属钡盐对环境的污染。
3.(11分)
(1)Cl2 + TiO2 + C高温= TiCl4 +CO (2)①C 活泼; ②Mg3N2 ③Mg(OH)2 盐
(3)A (4)Mg、Cl2。 (5)(写出计算过程)略
4.(4分,每空1分)(1)漏斗 (2) c a 硫酸钠( Na2SO4)
(3)控制Fe(OH)2的转化量(防止Fe(OH)2全部转化为Fe(OH)3等合理答案也可)
5.(本题共9分, 每空1分)
实验一: Fe2O3+3H2SO4====Fe2(SO4)3+3H2 O 氢气 Cu、C、O(有H不给分)
实验二:(1)不溶;
(2)Fe(或铁);Fe + CuSO4 = FeSO4 + Cu;稀硫酸;Fe + H2SO4 = FeSO4 + H2↑
(3)结晶(或蒸发结晶或冷却结晶)
6.(7分)(1)CaO
(2)①CO2+2NaOH===Na2CO3+H2O 增大气体与液体的接触面积,使反应更充分
②CaCO3 CaO+H2O===Ca(OH)2 Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
③CaO、NaOH
7.(6分,每空1分)
(1)MgCl2=通电== Mg+ Cl2↑(2)沸点(3)2Mg+TiCl4=通电==2 MgCl2+ Ti ;置换,防止Mg、Ti被氧化(4)MgCl2
8.
9.
10. NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl 2NaHCO3△ Na2CO3+ H2O+CO2↑ 氨气溶于水形成碱性溶液,更易于吸收二氧化碳 (拓展)(1)过滤 盐酸 (2)促进更多CO2溶解反应充分 (3)Ca(OH)2 溶解度(4)氯化铵受热易分解