- 70.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
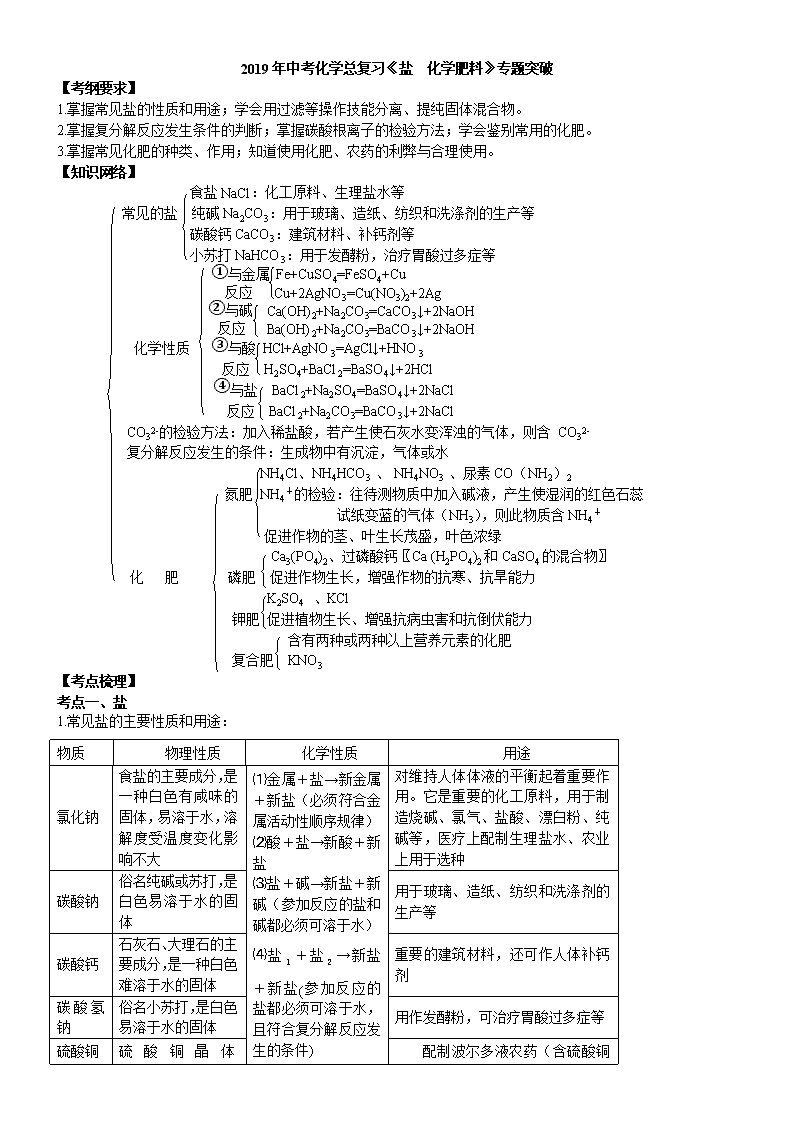
2019年中考化学总复习《盐 化学肥料》专题突破
【考纲要求】
1.掌握常见盐的性质和用途;学会用过滤等操作技能分离、提纯固体混合物。
2.掌握复分解反应发生条件的判断;掌握碳酸根离子的检验方法;学会鉴别常用的化肥。
3.掌握常见化肥的种类、作用;知道使用化肥、农药的利弊与合理使用。
【知识网络】
食盐NaCl:化工原料、生理盐水等
常见的盐 纯碱Na2CO3:用于玻璃、造纸、纺织和洗涤剂的生产等
碳酸钙CaCO3:建筑材料、补钙剂等
小苏打NaHCO3:用于发酵粉,治疗胃酸过多症等
①与金属 Fe+CuSO4=FeSO4+Cu
反应 Cu+2AgNO3=Cu(NO3)2+2Ag
②与碱 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
反应 Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
化学性质 ③与酸 HCl+AgNO3=AgCl↓+HNO3
反应 H2SO4+BaCl2=BaSO4↓+2HCl
④与盐 BaCl2+Na2SO4=BaSO4↓+2NaCl
反应 BaCl2+Na2CO3=BaCO3↓+2NaCl
CO32-的检验方法:加入稀盐酸,若产生使石灰水变浑浊的气体,则含 CO32-
复分解反应发生的条件:生成物中有沉淀,气体或水
NH4Cl、NH4HCO3 、 NH4NO3 、尿素CO(NH2)2
氮肥 NH4+的检验:往待测物质中加入碱液,产生使湿润的红色石蕊
试纸变蓝的气体(NH3),则此物质含NH4+
促进作物的茎、叶生长茂盛,叶色浓绿
Ca3(PO4)2、过磷酸钙〖Ca (H2PO4)2和CaSO4的混合物〗
化 肥 磷肥 促进作物生长,增强作物的抗寒、抗旱能力
K2SO4 、KCl
钾肥 促进植物生长、增强抗病虫害和抗倒伏能力
含有两种或两种以上营养元素的化肥
复合肥 KNO3
【考点梳理】
考点一、盐
1.常见盐的主要性质和用途:
物质
物理性质
化学性质
用途
氯化钠
食盐的主要成分,是一种白色有咸味的固体,易溶于水,溶解度受温度变化影响不大
⑴金属+盐→新金属+新盐(必须符合金属活动性顺序规律)
⑵酸+盐→新酸+新盐
⑶盐+碱→新盐+新碱(参加反应的盐和碱都必须可溶于水)
⑷盐1+盐2→新盐+新盐(参加反应的盐都必须可溶于水,且符合复分解反应发生的条件)
对维持人体体液的平衡起着重要作用。它是重要的化工原料,用于制造烧碱、氯气、盐酸、漂白粉、纯碱等,医疗上配制生理盐水、农业上用于选种
碳酸钠
俗名纯碱或苏打,是白色易溶于水的固体
用于玻璃、造纸、纺织和洗涤剂的生产等
碳酸钙
石灰石、大理石的主要成分,是一种白色难溶于水的固体
重要的建筑材料,还可作人体补钙剂
碳酸氢钠
俗名小苏打,是白色易溶于水的固体
用作发酵粉,可治疗胃酸过多症等
硫酸铜
硫酸铜晶体CuSO4•5H2O俗名蓝矾或胆矾,是蓝色晶体,加热时能失去结晶水。而硫酸铜是白色固体,能溶于水,水溶液是蓝色,具有毒性
配制波尔多液农药(含硫酸铜和氢氧化钙)等
2.盐发生化学反应的条件:
(1)盐与金属的反应:反应物中盐必须能溶于水,金属的活动性比盐中金属的活动性要强。
(2)盐与酸的反应:反应物中的酸一般是指盐酸、硫酸、硝酸。盐若是碳酸盐,则可以不溶;若不是碳酸盐,则要可溶于水。
(3)盐与碱的反应:盐与碱都要可溶于水,生成物中要有沉淀或气体。
(4)盐与盐的反应:反应物都要可溶于水,生成物中要有沉淀。
3.粗盐提纯的主要步骤:溶解、过滤、蒸发。提纯含有氯化钙、氯化镁、硫酸钠以及不溶性杂质的粗盐的主要流程如图所示:
4.部分盐的鉴别:
(1)碳酸盐(CO32-)的鉴别:用盐酸和石灰水
如:K2CO3 + 2HCl = 2KCl + H2O + CO2↑ CO2 + Ca(OH)2 = CaCO3↓+ H2O
(2)铵盐(NH4+)的鉴别:用氢氧化钠溶液或与熟石灰研磨
如: NH4Cl + NaOH = NaCl + H2O + NH3↑
2NH4Cl + Ca(OH)2 = CaCl 2+ 2H2O + 2NH3↑
【要点诠释】
1.注意食盐与氯化钠、盐的区别。食盐是特指主要成分是氯化钠的调味品,目前我国的食盐主要是加碘盐(其中含有少量的碘酸钾),盐则是一类物质的总称,氯化钠是盐类物质中的一种。
2.碳酸钙不能溶于水而能溶于含有二氧化碳的水,溶解过程的变化为CaCO3+H2O+CO2=Ca(HCO3)2。Ca(HCO3)2能溶于水,其水溶液受热时会分解生成CaCO3和CO2,Ca(HCO3)2CaCO3↓+H2O+CO2↑,石灰石岩洞中的钟乳石、石笋、石柱就是这样形成的。
3.要判断几种物质在同一种溶液中能不能大量共存,关键是看这几种物质能否发生反应,若能反应,则不能共存,反之,则能共存。要判断几种离子在同一种溶液中能不能大量共存,关键是这些离子相互结合能不能生成沉淀或气体或水。如:与H+不能共存的有OH-,CO32-,HCO3-;与OH-不能共存的有H+,NH3+,Cu2+,Fe3+,Mg2+,Al2+,Zn2+,Ag+等;与Cl-不能共存的有Ag+;与SO42-不能共存的有Ba2+;与CO32-不能共存的有H+、Ca2+,Ba2+,Cu2+等。如果离子相互结合能生成微溶性物质也不能大量共存,如:SO42-和Ca2+、Ag+;CO32-和Mg2+。
4.共存问题有时还把溶液的酸碱性和溶液的颜色结合起来考查。如果是在酸性溶液(pH<7的溶液)中共存,则提供的物质或离子不能与H+反应;如果是在碱性溶液(pH>7的溶液)中共存.则提供的物质或离子不能与OH-反应。如果是无色溶液,则溶液中不能有Cu2+(蓝色),Fe2+(浅绿色),Fe3+(黄色)。
考点二、复分解反应发生的条件
复分解反应发生的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
【要点诠释】
1.复分解反应属于基本反应类型,其特点为AB+CD=AD+CB。
2.复分解反应发生的三个条件中,只要具备其中一个,反应就可以进行,不必三个条件都具备。
考点三、化学肥料
1.常见化肥的种类和作用如下表所示:
化肥种类
举例
用途
氮肥
常见的氮肥有铵盐NH4Cl、NH4HCO3,硝酸盐如NH4NO3和NaNO3,还有尿素CO(NH2)2、氨水NH3·H2O等
氮是植物体内蛋白质、核酸和叶绿素的组成元素,能促进作物的茎、叶生长茂盛,叶色浓绿
磷肥
磷肥有Ca3(PO4)2磷矿粉、钙镁磷肥、过磷酸钙〖Ca (H2PO4)2和CaSO4的混合物〗
磷是植物体内核酸、蛋白质和酶等多种重要化合物的组成元素,可以促进作物生长,增强作物的抗寒、抗旱能力
钾肥
常用的钾肥有K2SO4和KCl等
钾具有保证各种代谢过程的顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力等功能
2.复合肥料:是指含有两种或两种以上营养元素的化肥。如KNO3含有钾元素和氮元素两种营养元素,属于复合肥料。
3.氮肥的简易鉴别:
(1)氮肥中的氨水是液态的,碳酸氢铵有强烈的刺激性气味,据此可直接将它们与其他的氮肥相区别。
(2)铵态氮肥能与碱反应,放出氨气,氨气能使湿润的红色石蕊试纸变为蓝色。常用此法检验铵态氮肥。常见氮肥的简易鉴别方法如图所示:
【要点诠释】
1.铵盐能与碱反应,生成氨气。所以铵盐不能与熟石灰、草木灰等碱性物质混合使用,否则会降低肥效。
2.硫酸铵、氯化铵、硝酸铵同时鉴别时,不能先加硝酸银溶液鉴别氯化铵,因为硝酸银与硫酸铵反应,可能生成微溶物硫酸银,出现沉淀。所以要同时区分含SO42-,Cl-和NO3-三种物质时,一般是先加硝酸钡来鉴别出含有SO42-的物质,再加入硝酸银,鉴别出含有Cl-的物质,无现象的则是含有NO3-的物质。 3.氮肥、磷肥、钾肥的简易鉴别方法:一看、二闻、三溶。一看:白色固体是氮肥、钾肥,灰白色固体是磷肥;二闻:有刺激性气味气体放出的是氮肥,无刺激性气味气体放出的是钾肥、磷肥;三溶:氮肥、钾肥全部溶于水,磷肥大多不溶于水或部分溶于水。
【典型例题】
类型一、考查盐的性质和用途
1.有一瓶溶液X,分别滴加到盛有硝酸银、氢氧化钠、氯化钠溶液的试管中,出现的现象如下表,则溶液X是( )
试管中试剂
硝酸银溶液
氢氧化钠溶液
氯化钠溶液
现象
出现白色沉淀
出现红褐色沉淀
无明显现象
A.CuCl2溶液 B.FeCl3溶液 C.H2SO4溶液 D.稀盐酸
【思路点拨】银离子能和氯离子结合成白色沉淀氯化银;铁离子能和氢氧根离子结合成红褐色沉淀氢氧化铁。
【答案】B
【解析】
A.氯化铜能和硝酸银反应生成白色沉淀氯化银和硝酸铜,能和氢氧化钠反应生成蓝色沉淀氢氧化铜和氯化钠,不能和氯化钠反应,因此氯化铜分别滴加到盛有硝酸银、氢氧化钠、氯化钠溶液的试管中时,依次出现白色沉淀、蓝色沉淀、无明显现象;
B.氯化铁能和硝酸银反应生成白色沉淀氯化银和硝酸亚铁,能和氢氧化钠反应生成红褐色沉淀氢氧化铁和氯化钠,不能和氯化钠反应,因此氯化铁分别滴加到盛有硝酸银、氢氧化钠、氯化钠溶液的试管中时,依次出现白色沉淀、红褐色沉淀、无明显现象;
C.稀硫酸能和硝酸银反应生成白色沉淀硫酸银和稀硝酸,能和氢氧化钠反应生成硫酸钠和水,不能和氯化钠反应,因此稀硫酸分别滴加到盛有硝酸银、氢氧化钠、氯化钠溶液的试管中时,依次出现白色沉淀、无明显现象、无明显现象;
D.稀盐酸能和硝酸银反应生成白色沉淀氯化银和稀硝酸,能和氢氧化钠反应生成氯化钠和水,不能和氯化钠反应,因此稀盐酸分别滴加到盛有硝酸银、氢氧化钠、氯化钠溶液的试管中时,依次出现白色沉淀、无明显现象、无明显现象。
【总结升华】本题主要考查物质的性质,只有掌握了物质的性质,才能够对各种问题作出正确的解答。
2.假设CuSO4溶液与Ba(NO3)2溶液恰好完全反应,生成白色沉淀A与溶液B,过滤后,溶液B再与过量的NaOH溶液反应,生成蓝色沉淀C和溶液D,则溶液D中溶质的组成为 。 (填化学式)
【思路点拨】根据题意:CuSO4溶液与Ba(NO3)2溶液恰好完全反应,生成白色沉淀A是硫酸钡和溶液B硝酸铜;硝酸铜与过量的NaOH溶液反应,生成蓝色沉淀C是氢氧化铜,同时生成硝酸钠。溶液D中除硝酸钠外,还有剩余的氢氧化钠。
【答案】NaNO3和NaOH
【解析】由题意,根据方程式CuSO4+Ba(NO3)2=CuNO3)2+BaSO4↓可知:CuSO4溶液与Ba(NO3)2溶液恰好完全反应,生成白色沉淀A(是硫酸钡)和溶液B(溶质是硝酸铜);硝酸铜与过量的NaOH溶液反应,生成蓝色沉淀C(是氢氧化铜),同时生成硝酸钠,溶液中还有剩余的氢氧化钠。所以,溶液D中溶质的组成为NaNO3和NaOH。
【总结升华】要想判断出溶液D中的溶质,关键是分清反应中那种物质过量以及恰好反应的情况。
3.海洋中有丰富的资源,如图所示利用海水可获得许多化工产品。
(1)粗盐中除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液中选出a所代表的试剂,按滴加顺序依次为: 、 、 ; 加入BaCl2溶液发生反应的化学方程式为 。
(2)在滤液中加盐酸的作用是 。
(3)第③步发生反应的基本反应类型是 。
【思路点拨】(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,则用氢氧化钠除掉氯化镁,用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡;(2)根据(1)中加的试剂都是过量分析;(3)根据反应物、生成物判断反应类型。
【答案】
(1)过量的NaOH溶液 过量的BaCl2溶液 过量碳酸钠溶液 BaCl2+Na2SO4═BaSO4↓+2NaCl
(2)除去溶液中的NaOH、Na2CO3 (3)分解
【解析】
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,则用氢氧化钠除掉氯化镁,用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙和多余的氯化钡;从提供的试剂中选出a所代表的试剂,按正确滴加顺序依次为:过量的NaOH溶液、过量氯化钡溶液、过量碳酸钠溶液。氯化钡和硫酸钠反应生成硫酸钡和氯化钠,反应的化学方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl。
(2)在滤液中加盐酸的作用是除去过量的NaOH、Na2CO3。
(3)带结晶水的氯化镁加热生成氯化镁和水,该反应属于分解反应。
【总结升华】掌握粗盐提纯的方法及其注意事项是解题的关键。含有较多杂质的氯化钠晶体叫做粗盐。通过晾晒海水或煮盐井水、盐湖水而得到的粗盐中含有较多的可溶性杂质(氯化镁、氯化钙、硫酸镁等)和不溶性杂质(泥沙等),可以通过溶解、过滤、蒸发、结晶等步骤来制取精盐。
举一反三:
【变式1】将10g碳酸钙固体高温煅烧一段时间,冷却后投入足量稀盐酸中完全反应.有关说法错误的是( )
A.共生成4.4g二氧化碳
B.煅烧越充分消耗盐酸越少
C.煅烧后固体氧元素质量分数减少
D.完全反应后得到溶液中无固体残留
【答案】B
【解析】
A.根据CaCO3CaO+CO2↑,可以计算,生成4.4g二氧化碳,故A正确;
B.碳酸钙、氧化钙和盐酸都会生成氯化钙,然后结合钙元素守恒,所以生成的氯化钙也始终是11.1g,故B错误;
C.根据CaCO3CaO+CO2↑,化学方程式可以看出,煅烧后固体氧元素质量分数减少,故C正确;
D.反应前固体是碳酸钙,反应后的固体是氧化钙,所以碳酸钙、氧化钙和盐酸都会生成氯化钙,故完全反应后得到溶液中无固体残留,故D正确。
【变式2】下列各物质能在pH=1的溶液中大量共存,且能得到无色溶液的是( )
A.BaCl2,NaOH,NaCl,CaCl2
B.Mg(NO3)2,KNO3,NaCl,ZnSO4
C.CuSO4,KCl,Na2SO4,NaNO3
D.BaCl2,CaCl2,Al(NO3)3,Na2SO4
【答案】B
【解析】在pH=1的溶液中大量共存,即能在酸性溶液中共存;得到无色溶液即溶液中不能有带颜色的离子。A选项中NaOH不能与酸溶液共存,C选项中CuSO4溶液是蓝色的,D选项中BaCl2和Na2SO4不能共存。
类型二、考查化学肥料
4.为鉴别四种化肥:磷矿粉、硝酸铵、硝酸钾和氯化铵,实验小组的同学将四种化肥样品带到化学实验室,请你参与他们的实验:(1)首先观察外观,灰白色固体的是 ;(2)将其余三种白色固体分别加熟石灰研磨,有氨味的是 ;为进一步鉴别这两种化肥,取样溶于水后分别滴加 溶液,通过观察是否有白色沉淀生成即可将两种化肥鉴别开。
【思路点拨】根据化肥的物理、化学性质进行分析解答本题。如磷矿粉是灰白色的粉末,铵盐和显碱性的物质混合能生成有刺激性气味的气体氨气。
【答案】磷矿粉 硝酸铵和氯化铵 硝酸银
【解析】
(1)首先观察外观。灰白色固体的是磷矿粉,其余三种为白色晶体。
(2)加熟石灰研磨,硝酸铵和氯化铵(都含有铵根)与熟石灰研磨会产生氨气,所以会有氨味。
(3)为进一步鉴别这两种化肥,加硝酸银溶液,因为只有氯化铵会与硝酸银反应生成氯化银白色沉淀,这样就很容易区分硝酸铵与氯化铵这两种化肥。
【总结升华】此题是对化肥知识的考查,解题的关键是对四种化肥的相关物理及化学性质的掌握,主要是结合铵根离子及氯离子的检验进行解题。
5.有一包化学肥料,可能是硫酸铵、过磷酸钙、氯化钾中的一种。取少量样品,观察到其外观为白色晶体,加入水后能全部溶解;另取少量样品与熟石灰混合、研磨,没有刺激性气味气体放出,这种化肥是 。
【思路点拨】铵盐、钾盐易溶于水;铵态氮肥能和熟石灰等显碱性的物质发生化学反应,生成有刺激性气味的氨气。
【答案】氯化钾(KCl)
【解析】过磷酸钙(灰白色粉末)不是白色晶体;硫酸铵是一种白色晶体,易溶于水,和熟石灰混合、研磨,能生成有刺激性气味的气体(氨气);只有氯化钾符合题目要求。
【总结升华】解答本题要充分理解磷酸盐、钾盐、铵盐的物理性质和化学性质,例如水溶性、颜色、能否与熟石灰等显碱性的物质反应。
6.能使农作物枝叶繁茂、叶色浓绿,还能提高产量的化学肥料是 。
A.尿素 B.钙镁磷肥 C.硫酸钾 D.碳酸氢铵(或硫酸铵)
【思路点拨】含有氮元素的化肥属于氮肥,氮肥能使农作物枝叶繁茂、叶色浓绿、还能提高产量。
【答案】A、D
【解析】尿素、碳酸氢铵、硫酸铵中含有氮元素,属于氮肥,尿素能使农作物枝叶繁茂、叶色浓绿,还能提高产量。故选A、D。
【总结升华】常见化肥的种类、作用及缺乏时的表现归纳如下表:
化肥种类
物质
在植物生长发育过程中的作用
缺乏时的表现
氮肥
尿素:CO(NH2)2
氨水:NH3·H2O
铵盐:NH4HCO3、NH4Cl等
硝酸盐:NH4NO3、NaNO3等
氮是植物体内蛋白质、核酸和叶绿素的组成元素。氮肥能促进作物的茎叶生长茂盛,叶色浓绿
植物矮小瘦弱,叶片发黄,严重时叶脉呈淡棕色
磷肥
磷矿粉:Ca3(PO4)2
钙镁磷肥(钙和镁的磷酸盐)
过磷酸钙:Ca(H2PO4)2和CaSO4的混合物
磷肥能促进作物根系发达,增强抗寒抗旱能力,还能促进作物提早成熟,穗粒增多,籽粒饱满
植株特别矮小,叶片呈暗绿色,并出现紫色
钾肥
硫酸钾:K2SO4
氯化钾:KCl
钾肥能保证各种代谢过程的进行、促进植物生长、增强抗病虫害和抗倒伏能力
茎杆软弱,容易倒伏,叶片的边缘和尖端呈现褐色,并逐渐焦枯
复合肥料
磷酸二氢铵:NH4H2PO4
磷酸氢二铵:(NH4)2HPO4
硝酸钾:KNO3
同时含有两种或两种以上的营养元素,能同时均匀地供给作物几种养分,充分发挥营养元素间的相互作用,有效成分高
举一反三:
【变式1】某农民种植的荔枝因欠缺磷肥和氮肥而出现生长较慢、叶色泛黄且产量较低的现象。下列肥料最适合使用的是( )
A.尿素[CO(NH2)2] B.磷酸二氢铵(NH4H2PO4)
C.磷酸二氢钙[Ca(H2PO4)2] D.氯化钾(KCl)
【答案】B
【变式2】这学期,小亮和班级的另两名同学主动承担了维护班级花坛的工作。前不久,他们发现有部分花的叶面出现了枯黄的现象,便及时向花坛里施用了足量的化肥,但效果并不明显。他们决定用所学的化学知识来解决这一问题。
收集资料:
(1)花的叶色枯黄,他们选择施用________(填“氮”、“磷”或“钾”)肥是正确的。
(2)前一段时间他们曾用熟石灰(化学式为________)对花坛中的________性土壤进行过改良。
(3)近一个星期一直无雨,气温较高。
(4)通过查阅资料,小亮和同学们知道含NH4+的盐受热或与碱混合使用会放出有刺激性气味的氨气,氨气的水溶液呈碱性。
提出假设:
(1)太阳的曝晒和气温的升高都可使肥效流失。
(2)熟石灰与化肥反应也可使肥效流失。
设计并进行实验:
(1)小亮取少量这种化肥置于试管中加热,并在试管口放一条干燥的pH试纸,pH试纸无变化。
(2)另取少量这种化肥与熟石灰混合研磨,闻到________气味。
结论:
由以上第二个实验中的现象,得出肥效流失与________ 有关。
反思与应用:
(1)小亮进行的第一个实验中,pH试纸无变化,这与查阅资料给出的信息不符,其原因是________。
(2)参与了小亮和同学们的探究活动,想必你也一定受到了启发,请你对小亮保存剩余化肥提出一条合理化建议 。
【答案】收集资料:(1)氮 (2)Ca(OH)2 酸
设计并进行实验:(2)氨(或刺激性)
结论:土壤中残留的熟石灰
反思与应用:(1)pH试纸是干燥的(或干燥的氨气不能使于燥的pH试纸变色等) (2)防晒(或防潮等)