- 184.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
永清2014模拟题化学部分
一、选择题(本大题包括7小题,共21分;每小题只有一个选项符合题意)
1.小亮同学对所学部分化学知识归纳如下,其中都正确的一组是( )
A.
合金,陶瓷,橡胶属于合成材料;煤,石油,液化气属于化石燃料
B.
应禁止食用使人发胖的油脂,胃酸过多的人可多喝柠檬汁
C.
电动自行车充电是电能转化为化学能,电动车喷漆可以防止钢铁的锈蚀
D.
用汽油洗涤油污使乳化作用,用氮气做粮食瓜果的保护气
2.化学实验的规范操作很重要性.以下实验操作符合规范要求的是( )
A.
“粗盐的提纯”实验中,过滤时将悬浊液直接倒入漏斗里
B.
“氯酸钾制取氧气”实验中,收集好气体后应先将导管移出水槽再停止加热
C.
“配制一定溶质质量分数的溶液”实验中,多余的药品应放回原试剂瓶
D.
“测定溶液酸碱性强弱”实验中,测定溶液pH时应先将试纸湿润
3.蜡烛成分之一化学式为C20H42,关于该成分的说法不正确的是( )
A.
是一种化合物
B.
该物质是由20个碳原子和42个氢原子构成
C.
由碳元素和氢元素组成
D.
碳原子与氢原子个数比为10:21
4.下列试管壁内残留的固体物质不能用稀盐酸除去的是( )
A.
盛放过生锈铁钉后留下的红棕色固体
B.
用氯化钡试液检验硫酸后留下的白色固体
C.
装氧化铜粉末后留下的黑色固体
D.
用澄清石灰水检验CO2后留下的白色固体
5. 向氢氧化钠溶液中不断滴入盐酸,得到如图的曲线,下列有关判断不正确的是( )
A.
a点时溶液中有氢氧化钠和氯化钠
B.
a点到b点溶液中盐酸的量不断增大
C.
b点时,HCl与NaOH恰好完全反应
D.
b点到c点时,溶液中氯化钠的量不再增加
6.PM2.5是可入肺颗粒物,为降低PM2.5的含量,应该提倡( )
A.
露天焚烧秸秆
B.
充分利用太阳能
C.
直接燃烧煤炭
D.
大量使用燃油汽车
7.下列四个坐标示意图分别表示四个实验过程中的某些变化情况,其中肯定错误的是
A.加热一定量碳铵(NH4HCO3)的实验,试管中固体的质量变化
B.等质量的镁条和铁丝分别与足量的稀硫酸反应,产生气体的质量变化
C.向一定质量的水中加入氢氧化钠时,形成的溶液pH的变化
D.向盛有一定量Ba(OH)2溶液的烧杯中逐滴滴加稀硫酸,测得烧杯中溶液导电性的变化
二、填空题(本大题包括6小题,共24分)
8.(3分)水是我们很熟悉的物质,通过化学学习之后,对水有了一些新的认识.
①了解了水的宏观组成,即水是由 _________ 元素组成的;
②知道了水的微观结构,构成水的微粒是 _________ (填A、B、C、D字母序号);
③认识了用实验测定物质元素组成方法.化学家卡文迪什做的关于水的组成实验原理如下:
2H2+O22H2O,请你从宏观角度描述该化学方程式表示的含义 _________ ;
9.(4分)现有氧气、氮气、氢气、一氧化碳、二氧化碳、二氧化硫、水、食盐等八种物质,
请按要求用化学式填写:
①导致酸雨的气体是 _________
②最常用的溶剂是 _________ ;
③日常生活中用作调味料是 _________ ;
④能与血液里血红蛋白结合的有毒气体是 _________ .
10.(4分)碳是构成物质种类最多的一种元素,许多物质都与我们的生活息息相关.
①CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为 _________ ,若要检验1%甲酸水溶液是否显酸性,能选用的有 _________ (填字母序号)
a.无色酚酞溶液 b.紫色石蕊溶液 c.pH试纸
②化石燃料有煤、石油和天然气,它们都属于 _________ (填“可再生”或“不可再生”)能源.天然气最主要成分是甲烷,完全燃烧生成二氧化碳和水,该燃烧反应的化学方程式为 _________ .
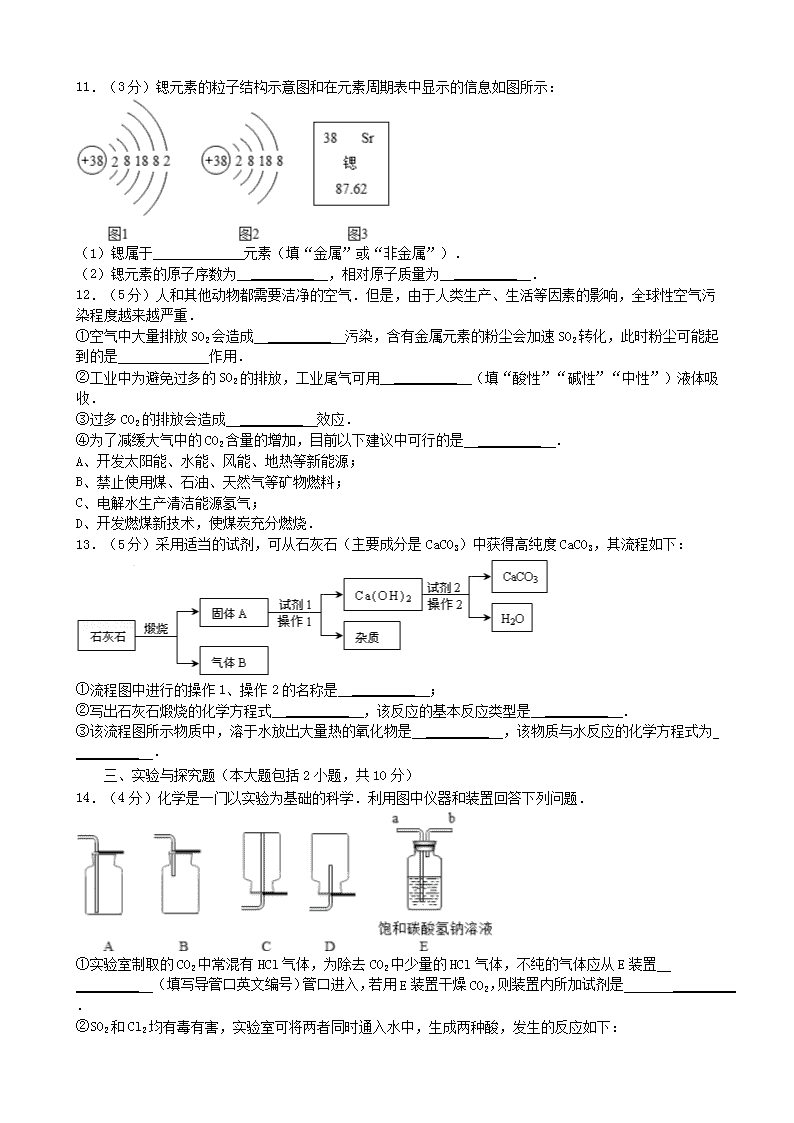
11.(3分)锶元素的粒子结构示意图和在元素周期表中显示的信息如图所示:
(1)锶属于 _________ 元素(填“金属”或“非金属”).
(2)锶元素的原子序数为 _________ ,相对原子质量为 _________ .
12.(5分)人和其他动物都需要洁净的空气.但是,由于人类生产、生活等因素的影响,全球性空气污染程度越来越严重.
①空气中大量排放SO2会造成 _________ 污染,含有金属元素的粉尘会加速SO2转化,此时粉尘可能起到的是 _________ 作用.
②工业中为避免过多的SO2的排放,工业尾气可用 _________ (填“酸性”“碱性”“中性”)液体吸收.
③过多CO2的排放会造成 _________ 效应.
④为了减缓大气中的CO2含量的增加,目前以下建议中可行的是 _________ .
A、开发太阳能、水能、风能、地热等新能源;
B、禁止使用煤、石油、天然气等矿物燃料;
C、电解水生产清洁能源氢气;
D、开发燃煤新技术,使煤炭充分燃烧.
13.(5分)采用适当的试剂,可从石灰石(主要成分是CaCO3)中获得高纯度CaCO3,其流程如下:
①流程图中进行的操作1、操作2的名称是 _________ ;
②写出石灰石煅烧的化学方程式 _________ ,该反应的基本反应类型是 _________ .
③该流程图所示物质中,溶于水放出大量热的氧化物是 _________ ,该物质与水反应的化学方程式为 _________ .
三、实验与探究题(本大题包括2小题,共10分)
14.(4分)化学是一门以实验为基础的科学.利用图中仪器和装置回答下列问题.
①实验室制取的CO2中常混有HCl气体,为除去CO2中少量的HCl气体,不纯的气体应从E装置 _________ (填写导管口英文编号)管口进入,若用E装置干燥CO2,则装置内所加试剂是 _________ .
②SO2和Cl2均有毒有害,实验室可将两者同时通入水中,生成两种酸,发生的反应如下:
SO2+Cl2+2H2O→(酸)+2HCl,其中另一种酸的化学式是 _________ ;向吸收液中投入锌粉会见到大量气泡,此时发生的反应属于 _________ (填写基本反应类型)反应.
15.(6分)碳酸氢钠常用于食品和医药工业。某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究。
【查阅资料】 1.碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
2.碳酸钠溶液呈碱性。
【进行实验】为了验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如右图所示。
(1)加热一段时间后,观察到烧杯内壁有 。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊。写出该反应的化学方程式: 。
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3。
①他们的依据是 。
②兴趣小组为了确定反应后的固体产物成分进行以下实验,请填写下表:
实验
实验现象
结论
实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液
溶液变成红色
固体产物是NaOH,而不是Na2CO3
实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液
固体产物是Na2CO3,而不是NaOH
实验三: 取少量反应后的固体产物,加入过量稀盐酸
产生大量气泡
固体产物是Na2CO3,而不是NaOH
【讨论与评价】实验一的结论与实验二、实验三的结论相反,在讨论时,兴趣小组的同学认为方案一的结论不正确,他们的理由是
。
【总结】请写出碳酸氢钠受热分解的化学方程式 。
四、计算题(本大题包括1小题,共5分)
16.(5分)钙是维持人体正常功能所必需的元素.钙尔奇是常用的补钙剂,主要成分是CaCO3,钙尔奇每片2.0g.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其它成分与盐酸不反应).烧杯内物质质量变为11.34g.试计算:
①反应产生二氧化碳 _________ g,
②每片钙尔奇中含碳酸钙 _________ g ;
③服用钙尔奇通常一日2次,每次1片.则每人每天摄入钙元素的质量为 _________ g.
④根据化学方程式列式计算上述反应所用稀盐酸溶质的质量分数(精确到0.01%) _________ .