- 921.14 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
每日一练(1)
班级 姓名
1.固体A中可能含有Na2SO4、CuSO4、Na2CO3、KNO3中的一种或几种,进行如下实验,
观察、记录现象,并逐步推出结论。请完成下表:
实验步骤及现象
结论
① 将少许A溶于水得到无色溶液B。
A中一定没有
② 在B中加入足量BaCl2溶液,生成白色沉淀。
A中一定有
③ 在白色沉淀中加入足量稀盐酸,沉淀不溶解。
④ 另取少许A进行焰色反应,透过蓝色钴玻璃片,
观察到火 焰呈 色。
A中还有KNO3
2.固体A中可能含有Na2SO4、CuSO4、Na2CO3、KNO3中的一种或几种,进行如下实验,
观察、记录现象,并逐步推出结论。请完成下表:
实验步骤及现象
结论
⑤ 将少许A溶于水得到无色溶液B。
A中一定没有
⑥ 在B中加入足量BaCl2溶液,生成白色沉淀。
A中一定有
⑦ 在白色沉淀中加入足量稀盐酸,沉淀部分溶解。
⑧ 另取少许A进行焰色反应,透过蓝色钴玻璃片,
观察到火 焰呈 色。
A中还有KNO3
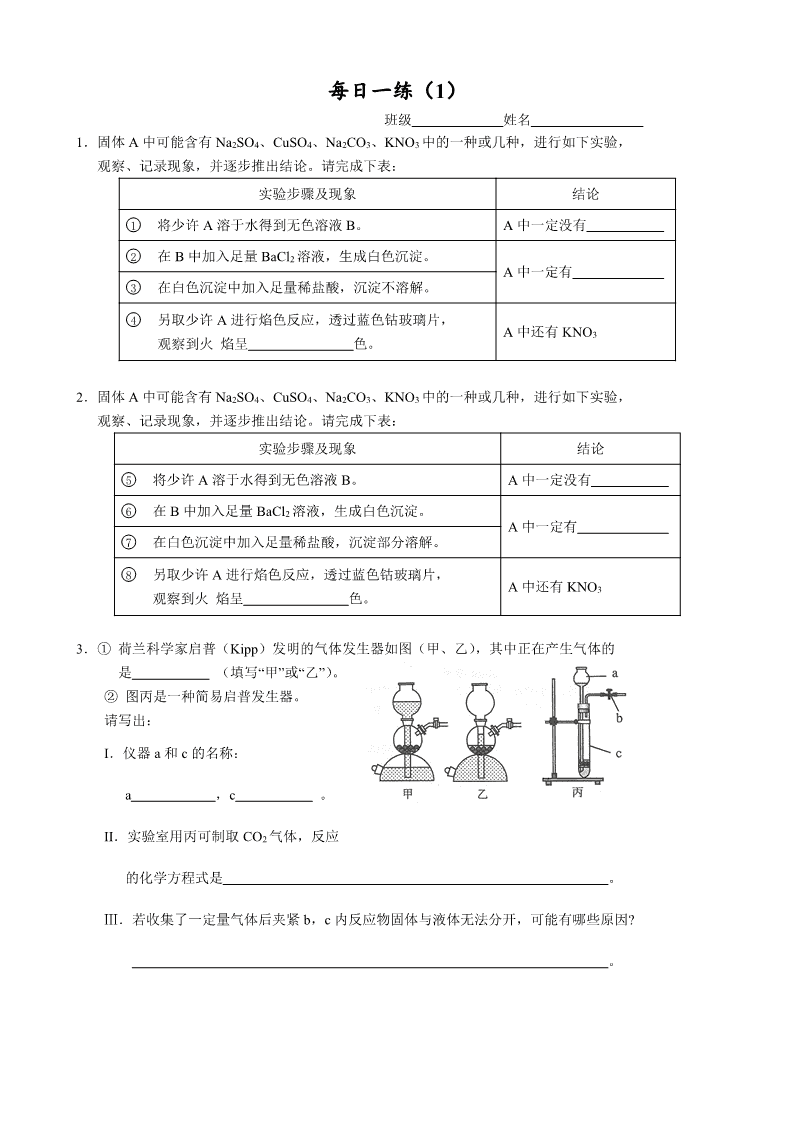
3.① 荷兰科学家启普(Kipp)发明的气体发生器如图(甲、乙),其中正在产生气体的
是 (填写“甲”或“乙”)。
② 图丙是一种简易启普发生器。
请写出:
I.仪器a和c的名称:
a ,c 。
II.实验室用丙可制取CO2气体,反应
的化学方程式是 。
Ⅲ.若收集了一定量气体后夹紧b,c内反应物固体与液体无法分开,可能有哪些原因?
。
每日一练(2)
班级 姓名
1. 某校化学实验室废液桶中收集了溶解大量FeSO4、CuSO4的废水,若直接排放到下水道不仅造成重金属污染而且造成浪费。初三(1)班的同学,准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理。
① 复习常见金属活动性顺序表,在下表空格中分别填入对应的元素符号。
K Ca Mg Al Fe Sn Pb (H) Cu Hg Pt Au
金属活动性依次减弱
② 设计回收硫酸亚铁晶体和铜的实验方案如下:
加入足量的溶液Y
过滤、洗涤
加入过量
的金属X
过滤
含FeSO4和
CuSO4的废水
滤液
铜
不纯
的铜
滤液
热饱和溶液
冷却结晶
硫酸亚
铁晶体
请回答下列问题:
Ⅰ.整个实验过程中多次采取过滤,该操作用到的玻璃仪器有烧杯、 和玻璃棒。
Ⅱ.金属X是 ,其加入废水后发生反应的化学方程式为 ;
溶液Y是 ,利用其除去铜中杂质,有关反应的化学方程式为 。
2.用含有少量CaCl2的NaCl固体,配制浓度为10%的食盐溶液。实验步骤如下图:
(1)加入的X为 ,发生反应的化学方程式 。
加入的Y为 。
(2)若将配制好的溶液装入试剂瓶中,请你填写好标签。
(3)若需要5%的氯化钠溶液200克(密度为1.02克/厘米3),则应量取上述溶液(密度为1.05克/厘米3) _____________毫升(精确到0.1)。
每日一练(3)
班级 姓名
1.小红加热试管中的黑色粉末,将产生的气体通入澄清石灰水中。观察到现象:ⅰ.黑色粉末逐渐变红;ⅱ.澄清石灰水变浑浊。试回答:
① 黑色粉末的成分是(用化学式表示) ;
② 产生现象ⅰ的化学反应方程式为 ,其中氧化剂是 ;
③ 产生现象ⅱ的化学反应方程式为 。
2. 初中化学实验中常用的实验装置如下图所示(选用装置都填字母代号):
(1)写出图中指定仪器的名称:① ;② 。
(2)实验室用无水醋酸钠和碱石灰两种固体混合物加热制甲烷气体,选用装置的是 ;
(3)实验室用水、生石灰、碳酸钠制取固体NaOH,选用装置除D、E外,还需要的装置是 ;
在上述制取过程中,发生的化学反应方程式有: 、
。
(4) 下图表示实验室用稀H2SO4、CuO、Fe粉三种物质,制取铜的两种实验方案。
② 按方案1制取铜,需要选用装置 , 步骤Ⅱ反应的现象是 ;
②若按方案2制取铜,写出步骤Ⅱ发生反应的化学方程式 ,
③若消耗铁粉相同,则实际操作中得到铜较多的是哪一个方案,理由是: 。
每日一练(4)
班级 姓名
1.下图是某研究性学习小组设计的几种装置,请你分析并回答下列问题:
①图中标号仪器为:a b
②装置A可用作实验室制取O2或CO2的发生装置,用此装置制取O2的化学方程式是:
,此反应的基本类型属于 。
③小勤同学从装置A得到启发,在装置A的基础上增加了隔离铜网制成装置B来制取氢气,又用一支底部有一个小洞的试管和矿泉水瓶制成装置C。则B与A相比优点是 ,C与B相比优点是 ;而装置B显示的化学反应状态为 (填“进行中”或“已停止”)。
④在实验室用装置C制取CO2化学反应方程式为 ,若隔离网改用铁丝做成,则产生的后果是 ,说明金属活动性Fe Cu(填“=”或“>”或“<”)。
相对原子质量:H---1 Cl---35.5 S---32 O---16
2.食盐不仅是人类生活必需的调味品,而且是一种重要的工业原料。在实验室里常用它制取氯化氢:2NaCl +H2SO4(浓)2HCl↑ +Na2SO4。
① HCl的式量为_________,摩尔质量为_________。0.1 mol HCl的质量是 g。这些HCl溶于水,可得到7.3%的盐酸 g。
②用上述方法制取7.3 g HCl时,消耗H2SO4 多少mol?(写出计算过程)
每日一练(5)
班级 姓名
1.某工厂排放的废液中含H2SO4和ZnSO4,处理废液回收ZnSO4晶体的流程如下:
废液
过量ZnO
操作Ⅰ
滤液
(ZnSO4)
ZnO
操作Ⅱ
100℃ZnSO4
饱和溶液
冷却
20℃的滤液
ZnSO4晶体
过滤
可供选择的装置如下:
a
b
A B C
请回答:
①写出仪器a、b的名称 、 。
②加入过量ZnO后发生反应的化学方程式为 。
③操作Ⅰ的装置为 (填装置编号);操作Ⅱ的名称是 ,需要的装置
为 (填装置编号)。
④从环保和经济的角度分析,该流程中可重复利用的物质有 。
2.氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板。以下是印刷线路板的生产及废液的处理过程:
请回答下列问题:
① 步骤②中发生了两个反应:2FeCl3 + Fe→3FeCl2 和 ,
涉及化学反应类型为置换和 。
② 过滤是将混合物进行分离,被分离的物质需满足的条件是 。
③ 滤渣的成份有 ,步骤③中发生反应的化学方程式是 。
④ 该流程中可以循环、回收利用的物质是: 。
每日一练(6)
班级 姓名
1.右图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和部分生成物省略)。
请按下列要求填空:
(1)物质a主要成分的化学式是 ;
发生燃烧的化学方程式
(2)物质b主要成分中原子团符号是 ;
(3)物质c(C6H12O6)所属类别是 ,(有机物,无机物);
该物质 中C、H、O三种元素的物质的量比是 ;
1mol(C6H12O6)中有 个氢原子;一个(C6H12O6)分子中有 个氢原子;
(4)标出物质e化学式中带点元素的化合价 。写出氢氧化钠溶液吸收二氧化碳的化学方程式 。有学生认为氢氧化钠溶液吸收二氧化碳后,滴入酚酞显无色,你认为对吗?请说出理由 。
(5)写出由CO2生成物质d的化学反应方程式 。
2. 请从下图中选择适当的实验装置序号填空,并回答有关问题。
(1) A,B装置都可以制取氧气,请写出使用A,B装置制取氧气对应的化学方程式
, ;
对应的基本反应类型为 。如果用B装置制氧气,为便于控制反应速率,装置中的仪器需稍作调整,其方法是 ;
(2)实验室制取CO2选用的发生装置是____________,收集CO2若用D装置,则气体从
(a ,b)进。若用D装置收集氢气,则氢气从 (a ,b)进。
(3)若要除去CO2中混有的HCl气体,得到纯净、干燥的CO2,应在收集装置前连接两个相同的________装置,第一个装置中放入足量的_________ (NaHCO3溶液、NaOH溶液、石灰水)除去HCl;第二个装置中放入足量的____________ 除去水蒸气。
(4 实验室用CO和H2的混合气体还原Fe2O3,若要设计一套连续装置,检验并吸收反应后的气态产物(100℃以上),合理的操作顺序是: ,E中药品为 ,写出有关反应方程式 , ,
, ;
剩余气体不能直接排放到空气中,应采取的措施是___________________ 。
每日一练(7)
班级 姓名
1.氧化剂定义: ;发生 反应
还原剂定义: ;发生 反应
2.Mg+2H2O→Mg(OH)2+H2↑。该反应中氧化剂是……………………………………( )
A.Mg B.H2O C.Mg(OH)2 D.H2
3. 下列物质是我们常见的物质,请按有机物与无机物分类(无机物写化学式)
蔗糖,碳酸钙,酒精,碳酸钾,甲烷,纯碱,碳酸氢钙,碳酸,一氧化碳,干冰,硫酸钠
4.家庭常用物质中属于无机物的是……………………………………………( )
A.葡萄糖 B.淀粉 C.食盐 D.蔗糖
5.中国2010上海世博会的主题是“城市,让生活更美好”。
①在世博会开幕式上举行了上海有史以来最为盛大的一次焰火表演,光彩夺目的焰火离不开多种元素的焰色反应,其中钠元素的焰色呈______________色。
②世博园区内使用电动车,有效减少了CO2、SO2、CO的排放,这些物质中会引起温室效应的是_________;会造成酸雨的是________;用烧碱溶液可吸收CO2、SO2气体,写出化学方程式: , ;
能与血液里的血红蛋白结合,造成人体中毒的是_______。煤气的主要成分是 ,它燃烧时产生 , 燃烧的化学方程式 。
③世博园区内用“活性炭+超滤膜+紫外线”组合工艺获得直饮水。其中活性炭起________作用;用紫外线代替氯气对水进行处理,其作用是_________ 。
6.每年的6月5日是世界环境日,环境保护是我国的一项基本国策,空气的质量越来越受到人们的关注,下列各组气体中都属于空气污染物的是……………………………( )A、CO2、N2 B、NO2、O2 C、SO2、NO2 D、N2、NO2
7.传统的化学燃料是 , , 。
8.化石燃料是不可再生能源。开发和利用新能源迫在眉睫,下列不属于新能源的是
A、太阳能 B、煤气 C、地热能 D、潮汐能
9.同素异形体:由 。
10.下列不属于同素异形体的是………………………………………………………( )
A、O2和O3 B、水和双氧水
C、N2 和 N4 D、金刚石和石墨
每日一练(8)
班级 姓名
1.水对于人类生活、工农业生产都具有重要意义。某自来水厂生产的主要步骤为:试回答:
(1) 以上步骤中,加入 可以除去河水中较大颗粒悬浮物杂质,加入 能够消毒杀菌。
(2) 生产得到的自来水与蒸馏水的主要区别是 ;能保持水化学性质的微粒是水分子,电解水的化学方程式是 ;这一实验可以说明水是由 元素和 元素组成的。
7.大多数固体随温度升高而 ,少数物质如食盐随 ,极少数物质如 随温度 。
练习:运用溶解度表与溶解度曲线回答下列问题:
(1)B是 的溶解度曲线;
(2)P点的含义是 ;
(3)满足A的溶解度<B的溶解度的温度范围是 ;
(4) 60℃时,50g水中加入55g硝酸钾,所得溶液是 (填“饱和”或“不饱和”)溶液,溶液质量是 g
(5)若要从A的溶液中提取A最简单的方法是 。
8.温度升高气体的溶解度 ,压强增大气体的溶解度 。
(1) 常压下,CO2在水中的溶解度随温度的变化应类似于_______ 物质;(填甲或乙)
(2)为了减缓二氧化碳使全球变暖的趋势,有科学家设想:将排放到空气中的二氧化碳压缩使其液化,然后将其压入到冰冷的深海中。但也有科学家担心海水中富含二氧化碳后酸度会增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,从而造成灾难性的后果。
Ⅰ.二氧化碳气体转变为液体时发生了 变化;
Ⅱ.二氧化碳使海水酸度增加的原理用化学方程式表示为: ;
Ⅲ.二氧化碳在深海中的溶解度比在通常状况下的水中的溶解度 ,
理由是 。
每日一练(9)
班级 姓名
9.实验室制二氧化碳的发生装置采用启普发生器的优点是:________________________
;启普发生器适用范围:(a)反应物状态:_____________;(b)反应条件:___________。
①二氧化碳的收集:一般用___________法收集,原因:_________________________。
②验满:检验一瓶二氧化碳是否集满的方法:____________ 。
③检验:检验一瓶无色气体是二氧化碳的方法:__________________________________。
④用途、俗称:固体二氧化碳俗称 ,用途:用于灭火或 。
二氧化碳用于灭火的原因: , 。
⑤实验室用__________溶液来检验CO2。化学方程式为:__________________________,
反应的实验现象为:____________________。用__________溶液来吸收CO2。化学方程式为:_________________________________。
练习:通过一年的化学学习,我们知道了常见气体的实验室制取方法和相关性质,我能根据所学知识回答下列问题:
⑴实验室用氯酸钾和二氧化锰混合物制取氧气的化学方程式是 ,所选用的发生装置是 (填序号),用C装置收集氧气后,验满的方法是
图24-2
。
⑵小丽欲使用图24-2装置收集较纯净的氧气,则应先将装置中装满
水,再将气体从 (填“a”或“b”)端通入。
⑶小丽用排新制的澄清石灰水的方法收集了半瓶氧气,然后将燃着的
木炭伸入该集气瓶中继续做气体性质实验,我能观察到的现象是 ,
我能写出二氧化碳和澄清石灰水发生反应的化学方程式 。
10.久置在空气中的澄清石灰水瓶壁上会有一层白色物质,这是_______,要除去它用_______;写出有关上述现象的化学方程式:_____________________________________、_____________________________________。
11.烧碱暴露在空气中会变质,写出变质的化学方程式
练习1:下列气体能用固体氢氧化钠干燥的是…………………………………………( )
A.CO B.CO2 C. SO2 D.HCl
练习2:除去二氧化碳中的水蒸气,可选用的干燥剂是…………………………………( )
A.氢氧化钠固体 B.生石灰 C.浓硫酸 D.氧化铜
每日一练(10)
班级 姓名
12.金属活动性顺序在工农业生产和科学研究中有重要应用。请回答下列问题:
(1)完成金属活动性顺序表:
K Ca Na Mg ____ Zn Fe Sn Pb (H) Cu Hg ____ Pt Au
练习1:能与硝酸银溶液反应,但不能与稀盐酸反应的金属是…………………………( )
A.镁 B.银 C.铁 D.铜
练习2:下列不能用金属与盐酸直接反应制得的物质是…………………………………( )
A、MgCl2 B、FeCl2 C、ZnCl2 D、FeCl3
练习3:根据金属活动性顺序进行分析,下列描述或判断错误的是……………………( )
A.常温下,金属镁在空气中要比铁容易氧化
B.在氧气中灼烧时,铁丝要比铜丝反应剧烈
C.在同一盐酸中反应时,锌片比铁片反应剧烈
D.铜活动性不强,故铜不能与硝酸银溶液反应得到金属银
13.二氧化碳中混入一氧化碳,为除去一氧化碳,可将混合气体通过 。
反应方程式: 现象:
一氧化碳中混入二氧化碳,为除去二氧化碳,可将混合气体通过 。
反应方程式:
14.除去NaCl溶液中杂质Na2SO4 的试剂是 ,
化学方程式
15.除去CaO固体中杂质CaCO3 的方法是 ,方程式
16.除去CuO固体中杂质 Cu的方法是 ,方程式
练习1:通过用水溶解、过滤、蒸发操作,可将下列各组混合物分离的方法是…………( )
A.硝酸钾,氯化钾 B.氧化铜 、二氧化锰 C.氯化钠、木炭 D.氧化铜,四氧化三铁
练习2:除去二氧化碳气体中混有的少量一氧化碳,正确的方法是……………………( )
A.点燃 B.通过灼热的氧化铜 C.通过澄清的石灰水 D.通过紫色的石蕊试液
练习3:除去下列物质中的少量杂质(括号内是杂:质),所用试剂及方法均正确的是…( )
A.铜粉(碳粉)——在空气中灼烧
B.氯化亚铁溶液(氯化铜)——加过量的铁粉、过滤
C.氢氧化钠(碳酸钠)——加适量的稀盐酸、蒸发
D.一氧化碳(二氧化碳)——通过灼热的氧化铜
练习4:除去下列各物质中的少量杂质所选用的试剂及操作方法均正确的是………( )
项目
物质
杂质(少量)
试剂
操作方法
A
KNO3
MnO2
足量的水
溶解、过滤、蒸发
B
H2
水蒸气
适量的NaOH溶液
洗气
C
硝酸
盐酸
过量的硝酸银溶液
过滤
D
CaO
CaCO3
足量的水
溶解、过滤
每日一练(11)
班级 姓名
1.达菲(C16H31N2PO8) 是目前国际社会用来治疗甲型H1N1流感患者的重要药物,达菲由
种元素组成,1mol达菲中含_______mol磷元素,约为 个磷原子。
2.乙醇汽油的使用,可以缓解石油危机。所谓乙醇汽油是在汽油中加入适量乙醇混合而成的一种燃料。
(1)乙醇的化学式为__________。乙醇汽油属于______________(选填:“纯净物”或“混合物”)。
(2)从环境保护的角度看,下列燃料中最理想的是___________________(填写字母编号)。
A.氢气 B.煤 C.乙醇汽油 D.煤气(主要含CO)
3.右图是甲、乙两种固体物质的溶解度曲线,请你回答:
(1)t1℃时,甲的溶解度 (填“>”、“<”或“=”)乙的溶解度;
(2)甲、乙两种物质的溶解度受温度变化影响较大的是 ;
(3)甲中含有少量乙,要提纯甲,可采用的方法是 ;
40
(4)t2℃时,分别取等质量的甲、乙两种物质,均刚好配制
成饱和溶液(甲、乙完全溶解),所需水的质量关系
20
是甲 (填“>”、“<”或“=”)乙。
(5)t1℃时,将15g乙物质溶解在50g水中,充分溶解后,
配成饱和溶液的质量为 g。
4.海洋是一个巨大的资源宝库,我们可以从海水中提取氯化钠,并以氯化钠和冰为原料制得氢氧化钠、氢气和氯气(Cl2)。其制取的主要工艺流程如下:
(1)利用风吹日晒可以从海水中提取粗盐,该过程主要发生______________变化(选填:“物理”或“化学”)。
(2)要除去食盐水中混有少量的泥沙,你选择的操作方法是________________________________。
(3)请你写出氯化钠在生活中的一种用途__________________________________________________。
(4)氯化钠饱和溶液在通电条件下发生反应的化学方程式是:__________________________________。
每日一练(12)
班级 姓名
1. 在工农业生产和日常生活中,化学物质具有广泛的用途。请用下列物质的化学式选择填空:氦气、氮气、氧化钙、氢氧化钙、盐酸、硝酸、硫酸亚铁。
⑴可用来替代氢气作为探空气球的稀有气体是 。
⑵胃液中常含有的酸是 。
⑶可用于治疗缺铁性贫血的药物是 。
⑷为了防止某些食品受潮,在其包装袋中放入一小袋干燥剂。这种干燥剂是 。
2. 诺氟沙星胶囊主要成分是诺氟沙星(化学式为C16H18FN3O3,式量为319),适用于肠道感染、尿路感染及其它沙门菌感染。它由________种元素组成,其中1mol诺氟沙星中所含物质的量最多的原子是__________;31.9克诺氟沙星的物质的量是 mol,其中所含氮的原子个数为 。
3. 右图是甲、乙两物质的溶解度曲线:
(1)甲、乙两物质溶解度相等时的温度为 ℃。
(2)60℃时,320g甲的饱和溶液中溶质的质量为______g。
(3)60℃时,将乙的饱和溶液降温至20℃时,以下描述
正确的是 (填字母)。
A.有乙物质的晶体析出 B.乙的溶解度不变
C.乙的溶质质量分数不变 D.乙溶液为不饱和溶液
4. 水是生命之源,也是常用于配制溶液的溶剂。
(1)写出“能证明水是由H、O两元素组成”的实验的化学方程式是: ;
(2)供城市生活用水的自来水厂净水流程如图所示:
在净水流程中有一个活性炭池,它最主要的作用是 ,投的药一般是液氯其目的是 。[来源:Zxxk.Com]
每日一练(13)
班级 姓名
1. 使用电子天平的步骤是接通电源,先 ,(归零,去皮),然后放一张洁净的 ,潮湿或有腐蚀性的药品放在 中称量,再
,(归零,去皮)。此时若在烧杯中放入药品大理石,待数据不再变化时记下的读数就是 的质量。
2. 下列实验操作,能达到预期目的是( )
A.用10mL水和10mL酒精配制成20mL酒精溶液 B.用NaOH溶液除去CO2中的HCl气体
C.用托盘天平称取3.27 gNaCl固体 D.用电子天平称取3.272 gNaCl固体
3. 现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取34 g该溶液于分液漏斗A中,锥形瓶B中加入一定量的二氧化锰。不同时间电子天平的读数如下表所示(不考虑H2O逸出):
反应时间/min
0
1
2
3
4
5
6
装置 + 过氧化氢溶液
+ 二氧化锰/g
335.70
333.78
332.64
332.58
332.50
332.50
332.50
请根据要求回答下列问题:
① 发生反应的化学方程式为 ;
② 生成氧气的物质的量为 mol;
③ 根据上述氧气的量计算分解过氧化氢的物质的量
(根据化学方程式列式计算)
② 瓶内过氧化氢溶液中溶质的质量分数为 。
(写出计算过程)
4:“黄铜”是铜锌合金,具有较高机械性能,比纯铜耐腐蚀。现取20.0 g某种黄铜投入l00 g某浓度的稀硫酸中,完全反应后得到氢气0.1mol。请计算:
① 该黄铜含锌的物质的量是 mol(根据化学方程式列式计算)。
② 剩余溶液的质量 g (写出计算过程)。
5:今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯①
烧杯②
烧杯③
烧杯④
烧杯⑤
加入样品的质量/g
10
10
10
10
10
加入稀盐酸的质量/g
10
20
30
40
50
充分反应后生成气体的质量/g
0.88
1.76
X
3.52
3.52
(1)表中X的值为 ; (2)求样品中碳酸钙的质量分数;(3)烧杯④中物质充分反应后所得溶液的质量为 g。
每日一练(14)
班级 姓名
H-1 Cl-35.5 Na-23 O-16
1.木炭具有 和 的化学性质;用 溶液吸收二氧化碳气体;检验一瓶液体是氢氧化钙溶液可通入 ____________________气体。
2.利用下图装置可进行气体性质的探究实验。甲的玻璃管中盛放黑色粉末(CuO或C),乙的洗气瓶中盛放无色溶液(澄清石灰水或NaOH溶液)。
实验
甲
乙
实验一
探究CO与CuO的反应。
反应的化学方程式:
_______________________________
氧化剂:_______________________
澄清石灰水的作用:
_________________________
实验二
探究CO2与C的反应。
(b换成酒精喷灯)
反应的化学方程式:
_______________________________
反应类型:_____________________
NaOH溶液的作用:
_________________________
上述两实验中,在导管c的尖嘴处都用火柴点燃,其目的是否完全相同?简述理由。
__________________________________________________________________________
3.某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。 (1)配制200g质量分数为8%的氢氧化钠溶液。
①计算:需要氢氧化钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。
②称量:电子天平接通电源,先 ,(归零,去皮),然后放一张洁净的 ,放上烧杯,再 ,(归零,去皮)。 将氢氧化钠固体加入烧杯中,待数据稳定时记下的读数就是 的质量。该步骤中用烧杯而不用称量纸的原因是 。
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。请你填写好标签。
(2)右图表示用上述配制的氢氧化钠溶液与20 g某
稀盐酸发生反应后溶液温度的变化情况。
①根据曲线判断,当加入氢氧化钠溶液的
质量为 时,反应恰好完全进行。
②当加入15 g氢氧化钠溶液时,所得溶液中的溶质为
(写化学式)。
③试计算该稀盐酸中溶质的质量分数(请写出计算过程)
每日一练(15)
班级 姓名
1.烟花爆竹的主要成分是黑火药,其化学组成为硝酸钾、硫磺和木炭等。
(1)黑火药中至少有_______ 种元素,欲分离出硝酸钾,可进行______、过滤、蒸发结晶等操作。
(2)黑火药的一般配方是:硫磺2 g、硝酸钾3 g、炭粉4. 5 g。已知黑火药在空气中燃爆时可
发生:S + 2KNO3 + 3C →K2S + 3CO2↑+ N2↑,则S、KNO3、C完全反应时的质量比为_______,该配方中C和_____ (填化学式)明显过量。燃放烟花爆竹产生SO2的反应方程式是_________ 。
(3)SO2气体在空气中经粉尘催化氧化为SO3 , SO3与水反应,形成硫酸型酸雨,写出有关
反应的化学方程式:___________ ___ ,____________ _______ 。
(4)很多城市出台“禁放”规定杜绝此类污染,以下解决“现代文明”与“传统文化”冲突的做法可行的是_______。(填字母)
A.提倡电子鞭炮 B.开发绿色鞭炮 C.关停鞭炮企业
2.气体的实验室制取是初中非常重要的一组实验,结合下列实验装置图回答有关问题:
(1)仪器a的名称是 。
(2)在初中可同时用来制取O2、CO2和H2的发生装置是 (填字母)。
(3)写出实验室用KClO3制氧气的化学方程式 。
(4)用KClO3制氧气需加MnO2作催化剂。若在KClO3中加少量的KMnO4,也能加快KClO3的分解。用文字说明其原因
。
(5)实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸反应来制取SO2。
已知:SO2是一种没有颜色而有刺激性气味的有毒气体,易溶于水,密度比空气大,常温下在空气中不反应。
①制取SO2的化学方程式为 。
②制取SO2的收集装置为 (填字母)。
③在收集SO2,为了避免SO2对环境的污染,对SO2的收集装置作了改进(见下图),请你把集气瓶内的导管补充完整(图中“→”表示气体流向)。
3. 我爱化学,化学使我们的生活变得绚丽多彩!前几天家里的花叶子有些发黄,妈妈给花施加了一些碳酸氢铵(NH4HCO3),今天我惊喜地发现花叶子变得浓绿。我知道碳酸氢铵是一种_____(填“磷肥”、“氮肥”或“复合肥”)。
爸爸给家里换了一台节能天然气热水器,天然气的主要成分甲烷燃烧的化学方程式为___________________________________,该反应将化学能转化为______能。我在学习炒菜时,不小心油锅着火了,我迅速用锅盖盖灭,该灭火的原理是___________ 。
每日一练(16)
班级 姓名
1. 下图是一些常见物质的转化关系,其中C是无色无刺激性的气体,且能使澄清石灰水变浑浊;
E是一种元污染的清洁能源,其燃烧产物是H。
(1) 红棕色粉末A和气体C、E的化学式
分别为:A 、C 、E: 。[来源:学.科.网]
(2)G转化为H和A的反应类型是 反应;
B转化成E和D的反应类型是 反应。
(3)①A与盐酸反应的化学方程式为:
;
②D和氯气化合生成F的化学方程式为: 。
(4)以上图中无色气体C为中心,延展如下图:
固体J
CO
高温 化合
无色
气体
C
溶液K
CaCO3
沉 淀
①请写出实现这两个转化的另一反应物J、K的化学式:J 、K 。
②请完善由CO和CaCO3分别转变成无色气体C的转化关系图,在箭号上注明必要的反应条件和其它反应物。
CO
无色
气体
C
CaCO3
沉 淀
2.氯气(Cl2)是黄绿色气体,水溶液叫氯水。把品红试纸(染有品红的纸)伸入氯水中,品红褪色。
【发现问题】 氯水中的哪些成分能使品红褪色呢?
【查阅资料】 氯气溶于水,部分与水反应,方程式为Cl2 + H2O → HCl + HClO。
其中,HClO的名称叫次氯酸,是一种弱酸,具有强氧化性。
【猜 想】
猜想1:是氯水中的水使品红褪色的; 猜想2:是氯水中的 (填化学式)使品红褪色的;
猜想3:是氯水中的盐酸使品红褪色的; 猜想1:是氯水中的次氯酸使品红褪色的。
【实验探究】
实验操作
实验现象
过程分析
①把品红试纸伸入水中
没有褪色
猜想1不成立
②把品红试纸伸入干燥的氯气中
没有褪色
猜想2不成立
③
没有褪色
猜想3不成立
【结 论】
综合分析:氯水中的 (填化学式)使品红褪色,具有漂白作用(能使品红等有色物质褪色)。
【反 思】
(1)HClO中氯元素的化合价为 价。
(2)氯水中加入AgNO3溶液有白色沉淀生成,化学方程式为 。
(3)向氯水中滴加紫色石蕊试液,观察到的现象是 。
每日一练(17)
班级 姓名
1.20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四只各盛有50 g水的烧杯中,充分溶解后的情况如下表:
物质
甲
乙
丙
丁
未溶解固体的质量 /g
4.2
2[来源:Z_xx_k.Com]
0
9.2
下列说法正确的是
A.所得溶液一定都是饱和溶液
B.丁溶液中溶质质量分数一定最大
C.20 ℃时物质溶解度的关系为:丁>甲>乙>丙
D.所得溶液的质量关系为:丙>乙>甲>丁
2. 已知①中盛有一定量的碳酸钠溶液, 根据下图所示的实验过程,下列说法正确的是
A. ②中溶液为无色
B. ③中溶液的溶质组成有2种情况
C. 加入过量稀盐酸后,③中只观察到沉淀消失,产生大量气泡
D. ④中溶液的溶质除酚酞外,还有3种
5 g
42 mL
3.用下图操作可完成甲、乙两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为16%的氯化钠溶液。下列说法中,正确的是
① ② ③ ④ ⑤
A.甲实验的步骤是①④⑤,其中去除杂质的关键一步是蒸发
B.甲实验各步操作中的玻璃棒都是用来搅拌的
C.乙实验按照②③①的步骤进行操作, 会导致配制的溶液浓度偏小
D.乙实验中,若①所用烧杯刚刚用清水洗过,会导致配制的溶液浓度偏大
4.向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。下列说法正确的是①②③④⑤
资料:A的溶解度
温度/℃
20
30
40
50
60
溶解度/g
37.2
41.4
45.8
50.4
55.2
A.②中A的质量分数最大
B.③⑤中A的质量分数相等
C.②④⑤的溶液为饱和溶液
D.①③④⑤中没有固体存在
每日一练(18)
班级 姓名
1.下列是分析放置在空气中的NaOH固体的相关实验,其中合理的是
序号
实验目的
实验方案
①
证明变质
取少量固体,加水溶解,滴加足量稀盐酸,观察是否有气泡产生
②
确定成分
取少量固体,加入石灰水,过滤,向滤液中滴加酚酞溶液
③
测定纯度
取少量固体,加入足量稀盐酸,用排水法收集VmL气体
④
除去杂质
取固体,加水溶解,滴加石灰水至恰好完全反应,过滤
A.②③ B.①③ C.②④ D.①④
2.如右图所示,瓶中X为固体,把滴管内的液体Y滴入瓶中,插入水中的导管口一定没有气泡冒出的是
A
B
C
D
X
Zn
NaCl
CaO
NaOH
Y
H2SO4
H2O
H2O
H2O
3.同学在实验室发现了一瓶标签残缺的无色液体(右图),想通过探究确定其成分,以便重新利用。
【初步分析】操作不规范可能造成标签破损,能造成标签破损的不当操作有 (写一点)。
根据受损标签的情况判断,这瓶试剂不可能是 (填字母代号)。
A.酸 B.碱 C.盐
【查阅资料】初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。有关四种物质的信息如下:
物质
NaCl
NaOH
Na2CO3
NaHCO3
20oC溶解度g/100g水
36
109
21.5
9.6
水溶液的pH
7
14
11
9
【实验探究】为确定该溶液的成分,小芳设计了如图乙所示的实验过程:
②
稀盐酸
①
石蕊试液
图乙 图丙
(1)实验①观察到紫色石蕊试液变蓝,由此得出结论是 。
(2)实验②观察到有气泡产生,还有可能观察到的现象是 。
【得出结论】通过以上活动,小刚认为不能确定瓶中试剂的成分,小芳认为可以,小芳的理由是 。
【拓展应用】通过以上探究活动,小组同学联想到二氧化碳与氢氧化钠的反应,设计了如图丙所示实验,观察到的现象是 。
每日一练(19)
班级 姓名
1. 向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量。
某同学依据实验事实绘制了如图所示的曲线。
下列说法正确的是
A.a至b段对应溶液的pH逐渐减小 B.b点对应溶液中的溶质为硫酸钠
C.c点对应溶液中的溶质种类最少 D.a至d段硫酸钠的质量逐渐增大
2.实验小组对久置生石灰的成分进行分析,实验操作及部分现象如下图所示。
(1)样品加水放热的原因是______________________________________________(用化学方程式表示)。
(2)②中反应的化学方程式是________________________________________________________________。
(3)③中的实验现象是______________________________________________________________________。
(4)将混合物B、C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣。向滤液E中滴加CaCl2溶液,有白色沉淀生成,则滤液E中的溶质可能是______。
依据实验现象及数据判断,原样品的成分是________________________________________________。
3、某兴趣小组用右图装置(碱石灰是氧化钙和固体氢氧化钠的混合物,极易吸收水蒸汽,经常用作干燥剂),测定过氧化氢溶液中溶质的质量分数。测得相关数据如下:整套装置16克。
(1)双氧水样品中加入二氧化锰,二氧化锰起 作用,反应生成氧气的物质的量为 。
(2)计算该过氧化氢溶液中溶质的质量分数。(写出计算过程)
(3)实验装置中锥形瓶上加接盛有碱石灰的干燥管作用是_________________________。如果实验装置中不接盛有碱石灰的干燥管,测得的过氧化氢溶液溶质的质量分数会偏大,原因是 。
每日一练(20)
班级 姓名
1、一包黑色粉末可能由氧化铜、炭粉中的一种或两种组成为探究其组成,某化学兴趣小组的学生进行实验研究。学生掌握的知识:
碳粉具有可燃性:在氧气中能燃烧,该反应的化学方程式__________________________,能观察到的现象是__________________________________________。
碳粉具有还原性:能与氧化铜反应,该反应的化学方程式__________________________。
[提出假设] ①黑色粉末可能是氧化铜②黑色粉末可能是木炭粉 ③黑色粉末可能是______________。
[设计实验]
同学甲:将干燥的CO与A中的黑色粉末反应,并检验其产物。在给黑色固体加热前,应先通入CO,目的是 。装置中的气球起___________________作用。若黑色粉末变红色,同学甲推断黑色粉末一定含有氧化铜,可能含有碳粉。
同学乙:关闭弹簧夹X,给排尽空气后的盛有黑色粉末的硬质玻璃管加热。一段时间后,若黑色粉末不变色,澄清石灰水也不变浑浊,请你帮助同学乙推断黑色粉末_______________。
同学丙:取少量粉末于试管中,再加入过量盐酸试剂,发现固体全部溶解,溶液呈蓝色。同学丙推断黑色粉末一定只含有氧化铜。该实验的化学反应方程式是____________________________________________。
2、实验室用98%的浓硫酸配制成稀硫酸,并与锌粒反应制取氢气。
(1)查阅资料。20℃时不同质量分数硫酸的密度(g/mL)
质量分数
0%
(纯水)
1%
4%
10%
16%
24%
32%
36%
44%
49%
60%
98%
密度
1.00
1.01
1.02
1.07
1.11
1.17
1.24
1.27
1.34
1.39
1.50
1.84
分析以上数据,可得出结论:(写2条)
① ;
② ;
(2)计算。配制200g24.5%的稀硫酸需 g 98%的浓硫酸和 g水。
实际操作时,取98%的浓硫酸 mL(精确到1mL)。
(3)配制稀硫酸。
分别用量筒量取所需水和浓硫酸,先将 倒入烧杯中,然后 。