- 276.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
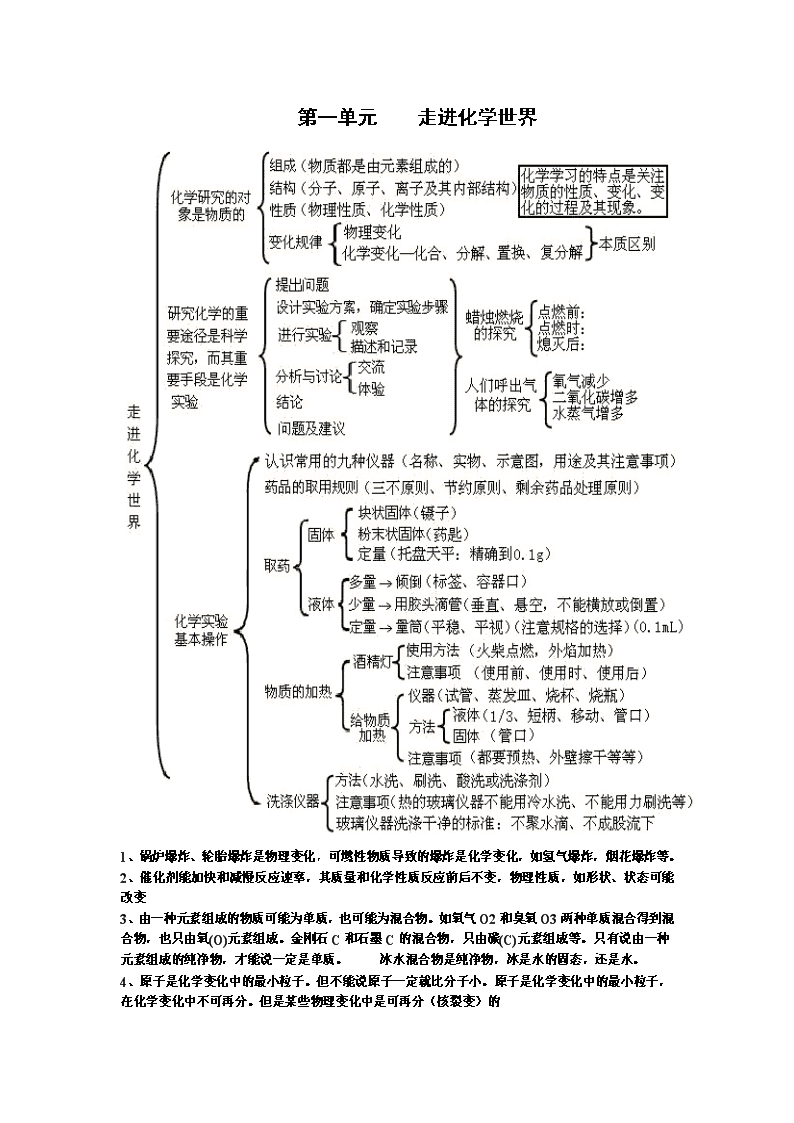
第一单元 走进化学世界
1、锅炉爆炸、轮胎爆炸是物理变化,可燃性物质导致的爆炸是化学变化,如氢气爆炸,烟花爆炸等。
2、催化剂能加快和减慢反应速率,其质量和化学性质反应前后不变,物理性质,如形状、状态可能改变
3、由一种元素组成的物质可能为单质,也可能为混合物。如氧气O2和臭氧O3两种单质混合得到混合物,也只由氧(O)元素组成。金刚石C和石墨C的混合物,只由碳(C)元素组成等。只有说由一种元素组成的纯净物,才能说一定是单质。 冰水混合物是纯净物,冰是水的固态,还是水。
4、原子是化学变化中的最小粒子。但不能说原子一定就比分子小。原子是化学变化中的最小粒子,在化学变化中不可再分。但是某些物理变化中是可再分(核裂变)的
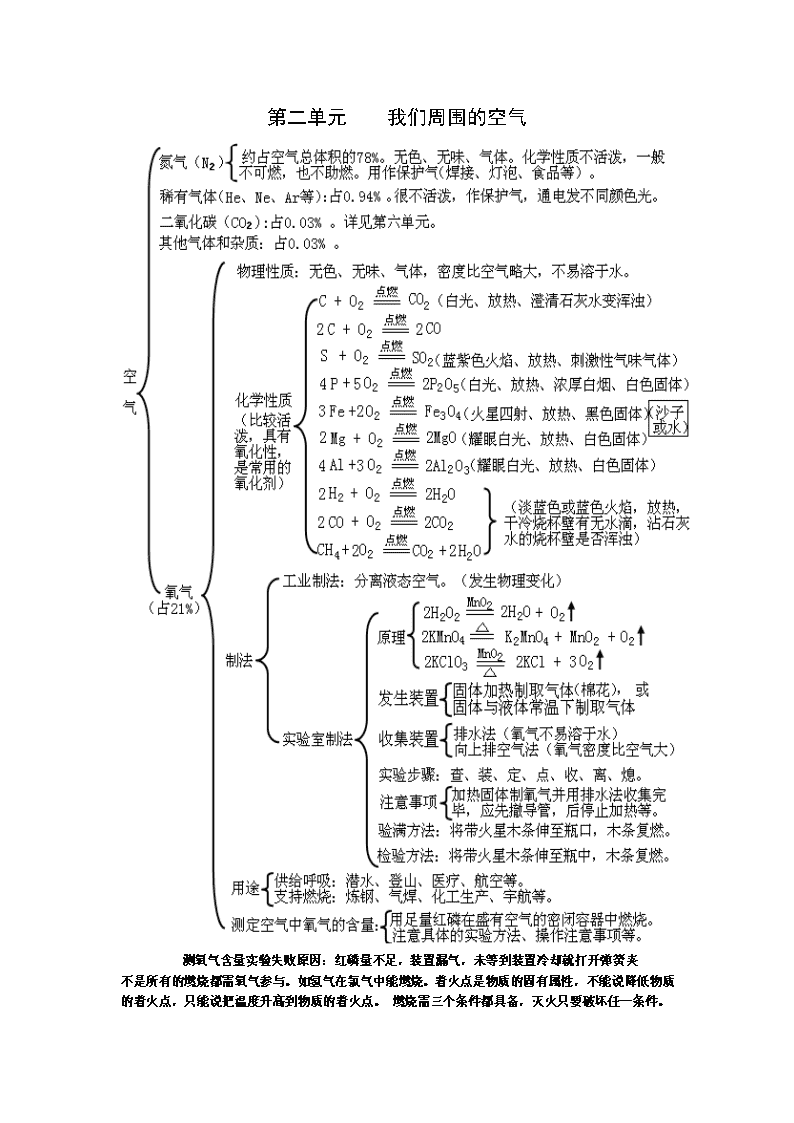
第二单元 我们周围的空气
测氧气含量实验失败原因:红磷量不足,装置漏气,未等到装置冷却就打开弹簧夹
不是所有的燃烧都需氧气参与。如氢气在氯气中能燃烧。着火点是物质的固有属性,不能说降低物质的着火点,只能说把温度升高到物质的着火点。 燃烧需三个条件都具备,灭火只要破坏任一条件。
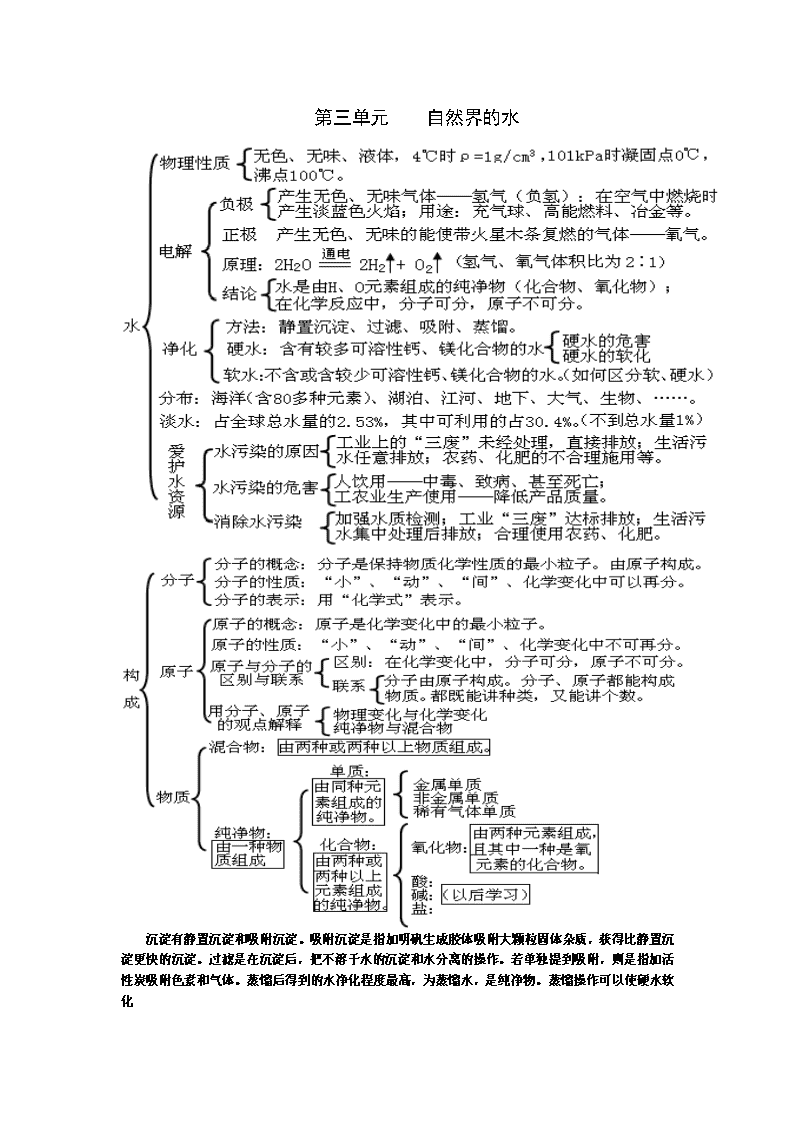
第三单元 自然界的水
沉淀有静置沉淀和吸附沉淀。吸附沉淀是指加明矾生成胶体吸附大颗粒固体杂质,获得比静置沉淀更快的沉淀。过滤是在沉淀后,把不溶于水的沉淀和水分离的操作。若单独提到吸附,则是指加活性炭吸附色素和气体。蒸馏后得到的水净化程度最高,为蒸馏水,是纯净物。蒸馏操作可以使硬水软化
第四单元 物质构成的奥秘
原子团的记忆找诀窍:如碳酸根CO3,就是二氧化碳CO2多1个O。硫酸根SO4,是三氧化硫SO3多1个O。硝酸根NO3,是二氧化氮NO2多1个O。铵根NH4,是氨气NH3多1个O.
第五单元 化学方程式
1、如点燃A克氧气和B克氢气的混合气体,生成水的质量是小于或等于(A+B)克。氧气和氢气要么恰好按质量比完全反应,都不剩余,则生成水质量等于(A+B)克。要么,氢气过量剩余或者氧气过量剩余,有一种没有全部反应,则生成水质量小于(A+B)克。但氢气和氧气不可能都有剩余,因为如果都有剩余,则会继续反应。
2、任何化学反应符合质量守恒定律。即便实验数值不相等,是因为有气体参加反应或生成气体逸出。
第六单元 碳和碳的氧化物
二氧化碳气体通到紫色石蕊溶液中,溶液变红,是因为二氧化碳与水反应生成了碳酸。不用燃着木条熄灭来检验二氧化碳,用澄清石灰水。因为使木条熄灭的还有氮气、稀有气体等,但可以验满。
第七单元 燃料及其利用
第八单元 金属和金属材料
第九单元 溶液
1、定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
2、组成
溶质(一种或几种)(固、液、气)
溶剂(一种)(若是液体,一般为水)
溶液
3、性质
均一性:(各处的性质相同,浓度一样)
稳定性:(只要温度、溶剂量不变,就不会析出固体)
吸热(如NH4NO3)
4、溶解时的热现象 温度不变(如NaCl)
放热(如NaOH、浓硫酸)
5、分类:饱和溶液与不饱和溶液
定义:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得溶液叫饱和溶液,还能继续溶解的溶液,叫做不饱和溶液。
①增加溶质 ②降温 ③恒温蒸发溶剂
①增加溶剂 ②升温
转化措施:不饱和溶液 饱和溶液
定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
影响因素
内因:溶质、溶剂的性质
1、固体溶解度 温度升高,一般溶解度增大
外因:温度 温度升高,溶解度变化不大(如NaCl)
溶解度(S)
温度升高,溶解度降低(如熟石灰)
读出某温度下的溶解度(读出某溶解度下的温度)
溶解度
曲线
比较(某温度)下不同物质的溶解度
交点意义:表示该温度下两物质的溶解度相同
物质提纯
溶解度受温度影响大:用降温结晶的方法
溶解度受温度影响小:用蒸发溶剂的方法
2、气体溶解度:影响因素: 温度(温度升高,溶解度降低,反之)
压强(压强升高,溶解度增大,反之)
溶质质量
溶质质量分数
溶液质量
1、定义:C% = ------------------- × 100%
溶质质量分数
实验步骤:计算→称量、量取→溶解
偏高:
2、计算
溶液的配制 仪器:
偏低:
影响实验结果的原因
溶液的稀释(A×a% = B×b%)
溶质质量分数应用到化学方程式的计算(与不纯物质的计算类似)
“相同温度” 下的某种溶质,饱和溶液比不饱和溶液的质量分数要大一些。但必须同温下才可比较。
第十单元 酸和碱
物理
(性质)
盐酸:刺激性气味,挥发性
酸
(H+ + 酸根离子)
盐酸(HCl)
硫酸(H2SO4)
硫酸:吸水性(作干燥剂),脱水性,溶解放热(稀释“硫入水”)
①使指示剂变色
紫色石蕊:变红
无色酚酞:不变色
化学
(性质)
②与金属(活泼金属)反应:酸 + 活泼金属 === 盐 + H2↑
③与金属氧化物(如Fe2O3、CuO)反应:H + O == + H2O
④与碱反应:H + OH === + H2O(中和反应)
⑤与盐(如碳酸盐)反应:H + CO3 == + H2O+CO2↑
腐蚀性:
用途:除铁锈。胃液中含盐酸HCl帮助消化。化工产品。
俗称
NaOH:火碱、烧碱、苛性钠
Ca(OH)2:熟石灰、消石灰
碱
(金属离子 + OH-)
氢氧化钠(NaOH)
氢氧化钙[Ca(OH)2]
物理
(性质)
氢氧化钠:吸水性(易潮解,作干燥剂),易溶于水
氢氧化钙:无吸水性[但生石灰有吸水性CaO+H2O===Ca(OH)2]
①使指示剂变色
紫色石蕊:变蓝
无色酚酞:变红
②化学
(性质)
与非金属氧化物反应:(如CO2、SO2、SO3)(都生成H2O)
③与酸反应:H + OH === + H2O(中和反应)
④与盐反应:[如Ca(OH)2+Na2CO3 === CaCO3↓+ 2NaOH]
腐蚀性:
用途:NaOH制造肥皂,Ca(OH)2 中和酸性土壤,(检验铵盐。)
酸性[酸溶液、一些盐溶液(如AlCl3溶液)]:pH<7
与溶液酸碱性的关系 碱性[碱溶液、一些盐溶液(如Na2CO3溶液)]:pH>7
pH值
中性[蒸馏水、一些盐溶液(如NaCl溶液)]:PH=7
与溶液酸碱度的关系
酸性越强:pH值越小
碱性越强:pH值越大
1、铁的化合价+2、+3价。置换反应生成+2价亚铁化合物。复分解反应中化合价不变,为+3价
Fe+2HCl==FeCl2+H2 ↑ Fe2O3+6HCl==2FeCl3+3H2O
2、金属与酸反应生成氢气,一般是稀盐酸和稀硫酸,浓硫酸和硝酸不行。
3、判断溶液中酸和碱是否完全反应,只要检验出反应后溶液的酸碱性即可。可加石蕊溶液、活泼金属、碳酸盐等。(如果是酸性溶液,则加活泼金属产生氢气,加碳酸盐产生二氧化碳,有气泡)
4、只要溶液显碱性或酸性,就能使指示剂变色,不一定要酸和碱。如:碳酸钠Na2CO3
.俗称纯碱、苏打,不是碱,是碳酸盐,但是溶液显碱性,也会使指示剂变色。还有碳酸钾也显碱性。
第十一单元 盐与化肥
俗称:食盐
物性:溶解度随温度变化改变小。
氯化钠
(NaCl)
用途:调味品,生理盐水
步骤:溶解→过滤→蒸发→计算产率
仪器:
溶解时:搅拌,加速溶解
粗盐提纯 玻璃棒用途 过滤时:引流
蒸发时:搅拌,防止液滴飞溅
产率偏差 偏高:①过滤不干净;②水没有蒸干。
偏低:①过滤时无润洗烧杯和玻璃棒②过滤或蒸发时液滴飞溅③转移固体不完全。
盐
(金属离子或NH4+
和酸根离子)
包括:碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、碳酸钙(CaCO3)
碳酸盐
俗称:纯碱或苏打 、小苏打 、(石灰石或大理石主要成分)
用途:Na2CO3洗涤剂,NaHCO3发酵粉和治疗胃酸过多,CaCO3建
筑材料,实验室制CO2,作补钙剂。
检验方法:(加稀盐酸有气泡,用澄清石灰水检验产物CO2)
化学性质
①与金属反应:(如:Fe + CuSO4 === Cu + FeSO4)
②与酸反应:(如:AgNO3 + HCl === AgCl↓+ HNO3)
③与碱反应:(如:Ca(OH)2+Na2CO3 === CaCO3↓+ 2NaOH)
④与某些盐反应:(如:Na2SO4 + BaCl2 === 2NaCl + BaSO4↓)
通式:AB + CD === AD + CB
复分解反应 条件:有H2O或↑或↓生成(酸、碱、盐的溶解性表P109)
应用:(物质共存、除杂质、鉴别)
分类:氮肥、磷肥、钾肥、复合肥
各种化肥的作用:氮肥(叶)、磷肥(果实)、钾肥(茎,抗倒伏)
化肥
氮肥
鉴别 磷肥 (①看外观或溶解→②加熟石灰研磨,有刺激性气味是铵盐)
钾肥
使用化肥的利与弊 利:提高农作物的产量
弊:污染大气、污染土壤、污染水源、土壤退化
1、石灰石主要成分是CaCO3、石灰水主要成分是Ca(OH)2、生石灰主要成分是CaO。
2、除去CO2气体可选用NaOH溶液,而检验CO2气体时选用Ca(OH)2溶液。
3、铵态氮肥与碱性物质混合后有刺激性气味。NH4++OH-==NH3↑+H2O
第十二单元 化学与生活
种类(六种):蛋白质、糖类、油脂、维生素、无机盐、水
食物来源:肉类 、大米 、动植物油、蔬菜或水果
营养素
提供能量:糖类(主要)、油脂(备用)、蛋白质
功能
血红蛋白:含铁元素
酶:(高效催化剂)
维生素A、C(缺乏A夜盲症,缺乏C坏血病)
人体元素
常量元素(>0.01%):O、C、H、N、Ca、P、K、S、Na、Cl、Mg
微量元素(<0.01%):Fe、Zn、I、F、Se
缺乏元素对人的影响:Ca、Fe、Zn、I、F、Se
区分
有机物:含C元素(CO、CO2、CaCO3除外)[最简单的有机物:CH4]
无机物:不含C元素
区分
有机小分子化合物:
有机高分子化合物:
区分
天然有机高分子材料:(棉花、羊毛、天然橡胶)
有机物
合成有机高分子材料:(塑料、合成纤维、合成橡胶)即有机合成材料
鉴别
热塑性塑料:
热固性塑料:
棉纤维:烧纸的气味
鉴别
(燃烧)
羊毛纤维:烧羽毛的气味
合成纤维(涤纶或锦纶):有特殊气味
白色污染
产生物质:废弃塑料
解决措施(4个): 1、少用塑料制品 2、回收废弃塑料 3、使用可降解塑料 4、重复使用某些塑料
有机物是含碳元素的化合物,但含碳元素的化合物不一定是有机物。如CO、CO2、H2CO3、含CO32-、HCO3-的化合物,组成和性质和无机物相似,所以归为无机物一类。有机物一定是化合物,所以碳单质不是有机物。