- 434.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
综合实验题测试卷
1.(10分)根据下列装置图,回答有关问题:
(1)写出装置图中标号仪器的名称:①_____________;②_____________。
(2)写出实验室用大理石和稀盐酸制取二氧化碳的化学方程式:_____________。
并据此选择上图中_____________ (填字母)组装一套制取干燥二氧化碳的装置。
(3)如选用装置A作为制取氧气的发生装置,其化学方程式可以为__________________________。
2.(12分)在做盐跟盐反应的分组实验时,第一组学生进行BaCl2与Na2CO3溶液的反应,第二组学生进行BaCl2与Na2SO4溶液的反应。
实验结束后,两组同学将全部的浊液集中倒进一个废液缸中。浊液中白色沉淀物质是
_________ 和_________。
化学兴趣小组对浊液进行过滤,探究滤液的成分。
【提出问题】滤液里除了NaCl外,还有什么物质?
【提出猜想】猜想①:_________;
猜想②:Na2SO4;
猜想③:Na2CO3;
猜想④:Na2CO3、Na2SO4
【实验探究】
若现象a只有白色沉淀,则猜想_________成立;若现象a只有气泡产生,则猜想_____________可能成立;若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,并产生气泡,则猜想_________成立,若沉淀全部不溶解,则猜想_________成立。
3.(12分)某兴趣小组对固体酒精充分燃烧后残留的白色固体的成分进行如下探究。
。【查阅资料】
(1)醋酸钙[Ca(Ac)2],不可燃,不助燃,易溶于水,溶于水时温度无显著变化;
(2)醋酸钙受热分解生成碳酸钙和有特殊气味的丙酮;
【猜想与假设】
假设l:白色固体中含有Ca(Ac)2
假设2:白色固体中含有CaCO3
假设3:白色固体中含有CaO
假设4:白色固体中含有Ca(OH)2
【实验探究】
实验①:取少量白色固体溶于足量蒸馏水中,过滤,得到溶液和白色不溶物;
实验②:取①中滤液于试管中,滴入2滴酚酞试液,溶液变为红色;
实验③:取①中滤液于试管中,滴加碳酸钠溶液,有白色沉淀生成。
【交流讨论】
(1)根据实验①,甲同学认为假设2成立,理由是:_____________;
(2)根据实验②,乙同学认为假设4成立,丙同学认为假设4不一定成立,但假设3成
立,因为丙同学在实验①中还发现:__________________;
(3)仅根据实验③,丁同学认为假设3或假设4成立,但戍同学反对,理由是:__________________ ;
(4)欲确认假设1成立,还需进行如下实验:
实验步骤
实验现象
实验结论
_________
_________
假设l成立
4.(14分)已知某混合金属粉末除铝外还含有铁、铜中的一种或两种,所含金属的量都
在5%以上。请设计实验探究该粉末中铁、铜的存在。
资料在线:铝和氢氧化钠溶液反应后生成溶于水的偏铝酸钠和氢气(2Al+2H2O+
2NaOH=2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应。
可供选择的实验用品:烧杯、大试管、量筒、药匙、磁铁、稀盐酸、稀硫酸、氢氧化钠溶液。
请你参与并完成以下实验探究过程:
(1)提出假设:
假设l:该混合金属粉末中除铝外还含有Fe
假设2:该混合金属粉末中除铝外还含有_________;
假设3:该混合金属粉末中除铝外还含有Fe、Cu。
(2)设计并实施实验方案
基于假设l,不用化学性质,证明金属铁的存在的方法是_________。
基于假设2,该混合金属粉末加入足量稀盐酸,你观察到的现象是__________________。
反应的化学方程式是____________________________________。
基于假设3,请你完成实验操作,描述实验现象。
实验步骤
实验操作
实验现象
结论
①
_________
________
仅除去铝
②
将大试管静止弃去上层清液,再加入过量_________
________
证明含有
铁
③
将大试管静止弃去上层清液,加水洗涤剩余固体
剩余固体
呈紫红色
证明含有
铜
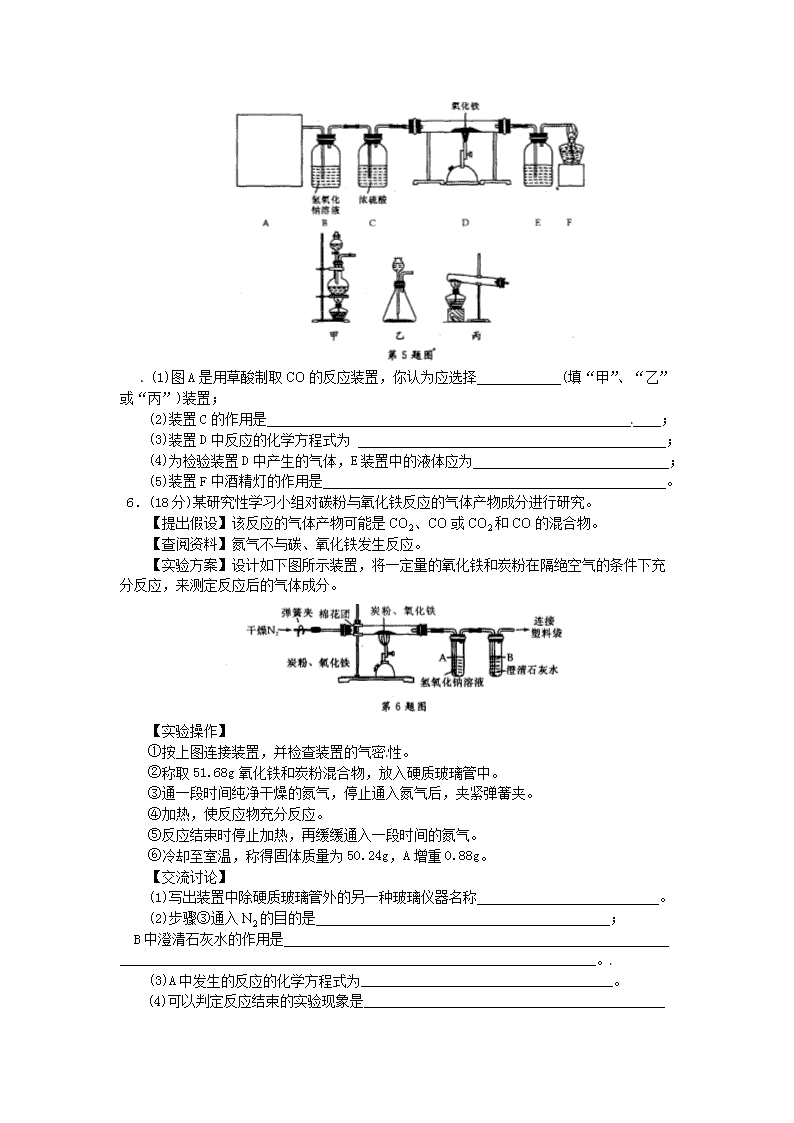
5.(14分)小明同学想研究一氧化碳的还原性,通过查阅资料知道:草酸(H2C2O4)与浓
硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4CO↑十+CO2↑十H2O
于是他设计了下图的实验装置,结合装置回答下列问题:
(1)图A是用草酸制取CO的反应装置,你认为应选择____________(填“甲”、“乙”
或“丙”)装置;
(2)装置C的作用是________________________________________________________;
(3)装置D中反应的化学方程式为 ____________________________________________;
(4)为检验装置D中产生的气体,E装置中的液体应为____________________________;
(5)装置F中酒精灯的作用是_________________________________________________。
6.(18分)某研究性学习小组对碳粉与氧化铁反应的气体产物成分进行研究。
【提出假设】该反应的气体产物可能是CO2、CO或CO2和CO的混合物。
【查阅资料】氮气不与碳、氧化铁发生反应。
【实验方案】设计如下图所示装置,将一定量的氧化铁和炭粉在隔绝空气的条件下充
分反应,来测定反应后的气体成分。
【实验操作】
①按上图连接装置,并检查装置的气密性。
②称取51.68g氧化铁和炭粉混合物,放入硬质玻璃管中。
③通一段时间纯净干燥的氮气,停止通入氮气后,夹紧弹簧夹。
④加热,使反应物充分反应。
⑤反应结束时停止加热,再缓缓通入一段时间的氮气。
⑥冷却至室温,称得固体质量为50.24g,A增重0.88g。
【交流讨论】
(1)写出装置中除硬质玻璃管外的另一种玻璃仪器名称__________________________。
(2)步骤③通入N2的目的是__________________________________________;
B中澄清石灰水的作用是_______________________________________________________
____________________________________________________________________。
(3)A中发生的反应的化学方程式为____________________________________。
(4)可以判定反应结束的实验现象是___________________________________________
________________________________________________________________________.
(5)通过实验分析,该反应的气体产物是____________________________________,
其依据是__________________________________________________________________。
(6)检验反应后的固体中炭粉是否有剩余的实验步骤是:①取少量反应后的固体样品放
入小烧杯;②向其中加入足量的________________________;③观察到________________________ ;④固体中含有剩余的炭粉。
7.(20分)对实验室制取C02反应后滤液的相关探究
(1)块状石灰石和适量稀盐酸反应至气泡逸出不明显后,过滤,测得滤液的pH=2。则
滤液呈____________性,滤液中所含的主要离子有________________________。
(2)因后续实验需要,现要配制质量分数为26.5%的碳酸钠溶液200g。
①计算:需要碳酸钠固体的质量为____________g;水台勺体积为____________mL
(水的密度近似看作1g/cm3)
②称量:调节托盘天平平衡后,将____________放在托盘天平的左盘,称量其质量。
然后在右盘添加____________。最后加碳酸钠固体,直至天平平衡。
③溶解:用量筒量取所需的水,倒入装有碳酸钠固体的烧杯里,用玻璃棒____________,
使其溶解,并冷却至室温。
④存储:把配好的溶液装入试剂瓶,塞好橡皮塞并____________ ,放到指定的地方。
(3)取50g滤液,逐滴滴入上述配制的碳酸钠溶液,并用pH数字探测仪连续监测,得曲
线如下[pH为纵坐标,时间s(秒)为横坐标]:
①写出AB段内有关化学方程式______________________________________________,
_________________________________________________________________________。
②写出BC“平台”段现象__________________________________________________。
③CD段上升的原因是:______________________________________________________。
(4)根据上述实验测得的另一组数据绘制出下图(纵坐标m是实验得到的沉淀或气体
的质量,横坐标表示的是碳酸钠溶液质量)。请计算出原滤液中氯化钙的质量分数。
综合实验题测试卷
1.(1)①试管②集气瓶
(2) CaCO3+2HC1====CaC12+H2O+CO2↑
BFC
(3) 2KC1O3 2KC1+3O2↑
【解析】 (2) CO2密度大于空气,要制备干燥的CO2气体必须用浓硫酸干燥并用向上排空气法收集
2.BaCO3 BaSO4
【提出猜想】BaCl2
【实验探究】①③④④②
【解析】BaC12+NaCO3 ====Ba CO3↓+2NaCl,BaC12+ Na2SO4====BaSO4↓+2NaCl ,因此白色沉淀可能是BaC03和BaS04。滤液中除NaCl外,还可能有BaC12、NaC03、Na2SO4。中的一种或几种,加入稀硫酸后只生成白色沉淀,说明有BaCl2;滴加BaCl2。后产生白色沉淀,若加入稀硝酸沉淀部分溶解,且有气泡,说明沉淀是BaCO3 和BaSO4,滤液中有NaCO3、Na2SO4,若沉淀全部不溶解,则沉淀全部是BaSO4,滤液中只有Na2SO4。
3.(1)碳酸钙不溶于水;
(2)溶液温度升高;
(3)Ca(Ac)2溶液也可能与NaCO3。溶液反应生成白色沉淀;
(4)灼烧白色固体有特殊气味
【解析】(1)因为碳酸钙不溶于水,而反应后的白色固体溶于足量蒸馏水中,得到了白色不溶物,所以甲同学认为假设2成立;
(2)丙同学在实验中还发现溶液温度升高,氧化钙和水反应放热,生成的氢氧化钙微溶于水,所以认为假设4不一定成立,但假设3成立;
(3)醋酸钙、氢氧化钙和碳酸钠反应均生成白色沉淀,仅根据实验③,不能认为假设3或假设4成立;
(4)根据醋酸钙受热分解生成碳酸钙和有特殊气味的丙酮来设计实验,灼烧白色固体,有特殊气味,说明假设l成立。
4.(1)铜 (2)用磁铁吸引 有气泡产生
2A1十6HCl=====2AlCl3+3H2↑
实验步骤
实验操作
实验现象
结论
①
取金属混合物粉末于大试管中,加入过量的氢氧化钠溶液
有气泡
产生
仅 除
去铝
②
将大试管静止弃去上层清液,再加入过量稀盐酸(硫酸)
试管中
有气泡
产生,溶液由无色变为浅绿色
证明含
有铁
③
将大试管静止弃去上层清液,加水洗涤剩余固体
剩余固
体呈紫
红色
证明含
有铜
【解析】(1,根据题干提供的物质,可以推测假设2中含有金属铜;(2)不用化学试剂,证明金属铁的存在,可以利用铁的特性,能被磁铁吸引而铝不可以;假设2为铝和铜,加入盐酸则铝与盐酸反应生成氯化铝和氢气,2A1十6HCl=====2AlCl3+3H2↑
;根据题干叙述和已有的知识,要除去铝可以使用氢氧化钠溶液,剩余金属中证明含有铁可以使用盐酸。
5.(1)甲
(2)干燥一氧化碳气体(或除去一氧化碳气体中的水蒸气)
(3) Fe2O3+3CO2Fe+3CO2
(4)澄清石灰水
(5)点燃一氧化碳气体,防止污染空气
【解析】 (1)草酸(H2C204)与浓硫酸混合加热会产生一氧化碳,反应物均为液体,且需要加热,所以选择发生装置甲;(2)浓硫酸具有吸水性,常用来干燥气体;(3)一氧化碳和氧化铁高温生成铁和二氧化碳,方程式是:Fe2O3+3CO2Fe+3CO2;(4)一氧化碳与氧化铁反应生成二氧化碳,检验二氧化碳澄清的石灰水,所以E装置中的液体应为澄清石灰水;(5)一氧化碳有毒,必须经过处理后变成无害物质再排放,酒精灯的作用是将一氧化碳点燃,防止污染空气。
6.(1)试管或玻璃导管
(2)排尽空气检验A是否将二氧化碳吸收完全
(3)CO2+2NaOH====NaCO3+H2O
(4)试管A和B中均无气泡产生
(5)CO2和CO的混合物 减少的反应物质量多于A中增重(CO2的质量)
(6)稀盐酸或稀硫酸 烧杯底部有不溶解的黑色固体
【解析】(1)装置中硬质玻璃管、试管、导管都是玻璃仪器;(2)反应前先通入一段时间N
:排尽试管内空气,炭粉与氧化铁反应生成铁和二氧化碳、一氧化碳,气体通入氢氧化钠中反应掉二氧化碳,用石灰水检验二氧化碳是否除净;当A、B中均没有气泡产生时则反应完毕,不再产生气体;反应前混合物质量51.68g,剩余固体50.24g,生成气体总质量为1.44g,而Na0H溶液反应掉C020.88g,说明气体中有CO2和CO;检验反应后的固体,可加入稀HCl或H2S04,若有不溶的黑色固体,则说明有炭粉剩余。
7. (1)酸H+、Ca2+、Cl一
(2)①53 147②烧杯砝码 ③搅拌 ④贴上标签
(3)①Na2CO3+2HC1====2NaCl+H2O+CO2↑
CaCO3+2HC1====CaC12+H2O+CO2↑
Na2CO3+ CaC12==== CaCO3↓+2NaC1
②出现白色沉淀
③碳酸钠溶液呈碱性,过量的碳酸钠溶液使溶液碱性增强
(4)11.1%
【解析1(1)实验室中用石灰石和稀盐酸反应来制取二氧化碳,该反应生成了氯化钙、水和二氧化骧,其中氯化钙在溶液中以钙离子和氯离子的形式存在,而水以水分子的形式存在,二氧化碳逸出,根据溶液的pH值和溶液的酸碱性的关系可以知道,pH=2的溶液为酸性溶液;(2)①现要配制质量分数为26.5%的碳酸钠溶液200g,需要碳酸钠固体的质
量为:200g×26.5%=53g;水的质量为:200g-53g=147g,即为147mL;②用天平称量物质时,对于有腐蚀性的固体应该在烧杯中称量,应该将烧杯放在左盘,然后将砝码放在右盘,调节游码,向左盘加入药品直至天平平衡;③溶解时为了加速溶解,通常用玻璃棒搅拌来加速溶解;④为了方便识别试剂,应该将试剂瓶贴上标签;(3)①根据上述分析可以知道,在溶液中含有氯化钙、盐酸,所以将碳酸钠溶液滴入溶液中,即AB段发生的反应为:碳酸钠和氯化钙溶液的反应、碳酸钙和盐酸反应、碳酸钠和盐酸的反应,可以据此写出它们反应的化学方程式为:
Na2CO3+2HC1====2NaCl+H2O+CO2↑
CaCO3+2HC1====CaC12+H2O+CO2↑
Na2CO3+ CaC12==== CaCO3↓+2NaC1;
②BC段的pH一7,且不再发生改变,则可以判断盐酸已被完全反应,即该段发生
的反应为碳酸钠和氯化钙的反应,所以产生的实验现象为产生白色沉淀;③CD段pH值升高,说明溶液中的氯化钙已被完全反应,而碳酸钠溶液呈碱性,当氯化钙反应完后继续滴加碳酸钠溶液,溶液会显碱性,故pH会逐渐增大;(4)盐酸和碳酸钠反应生成气体,而沉淀为碳酸钠和氯化钙的反应生成的,但是碳酸钙可以溶于盐酸中,所以必须把盐酸消耗完全才能生成碳酸钙沉淀,结合图中数据可以知道当滴入l0g碳酸钠溶液时盐酸被消耗完毕,即开始产生了沉淀,最后生成沉淀的质量为5g;设氯化钙的质量为2,则:
Na2CO3+ CaC12==== CaCO3↓+2NaC1
111 100
x 5g
111/l00=x/5g
解得:x=5.55g原滤液中氯化钙的质量分数为:5.55g/50g×l00%=11.1%
相关文档
- (东营专版)2020年中考物理总复习 第2021-05-134页
- 山西2011中考理综物理试卷及答案2021-05-137页
- 2019年中考物理真题试题(含解析)(新版2021-05-1327页
- 南京市中考历史试题及答案2021-05-136页
- 2020年中考生物试题分项版解析汇编2021-05-1325页
- 厨房里的中考物理题2021-05-1310页
- 2020届中考数学全程演练 第二部分2021-05-138页
- 2020年中考历史真题试题(含答案) 人2021-05-137页
- 2019年中考数学提分训练 平面直角2021-05-1319页
- (东营专版)2020年中考物理总复习 第2021-05-137页