- 311.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
物质的变化测试卷
一、单项选择题(每小题只有一个选项符合题意,每题2分,共30分)
1.下列变化中,发生了化学变化的是 ( )
A.用木材做成桌椅 B.冰融化成水
C.蜡烛燃烧 D.苹果榨汁
2.下列变化中,没有新物质生成的是 ( )
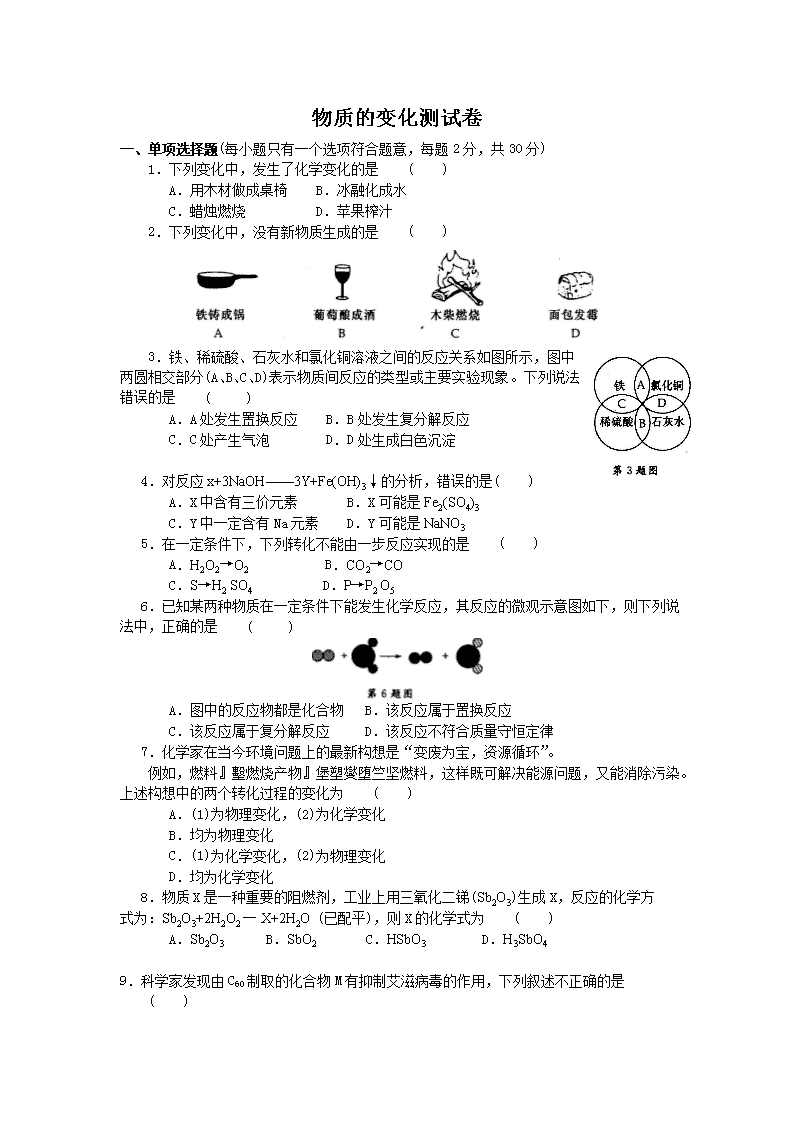
3.铁、稀硫酸、石灰水和氯化铜溶液之间的反应关系如图所示,图中
两圆相交部分(A、B、C、D)表示物质间反应的类型或主要实验现象。下列说法错误的是 ( )
A.A处发生置换反应 B.B处发生复分解反应
C.C处产生气泡 D.D处生成白色沉淀
4.对反应x+3NaOH——3Y+Fe(OH)3↓的分析,错误的是( )
A.X中含有三价元素 B.X可能是Fe2(SO4)3
C.Y中一定含有Na元素 D.Y可能是NaNO3
5.在一定条件下,下列转化不能由一步反应实现的是 ( )
A.H2O2→O2 B.CO2→CO
C.S→H2 SO4 D.P→P2 O5
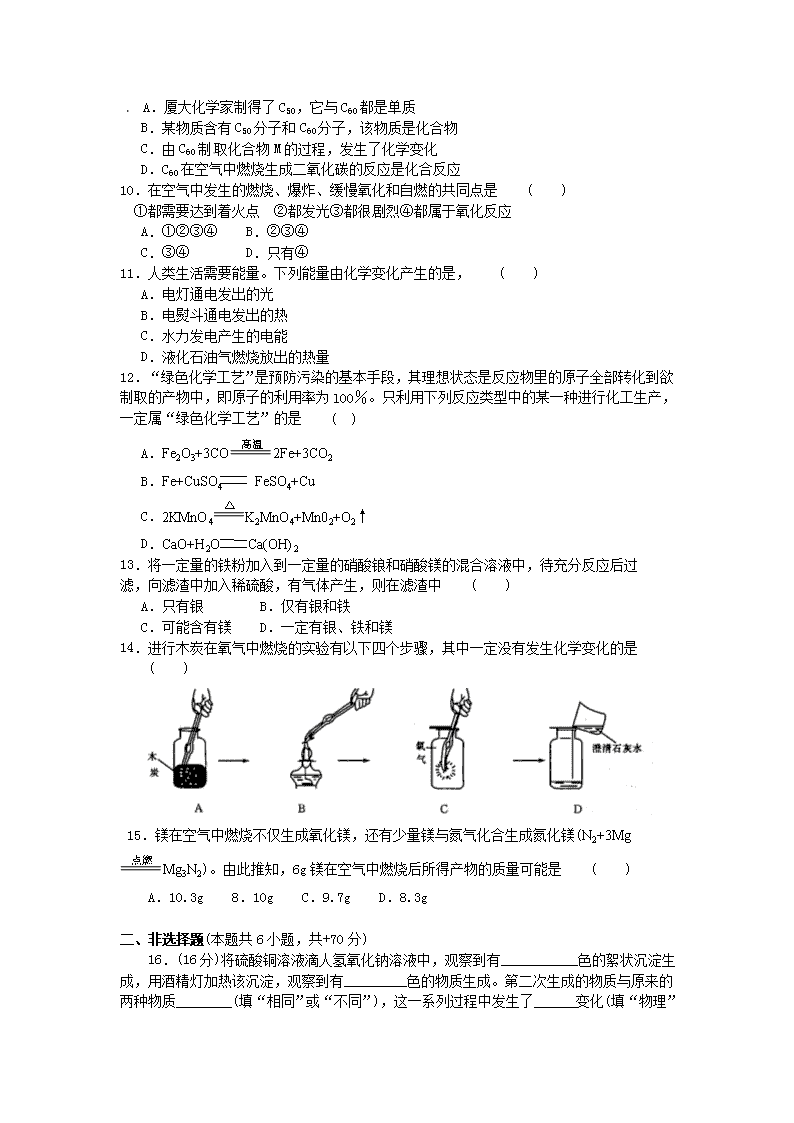
6.已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如下,则下列说法中,正确的是 ( )
A.图中的反应物都是化合物 B.该反应属于置换反应
C.该反应属于复分解反应 D.该反应不符合质量守恒定律
7.化学家在当今环境问题上的最新构想是“变废为宝,资源循环”。
例如,燃料』墼燃烧产物』堡塑燮堕竺坚燃料,这样既可解决能源问题,又能消除污染。上述构想中的两个转化过程的变化为 ( )
A.(1)为物理变化,(2)为化学变化
B.均为物理变化
C.(1)为化学变化,(2)为物理变化
D.均为化学变化
8.物质X是一种重要的阻燃剂,工业上用三氧化二锑(Sb2O3)生成X,反应的化学方
式为:Sb2O3+2H2O2一X+2H2O (已配平),则X的化学式为 ( )
A.Sb2O3 B.SbO2 C.HSbO3 D.H3SbO4
9.科学家发现由C60制取的化合物M有抑制艾滋病毒的作用,下列叙述不正确的是
( )
A.厦大化学家制得了C50,它与C60都是单质
B.某物质含有C50分子和C60分子,该物质是化合物
C.由C60制取化合物M的过程,发生了化学变化
D.C60在空气中燃烧生成二氧化碳的反应是化合反应
10.在空气中发生的燃烧、爆炸、缓慢氧化和自燃的共同点是 ( )
①都需要达到着火点 ②都发光③都很剧烈④都属于氧化反应
A.①②③④ B.②③④
C.③④ D.只有④
11.人类生活需要能量。下列能量由化学变化产生的是, ( )
A.电灯通电发出的光
B.电熨斗通电发出的热
C.水力发电产生的电能
D.液化石油气燃烧放出的热量
12.“绿色化学工艺”是预防污染的基本手段,其理想状态是反应物里的原子全部转化到欲制取的产物中,即原子的利用率为l00%。只利用下列反应类型中的某一种进行化工生产,一定属“绿色化学工艺”的是 ( )
A.Fe2O3+3CO2Fe+3CO2
B.Fe+CuSO4 FeSO4+Cu
C.2KMnO4K2MnO4+Mn02+O2↑
D.CaO+H2O Ca(OH)2
13.将一定量的铁粉加入到一定量的硝酸锒和硝酸镁的混合溶液中,待充分反应后过
滤,向滤渣中加入稀硫酸,有气体产生,则在滤渣中 ( )
A.只有银 B.仅有银和铁
C.可能含有镁 D.一定有银、铁和镁
14.进行木炭在氧气中燃烧的实验有以下四个步骤,其中一定没有发生化学变化的是
( )
15.镁在空气中燃烧不仅生成氧化镁,还有少量镁与氮气化合生成氮化镁(N2+3Mg
Mg3N2)。由此推知,6g镁在空气中燃烧后所得产物的质量可能是 ( )
A.10.3g 8.10g C.9.7g D.8.3g
二、非选择题(本题共6小题,共+70分)
16.(16分)将硫酸铜溶液滴人氢氧化钠溶液中,观察到有___________色的絮状沉淀生
成,用酒精灯加热该沉淀,观察到有_________色的物质生成。第二次生成的物质与原来的
两种物质________(填“相同”或“不同”),这一系列过程中发生了______变化(填“物理”
或“化学”)。请写出这一系列变化的化学反应方程式________________________
17.(7分)镁条在空气中燃烧,不仅生成氧化镁、氮化镁,还有少量镁与二氧化碳反应生成另一种单质和镁的氧化物。
(1)已知氮化镁中氮元素的化合价为-3价,请你写出氮化镁的化学式_____________。
(2)写出镁与二氧化碳反应的化学方程式__________________,指出该反应的基本类型:
___________________反应。
18.(12分)把A、B、C、D四种物质放在密闭寄器中,在一定条件下充分反应,并测得
反应物和产物在反应前后各物质的质量如下表所示:
物 质
A
B
C
D
反应前质量/g
O
0.2
60
2
反应后质量/g
x
30
11
2
(1)上述反应中,x=_________;该反应的基本类型是_______________。
(2)上述反应中,D有可能作该反应的___________剂。
(3)若上述反应中A为气体,B、C、D均为固体,且A、B、C的物质反应系数之比为3:
2:2,则该反应的化学方程式可表示为___________________________________________。
19.(15分)维生素C的化学式是C6H8O6,在新鲜水果、蔬菜中含量都较高。探究小组测定了某品牌橙汁中维生素C的含量,过程如下:取20.00 g橙汁用含碘(I2)1.00%的碘溶液与其反应,恰好反应时消耗碘溶液25.40g(化学方程式:C6H8O6+I2 C6H6O6+2HI)。求
(1)维生素C分子中碳元素的质量分数是__________。(保留2位小数)
(2)橙汁中维生素C的质量分数是多少?(列式计算)
20.(20分)物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象。某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定
混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化
学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是:____________________________
__________________________________________________________________________。
(2)简述强调“测得的pH小于7”的理由:____________________ _________
__________________________________________________________________________。
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察
到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中
滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了。该小组对这种意外现象的原因、
作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液。实验中“加热”和“滴入植物油”目的是________________________。实验结果表明酚酞溶液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:
结论l:说明Na2CO3溶液呈___________性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现
象。请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法_________________,
②观察到的现象______________________________________________________________。
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应
的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10mL混合,用温度计测定室温下混合前
后温度的变化,并记录了每次混合前后温度的升高值At(如下表)。
编号
盐酸
NaOH溶液
△t/℃
1
3.65%
2.00%
3.5
2
3.65%
4.00%
x
3
7.30%
8.00%
14
(1)表中x=________。
(2)某同学在没使用温度计的情况下,通过右图所示装置完
成了实验。则该同学根据______________判断NaOH溶液与稀盐
酸发生了中和反应。
物质的变化测试卷
一、单项选择题
1.C【解析】 蜡烛燃烧为化学变化,A、B、D均 为物理变化。
2.A【解析】铁铸成锅只是改变了铁的形状并 没有新物质产生,故选A。
3.矿【解析】D处应生成蓝色沉淀。
4.B【解析】根据质量守恒定律知,化学反应前 后元素种类、原子数目没有变化,所以选B。
5.C【解析】 H2O2可加入催化剂分解为O 2,CO 2可与C反应生成CO,P与O2反应生成P2O5,而S不能由一步反应直接生成H2S04。
6.B【解析】由同种原子构成的是单质,所以该 反应从微观上看是单质分子与化合物分子反应生成 新的单质分子和新的化合物分子,属于置换反应。
7.D【解析】燃烧属于化学变化;燃烧产物在太 阳能或生物能作用下重新变为燃料,二者是不同的物质,即有新物质生成,发生了化学变化,故选D。
8.A【解析】根据化学反应前后原子的种类和 数目不变,反应前有2个sb原子,7个O原子和4个 H原子,反应后有4个H原子和2个O原子,故l 个X中有2个sb原子和5个O原子,则x的化学 式为Sb2O5。
9.B【解析】 物质是由分子组成的,某物质中含有C50分子和C60分子,说明该物质是由两种物质纽成所以该物质是混合物。
10.D【解析】缓慢氧化不需要达到着火点就能发生,且不发光,也不剧烈,但属于氧化反应。
11.D【解析】 化学变化的本质是有新物质生
成,A、B、c都无新物质生成,故选D。
12.D【解析】只有D项反应物里的原子全部转化到欲制取的产物中,故选D。
13.B 【解析】 将铁粉加入到AgN03和Mg(N03)2的混合溶液中,铁粉只与AgN0。溶液发生置换反应,而在反应后的滤渣中加入稀硫酸有气体产生,说明铁粉过量,故滤渣的成分为铁和银,B正确。
14.A【解析】A项取木炭,没有发生化学变化;B项是木炭点燃;C项是木炭在氧气中燃烧;D项是用澄清石灰水检验产物CO2,B、C、D都发生化学反应,属化学变化。
15.C【解析】本题利用极值法进行解题,6 g镁全部与氧气反应能生成l0 g氧化镁,如果6 g镁全部与氮气反应能生成8.3 g氮化镁,6 g镁在空气中燃烧后所得产物的质量一定既含氧化镁也含氮化镁,所以生成质量介于他们之间。
二、非选择题
16.蓝 黑 不同 化学
CuSO4+2NaOH=Cu(OH)2↓++Na2 SO4
Cu(OH)2 CuO+H2O
【解析】硫酸铜溶液与氢氧化钠溶液反应生成蓝色沉淀氢氧化铜,氢氧化铜在加热条件下可生成黑色物质氧化铜,这两种生成物为不同的物质,即发生了化学变化,反应方程式为:CuSO4+2NaOH=Cu(OH)2↓++Na2 SO4;Cu(OH)2 CuO+H2O。
17.(1)Mg3N2 (2)2Mg+ CO22MgO+C
置换
【解析】(1)Mg是+2价,N是一3价,原子数=最小公倍数/正价数(或负价数)所以是Mg3N2 Mg与 CO2反应生成MgO和单质C条件是点燃。 (3)单质 Mg置换出CO2中的C单质,符合置换反应定义。
18.(1)19.2 分解反应 (2)催化
(3)2C2B+3A↑
【解析】根据质量守恒定律,在反应前后各物质质量总和不变,则x=(60+0.2+2)一(30+11+2)=19.2;由反应前后分析可知,A、B在反应后质量增大,C在反应后质量减小,
D的质量不变,则D可能为催化剂,该反应为分解反应;由A、B、C反应系数之比为3:2:2可知,该反应的方程为2C2B+3A↑ 19.(1)54.55% (2)0.88%。
【解析】(1)维生素中C的质量分数为12*6/(12*6+1*8+16*6)*l00%=54.55%;
(2)设维生素C的质量为x C6H8O6+I2=C6H6O6+2HI
176 254
x 25.4g×1.00%
176/x=254/0.254 g x=0.176 g
0.176g/20.00 g*l00%=0.88%
答:橙汁中维生素C的质量分数是0.88%。
(1)在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较
(2)排除因盐酸的加入,稀释氢氧化钠溶液而引
方案二:
(1)赶走溶液中少量氧气,隔绝氧气
(3)①做对比实验,取上述NaOH溶液稀释,加入酚酞溶液②出现红色且不褪去
方案三:
(1)7 (2)U形管中左边液面下降
【解析】(1)用pH试纸测定溶液的pH时,正确加入,稀释氢氧化钠溶液而引起pH减小。方案二: (1)为验证猜想①,该组同学做了如下实验:将配制的述现象。方案三:化学反应中通常伴随有能量的变混合前后温度的变化,并记录了每次混合前后温度
(1)由表中数据,可推出x=7。(2)某同学在没使溶液与稀盐酸发生了中和反应。