- 161.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
混合物分离
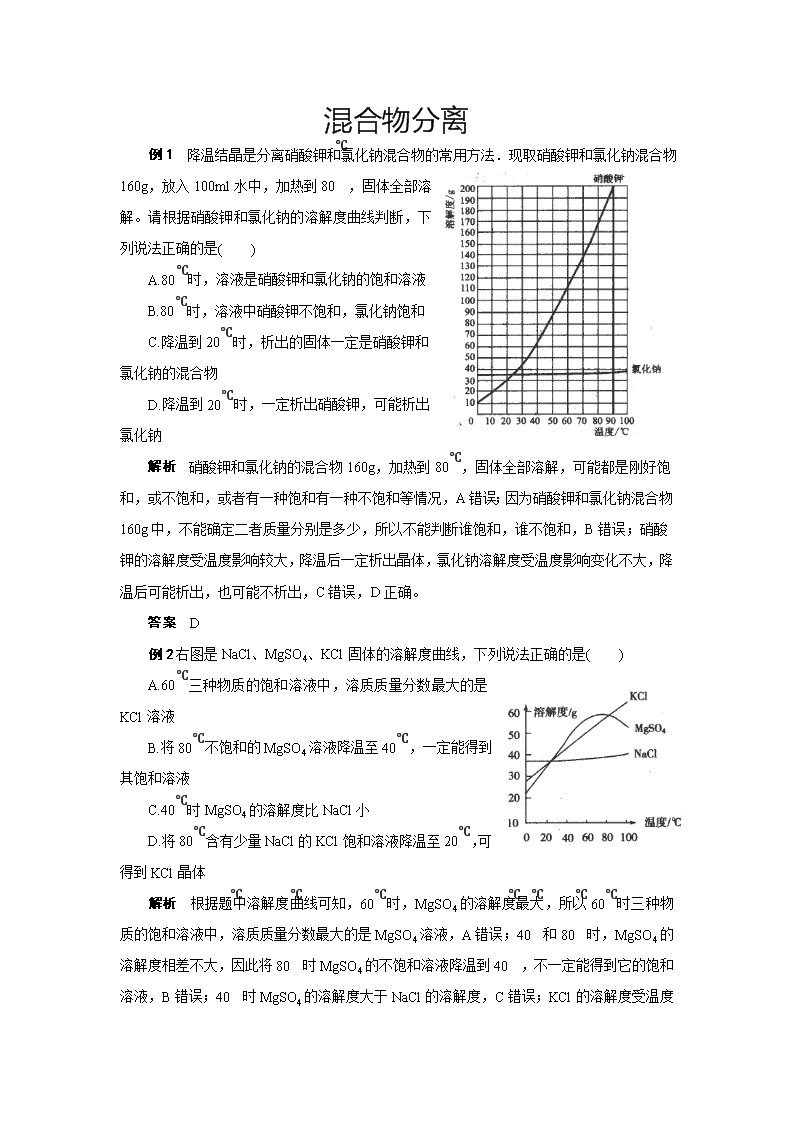
例1 降温结晶是分离硝酸钾和氯化钠混合物的常用方法.现取硝酸钾和氯化钠混合物160g,放入100ml水中,加热到80℃,固体全部溶解。请根据硝酸钾和氯化钠的溶解度曲线判断,下列说法正确的是( )
A.80℃时,溶液是硝酸钾和氯化钠的饱和溶液
B.80℃时,溶液中硝酸钾不饱和,氯化钠饱和
C.降温到20℃时,析出的固体一定是硝酸钾和氯化钠的混合物
D.降温到20℃时,一定析出硝酸钾,可能析出氯化钠
解析 硝酸钾和氯化钠的混合物160g,加热到80℃,固体全部溶解,可能都是刚好饱和,或不饱和,或者有一种饱和有一种不饱和等情况,A错误;因为硝酸钾和氯化钠混合物160g中,不能确定二者质量分别是多少,所以不能判断谁饱和,谁不饱和,B错误;硝酸钾的溶解度受温度影响较大,降温后一定析出晶体,氯化钠溶解度受温度影响变化不大,降温后可能析出,也可能不析出,C错误,D正确。
答案 D
例2右图是NaCl、MgSO4、KCl固体的溶解度曲线,下列说法正确的是( )
A.60℃三种物质的饱和溶液中,溶质质量分数最大的是KCl溶液
B.将80℃不饱和的MgSO4溶液降温至40℃,一定能得到其饱和溶液
C.40℃时MgSO4的溶解度比NaCl小
D.将80℃含有少量NaCl的KCl饱和溶液降温至20℃,可得到KCl晶体
解析 根据题中溶解度曲线可知,60℃时,MgSO4的溶解度最大,所以60℃时三种物质的饱和溶液中,溶质质量分数最大的是MgSO4溶液,A错误;40℃和80℃时,MgSO4的溶解度相差不大,因此将80℃时MgSO4的不饱和溶液降温到40℃,不一定能得到它的饱和溶液,B错误;40℃时MgSO4的溶解度大于NaCl的溶解度,C错误;KCl
的溶解度受温度影响较大,且溶解度随温度的降低而减小,而NaCl的溶解度受温度影响变化不大,所以可采取降温结晶的方法提纯含有少量NaCl的KCl晶体,D正确。
答案 D
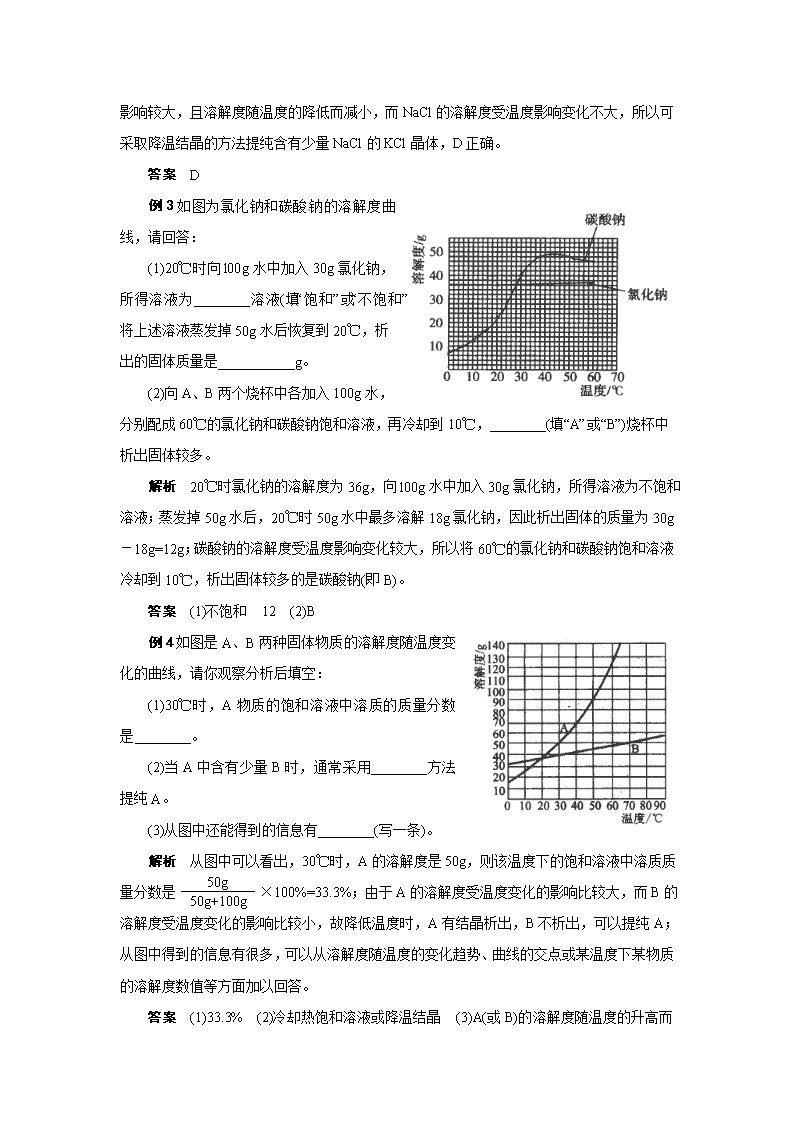
例3如图为氯化钠和碳酸钠的溶解度曲线,请回答:
(1)20℃时向l00g水中加入30g氯化钠,所得溶液为________溶液(填“饱和”或“不饱和”);将上述溶液蒸发掉50g水后恢复到20℃,析出的固体质量是___________g。
(2)向A、B两个烧杯中各加入100g水,分别配成60℃的氯化钠和碳酸钠饱和溶液,再冷却到10℃,________(填“A”或“B”)烧杯中析出固体较多。
解析 20℃时氯化钠的溶解度为36g,向l00g水中加入30g氯化钠,所得溶液为不饱和溶液;蒸发掉50g水后,20℃时50g水中最多溶解18g氯化钠,因此析出固体的质量为30g-18g=12g;碳酸钠的溶解度受温度影响变化较大,所以将60℃的氯化钠和碳酸钠饱和溶液冷却到10℃,析出固体较多的是碳酸钠(即B)。
答案 (1)不饱和 12 (2)B
例4如图是A、B两种固体物质的溶解度随温度变化的曲线,请你观察分析后填空:
(1)30℃时,A物质的饱和溶液中溶质的质量分数是________。
(2)当A中含有少量B时,通常采用________方法提纯A。
(3)从图中还能得到的信息有________(写一条)。
50g+100g
50g
解析 从图中可以看出,30℃时,A的溶解度是50g,则该温度下的饱和溶液中溶质质量分数是 ×100%=33.3%;由于A的溶解度受温度变化的影响比较大,而B的溶解度受温度变化的影响比较小,故降低温度时,A有结晶析出,B不析出,可以提纯A;从图中得到的信息有很多,可以从溶解度随温度的变化趋势、曲线的交点或某温度下某物质的溶解度数值等方面加以回答。
答案 (1)33.3% (2)冷却热饱和溶液或降温结晶 (3)A(或B)
的溶解度随温度的升高而增大(或A的溶解度受温度的影响比B大,只要合理即可)
例5右图是A、B两种固体物质的溶解度曲线。据图回答:
(1)P点表示的意义是________________。
(2)把t2℃时等质量A、B两物质的饱和溶液降低到t1℃,析出晶体较多的是________________。
(3)当A中含有少量B物质时,可采用_____________的方法提纯A物质。
(4)t2℃时,将90gA物质投入到100g水中,得到A物质的____________(填“饱和”或“不饱和”)溶液,此时溶液的质量是________g。
解析 溶解度曲线中交点表示该温度时两种物质的溶解度相等,所以P点表示的意义是在t1℃时,A、B两物质的溶解度相等;曲线陡的是A曲线,平缓的是B曲线,所以把t2℃时等质量A、B两物质的饱和溶液降低到t1℃,溶解度变化较大的物质是A,即A的溶解度减小得更多,所以降低相同温度,A物质析出的更多;当A中含有少量B时,要提纯A物质,应以A物质为主,根据其溶解度受温度影响的情况采取相应的结晶方法,因为A的溶解度受温度影响较大,且溶解度随温度的降低而减小,所以适合采用降温结晶(或冷却热饱和溶液结晶)的方法;t2℃时,A的溶解度是50g,即该温度下100g水中最多溶解50gA物质,t2℃时,将90gA物质投入到100g水中,得到A物质的饱和溶液,且只溶解了50gA物质,所得溶液质量为50g+100g=150g。
答案 (1)在t1℃时,A、B两物质的溶解度相等(其它合理答案均可) (2)A物质 (3)降温结晶(或冷却热饱和溶液结晶) (4)饱和 150