- 217.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017中考计算题专题复习(1)
可能用到的相对原子质量:Mn—55;Mg—24;Fe—56;Zn—65;Al—27;Ca—40;Cl—35.5;K—39;Cu—64;H—1;O—16;C—12;Na—23;S—32;N—14;Si—28;Ba—137
一、平均值型计算选择题:
例:两种金属粉末的混合物30克,与足量的稀硫酸反应,只生成氢气1克,则这种混合物中的两种金属可能是( )
A.Mg Al B.Zn Fe C.Mg Fe D.Al Fe
【同题链接】
1、一种不纯的铁,已知它含有铜、钙、镁的一种或几种金属杂质,5.6g这样的铁跟足量的稀H2SO4反应时,生成H20.2g,则该铁样品中一定含有的金属杂质是( )
A.铜 B.镁 C.铝 D.钙
2、把含有某一种氯化物杂质的氯化镁粉末95g溶于水后加入足量的AgNO3溶液,完全反应后生成白色沉淀300g,则氯化镁中的杂质可能是( )
A.NaCl B.AlCl3 C.KCl D.CaCl2
3、在某铁的样品中可能含有Zn、Mg、Al、Cu等杂质金属中的2种,取5.6g样品跟足量稀硫酸反应,得到0.20gH2,则此铁的样品中不可能含有的杂质金属组是( )
A. Cu和Mg B. Zn和Al C. Mg和Al D. Zn和Cu
4、某不纯的氯化铵样品中,测得其中氮元素的质量分数为28%,则混入的一种杂质可能是
①NH4HCO3 ②(NH4)2SO4 ③NH4NO3 ④CO(NH2)2 ( )
A.(1)或(2) B.①或③ C.②或(4) D.(3)或(4)
二、估算型选择题
例:20g20%的NaOH溶液与20g20%的H2SO4溶液充分反应后,滴入紫色石蕊试液是( )
A.蓝色 B.紫色 C.红 D.无色
【同题链接】
1、相同质量的下列的物质中,铁的质量分数最高的是( )
A.FeS B.FeCO3 C.Fe2O3 D.Fe3O4
2、由二氧化硫和三氧化硫组成的混合气体中,硫元素与氧元素的质量比可能是( )
A. 1∶1 B. 1∶1.25 C. 1∶1.5 D. 1∶2
三、 特殊规律型选择题
例:某甲醛(HCHO)溶液中氢元素的质量分数为10%,则碳元素的质量分数正确的是( )
A.12% B.10% C.8% D.6%
【同题链接】
已知NaHS、MgSO4、和NaHSO3由组成的混合物中硫元素的质量分数为20%,则氧元素的质量分数为( )
A.35% B.25% C.65% D.无法计算
四、溶质的质量分数计算
1、已知20℃硝酸钾的溶解度为31.6g。在该温度下将20g硝酸钾放入50g水中,充分搅拌,则所得溶液中溶质的质量分数约为( )
A.24.0% B.28.6% C.31.6% D.40.0%
2、对100g溶质质量分数为10%的某物质的溶液,分别进行如下操作:①蒸发掉10g水,无晶体析出 ②加入溶质质量分数为10%的同种溶质的溶液10g ③加入10g同种溶质,且完全溶解 ④加入10g水。操作后的四种溶液的溶质质量分数由小到大的顺序是( )
A. ①②③④ B.④②①③ C.④③②① D.④②③①
3、足量的下列固体物质分别与质量相等、溶质质量分数相同的盐酸混合,若盐酸均完全反应,所得ZnCl2溶液中溶质的质量分数最小的是( )
A.Zn B.ZnO C.Zn(OH)2 D.ZnCO3
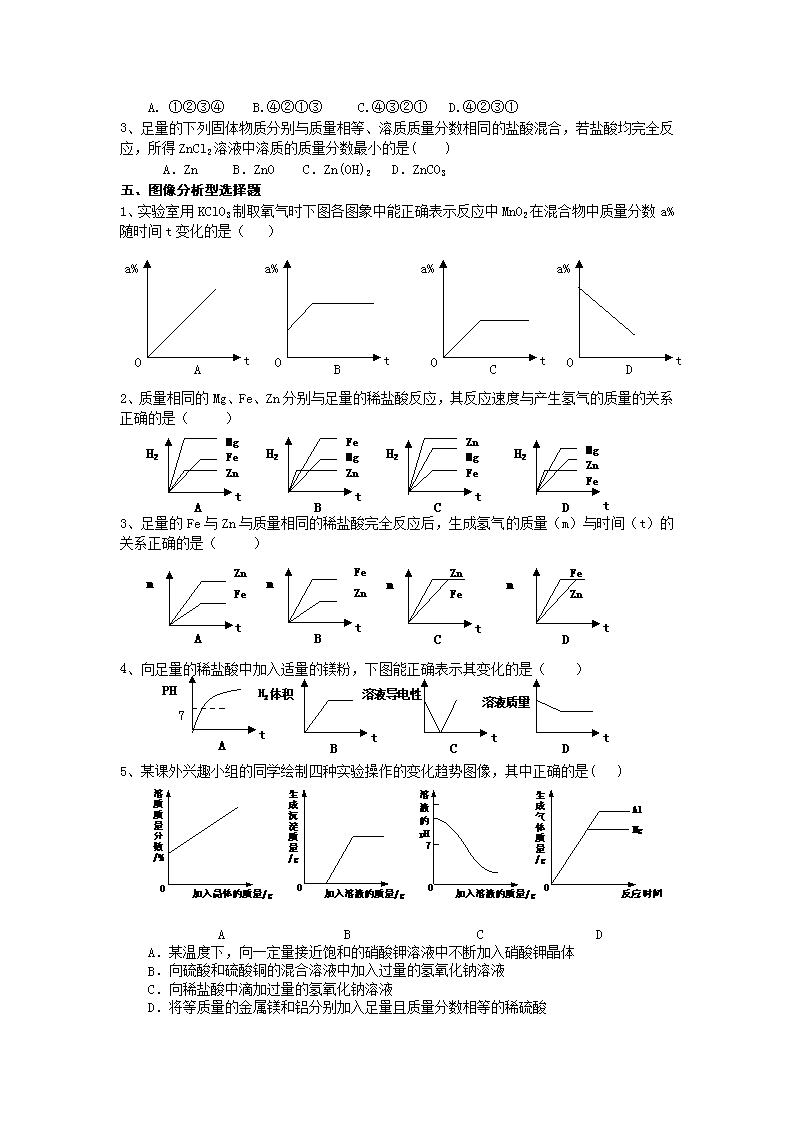
五、图像分析型选择题
1、实验室用KCl03制取氧气时下图各图象中能正确表示反应中MnO2在混合物中质量分数a%随时间t变化的是( )
A
t
O
a%
C
t
O
a%
B
t
O
a%
D
t
O
a%
2、质量相同的Mg、Fe、Zn分别与足量的稀盐酸反应,其反应速度与产生氢气的质量的关系正确的是( )
Mg
Zn Fe
Zn Mg
Fe
Fe
Mg
Zn
Mg
Fe
Zn
H2
H2
H2
H2
t
t
t
t
D
C
B
A
3、足量的Fe与Zn与质量相同的稀盐酸完全反应后,生成氢气的质量(m)与时间(t)的关系正确的是( )
m
Zn
Fe
m
Fe Zn
Fe Zn
m
Zn Fe
m
t
t
t
t
C
B
A
D
t
A
PH
4、向足量的稀盐酸中加入适量的镁粉,下图能正确表示其变化的是( )
溶液质量
t
C
溶液导电性
t
B
H2体积
7
D
t
5、某课外兴趣小组的同学绘制四种实验操作的变化趋势图像,其中正确的是( )
溶质质量分数/%
生成沉淀质量/g
生成气体质量/g
加入晶体的质量/g
加入溶液的质量/g
加入溶液的质量/g
反应时间/s
溶
液
的
pH
7
0
0
0
0
Al
Mg
A B C D
A.某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B.向硫酸和硫酸铜的混合溶液中加入过量的氢氧化钠溶液
C.向稀盐酸中滴加过量的氢氧化钠溶液
D.将等质量的金属镁和铝分别加入足量且质量分数相等的稀硫酸
6.下列图像不能正确反映其对应变化关系的是( )
A B C D
A.用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气
B.一定质量的红磷在密闭容器中燃烧
C.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
D.向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
7.向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如图。下列说法正确的是( )
A.a点所得固体为银和铁
B.b点所得溶液中的溶质为硝酸银、硝酸亚铁和硝酸锌
C.c点所得固体为银、铁和锌
D.d点所得溶液中的溶质为硝酸锌
8.将质量相等的铝粉和铁粉分别与同体积、同浓度的两份稀硫酸反应。反应情况如下图所示。有关叙述中正确的是( )
A.铝粉、铁粉和硫酸均有剩余
B.铝粉、铁粉均反应完,硫酸有剩余
C.硫酸、铝粉均反应完,铁粉有剩余
D.硫酸均反应完,铝粉有剩余
9.向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定
质量分数的氢氧化钠溶液,直至过量。某同学依据实验
事实绘制了如图所示的曲线。下列说法正确的是
A.c点对应溶液中的溶质种类最少
B.b点对应溶液中的溶质只有硫酸钠
C.a至b段对应溶液的pH逐渐减小
D.a至d段硫酸钠的质量逐渐增大
六、实验数据型计算题
例:某同学为探究铜铁合金中铁的质量分数,先后进行了三次实验,实验数据如下表:
实验次数
项目
第一次
第二次
第三次
所取合金的质量/g
20
20
40
所加稀硫酸的质量/g
100
120
80
生成氢气的质量/g
0.4
0.4
0.4
根据该同学的实验,试回答以下问题:
(1)上表三次实验中,合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是_____g。
(2)该铜铁合金中铁的质量分数是多少?
(3)第三次实验所得溶液溶质质量分数为____________(结果保留至0.1%)。
【同题链接】
1、甲、乙、丙三位同学分别取某石灰石样品与50g盐酸进行实验,所得结果如下:
实验
甲
乙
丙
加入样品的质量/g
5
10
15
生成CO2的质量/g
1.76
3.52
4.4
求:⑴该石灰石样品中碳酸钙的质量分数。
⑵盐酸中溶质的质量分数。
2.把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是( )
物质
甲
乙
丙
丁
反应前的质量(g)
6.4
4.0
3.2
2.8
反应后的质量(g)
5.2
7.2
1.2
X
A.乙可能是化合物 B.丁一定为该反应的催化剂
C.若消耗6g甲,则生成16g乙 D.甲和丙的质量之和一定等于乙的质量
3.在一定条件下,一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。下列有关说法不正确的是( )
物质
a
b
c
d
反应前的质量/g
30
20
10
15
反应后的质量/g
x
y
0
10
A.参加反应的c与d的质量之比为2:1
B.x的取值范围一定是:0≤x≤30
C.当y≤20时,该反应一定是化合反应
D.x + y = 65
4、石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4 g石灰石样品,把20 g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
稀盐酸的用量
第一次加入5 g
第二次加入5 g
第三次加入5 g
第四次加人5 g
剩余固体的质量
3 g
2 g
l g
1 g
(1)该石灰石样品中碳酸钙的质量分数是 ;
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
七、天平平衡
1、天平两端分别放置盛有足量稀盐酸的烧杯,把天平调到平衡,向其中一只烧杯中投入5.6g氧化钙,向另一只烧杯中投入适量的镁片,要使天平最终保持平衡,需投入镁片的质量为( )
A.5.61g B.8.00g C.4.2g D.6.11g
2、在天平的两盘分别放入质量相等的烧杯,烧杯中各盛100g9.8%的硫酸溶液,向两个烧中同时加入哪组金属,反应终止时天平仍保持平衡( )
A.锌、铁各7g B.锌、铁各5g C.锌、铁各4g D.锌、铁各3g
3、在天平的两个托盘里分别放上等重的两个烧杯,分别加入等质量的足量稀H2SO4,往左杯里放入0.44gCaO,要使天平重新达到平衡,可以往右边烧杯中加入的适宜物质是( )
A.100gCaCO3 B.0.48gMg粉 C.0.924gMgCO3 D.0.44gCu·Al合金
八、综合分析型选择题
例:取一定质量的CO和CO2的混合气体,通入足量的Ba(OH)2溶液中,充分反应后过滤,发现生成的沉淀和所取的混合气体质量相等,则混合气体中,碳原子与氧原子的个数比为( )
A.1:1 B.1:2 C.28:44 D.181:209
【同题链接】
1、在CO、CO2的混合气体中氧元素的质量分数元素为64%,将10g混合气体先通过足量灼热的氧化铜充分反应后,所得气体再通入到足量的石灰水中,最多可得到白色沉淀( )
A.10 g B.20g C.30g D.40 g
2、在实验室里用铁屑、氧化铜、稀硫酸为原料制取铜,有下列两个途径:
硫酸
Fe
硫酸
CuO
△
(1)
Fe H2 Cu (2) CuO CuSO4 Cu
若用这两种方法制得质量相同的铜,则下列有关说法:①消耗相同质量的氧化铜②消耗相同质量的铁③消耗相同质量的硫酸④生成硫酸亚铁的质量不同。其中符合实际情况的是( )
A.①② B.①②③ C.①④ D.①②③④
3.现有下列四组物质:①乙炔(C2H2)和苯(C6H6);②乙烷(C2H6)和乙醇(C2H6O);③丁烷(C4H10)和乙醚(C4H10O);④甲苯(C7H8)和甘油(C3H8O3).当总质量一定时,各组中的两种物质无论按何种质量比混合,完全燃烧生成水的质量均相同.符合该条件的共有( )
A.1组 B.2组 C.3组 D.4组
4.镁是一种活泼金属,除了能与氧气反应,还可以与氮气,二氧化碳等反应。
为测定镁铝合金(不含其它元素)中镁的质量分数。
称量ag镁铝合金粉末,放在如右图所示装置的惰性电热板上,
通电使其充分灼烧。在下列关于实验的说法中正确的是( )
①氧气要保证充足 ②实验结束后一定要再次称量剩余固体的质量
③用空气代替氧气对实验没有影响 ④灼烧后的固体为氧化镁和铝的混合物,质量大于ag
A.①④ B. ①②④ C . ①② D ①②③④
5.测得CO、CO2和N2的混合气体中碳元素的质量分数为24%,则其中氧元素的质量分数可能是 ( )
A.10% B.30% C.50% D.70%
6.碳酸钾和碳酸钙的固体混合物75g与足量的稀盐酸充分反应后,如果将反应后的溶液蒸干得到82.7g固体,则原混合物中金属元素的质量分数为( )
A.40% B.44% C.48% D.52%
7.将m1g碳与m2g氧气置于密闭容器中,在一定条件下充分反应,恢复至常温,若此时密闭容器中的气体是纯净物,则m1∶m2不可能是( )
A.1∶1 B. 1∶2 C.3∶4 D.3∶8
8.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入m克Zn,充分反应后过滤,将
滤渣洗涤、干燥、称量,得到质量为m克的滤渣。下列说法不正确的是( )
A.取反应后的滤液观察,滤液可能呈蓝色
B.取反应后的滤液滴加稀盐酸,有白色沉淀产生
C.取滤渣滴加稀硫酸,可能有气泡产生
D.滤液中的溶质最多有两种,滤渣中的物质至少有两种
9、向碘化钾溶液中加入硝酸银溶液,直到反应完全时为止,结果反应后溶液的质量恰好等于反应前溶液的质量。则加入硝酸银溶液的质量分数为( )
A、72.3% B、50% C、38.3% D、38%
10、葡萄糖(C6H12O6)、乙酸(CH3COOH)和尿素(CO(NH2)2)组成的混合物240g,在一定条件下完全燃烧,生成水的质量是( )
A、48g B、72g C、144g D、无法计算
11、将一定质量的碳酸钙和铜粉置于一敞口容器中,加热煅烧使其完全反应。若反应前后容器内固体质量不变,则容器中铜和碳酸钙的质量比是( )
A、11:14 B、20:14 C、44:25 D、16;25
12、质量相等的SO2和SO3分子中,所含氧原子个数比是( )
A、3:4 B、2:3 C:5:6 D、16:15
13、含原子个数相等的SO2和SO3的质量比是( )
A、3:4 B、4:5 C、15:16 D、16:15
14、在X + 2Y = R + 2M中,已知R和M的相对分子质量之比是22:9.当1.6g X和Y恰好完全反应后,生成4.4g R,则在此反应中Y和M的质量之比为( )
A、16:9 B、23:9 C、32:9 D、46:9
15
、一定质量的某含碳化合物在空气中完全燃烧后,生成8.8g二氧化碳和5.4g水,则该化合物可能是( )
A 、CH4 B、C3H6 C、C2H5OH D、CH3OH
九、根据化学方程式计算
1、化学方程式反映的是纯净物间的质量关系,若遇到不纯物时,应先把不纯物的质量换算成纯净物质量。
纯物质的质量==不纯物质的质量×纯度=不纯物质的质量×(1- 杂质的质量分数)
4.4
25.1
【例1】某班一次社会实践活动是到碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠)。参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质)。取样品9.3 g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
(1)样品中碳酸氢钠的质量分数。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
【例2】向一定质量的碳酸钙中加入100g稀盐酸,反应一段时间后,称得剩余溶液的质量为105.6g,求参加反应的碳酸钙质量。
【例3】将12gCO和CO2的混合气体通过灼热的氧化铜后,得到气体的总质量为18g,求混合气体中的CO的质量分数。
实战练习
1.向碳酸钠和氯化钠的混合物15.6 g中加入100 g稀盐酸,恰好完全反应后,得到111.2 g溶液。试计算:
(1)产生二氧化碳多少克?
(2)所得溶液中溶质的质量分数是多少?
2、将质量为10g的铁棒放入硫酸铜溶液中,过一定时间取出洗净、干燥、称重,发现铁棒的质量增加到10.4g,求10.4g铁棒由哪些物质组成、各多少克?