- 933.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题突破练7 电化学
一、选择题(本题包括7个小题,每小题8分,共56分)
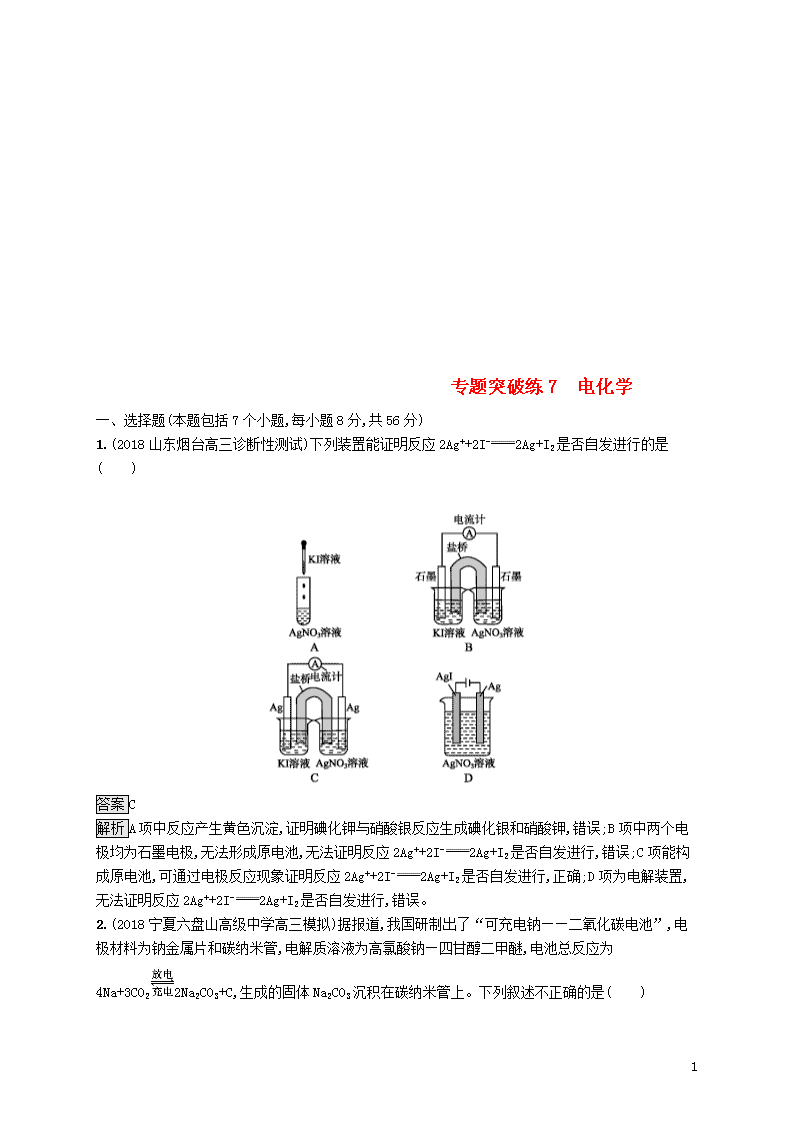
1.(2018山东烟台高三诊断性测试)下列装置能证明反应2Ag++2I-2Ag+I2是否自发进行的是( )
答案C
解析A项中反应产生黄色沉淀,证明碘化钾与硝酸银反应生成碘化银和硝酸钾,错误;B项中两个电极均为石墨电极,无法形成原电池,无法证明反应2Ag++2I-2Ag+I2是否自发进行,错误;C项能构成原电池,可通过电极反应现象证明反应2Ag++2I-2Ag+I2是否自发进行,正确;D项为电解装置,无法证明反应2Ag++2I-2Ag+I2是否自发进行,错误。
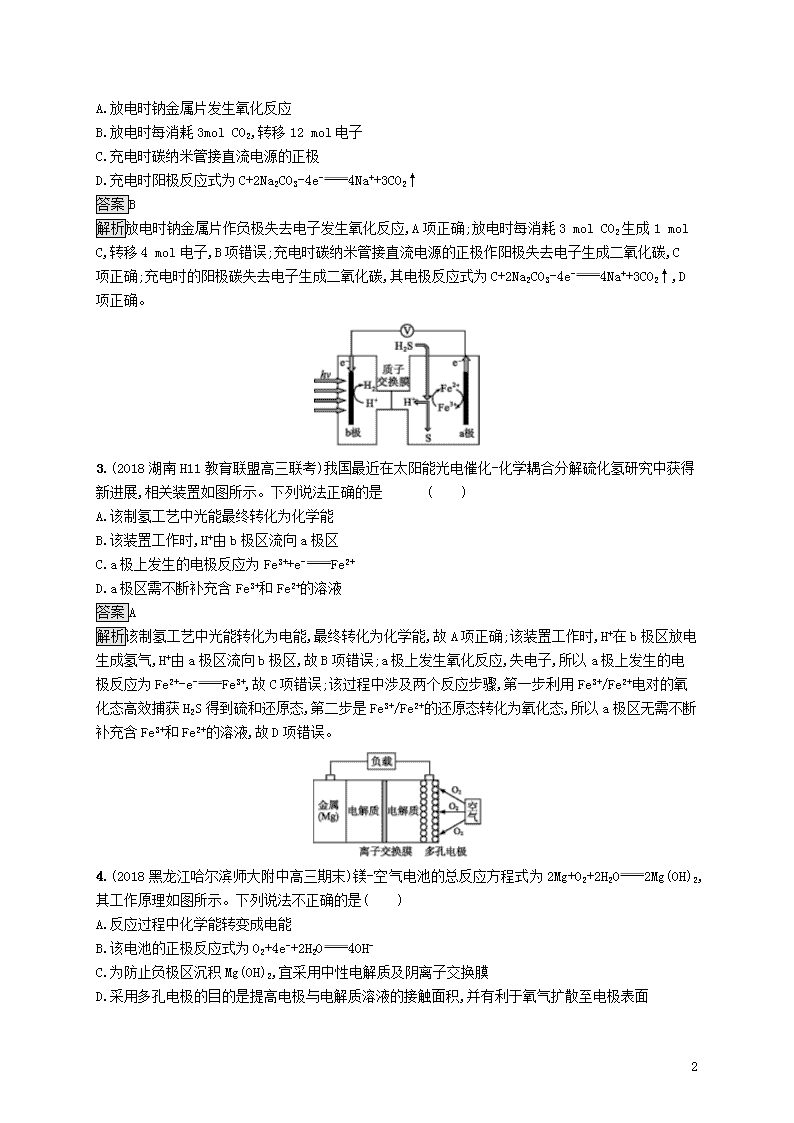
2.(2018宁夏六盘山高级中学高三模拟)据报道,我国研制出了“可充电钠——二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解质溶液为高氯酸钠—四甘醇二甲醚,电池总反应为4Na+3CO22Na2CO3+C,生成的固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是( )
8
A.放电时钠金属片发生氧化反应
B.放电时每消耗3mol CO2,转移12 mol电子
C.充电时碳纳米管接直流电源的正极
D.充电时阳极反应式为C+2Na2CO3-4e-4Na++3CO2↑
答案B
解析放电时钠金属片作负极失去电子发生氧化反应,A项正确;放电时每消耗3 mol CO2生成1 mol C,转移4 mol电子,B项错误;充电时碳纳米管接直流电源的正极作阳极失去电子生成二氧化碳,C项正确;充电时的阳极碳失去电子生成二氧化碳,其电极反应式为C+2Na2CO3-4e-4Na++3CO2↑,D项正确。
3.(2018湖南H11教育联盟高三联考)我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是 ( )
A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
答案A
解析该制氢工艺中光能转化为电能,最终转化为化学能,故A项正确;该装置工作时,H+在b极区放电生成氢气,H+由a极区流向b极区,故B项错误;a极上发生氧化反应,失电子,所以a极上发生的电极反应为Fe2+-e-Fe3+,故C项错误;该过程中涉及两个反应步骤,第一步利用Fe3+/Fe2+电对的氧化态高效捕获H2S得到硫和还原态,第二步是Fe3+/Fe2+的还原态转化为氧化态,所以a极区无需不断补充含Fe3+和Fe2+的溶液,故D项错误。
4.(2018黑龙江哈尔滨师大附中高三期末)镁-空气电池的总反应方程式为2Mg+O2+2H2O2Mg(OH)2,其工作原理如图所示。下列说法不正确的是( )
A.反应过程中化学能转变成电能
B.该电池的正极反应式为O2+4e-+2H2O4OH-
C.为防止负极区沉积Mg(OH)2,宜采用中性电解质及阴离子交换膜
D.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
8
答案C
解析镁-空气电池是将化学能转化为电能的装置,A项正确;正极上O2得电子,与水反应生成OH-,正极反应式为O2+2H2O+4e-4OH-,B项正确;负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则负极区溶液中不能含有大量OH-,所以宜采用中性电解质及阳离子交换膜,C项错误;反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,D项正确。
5.(2018河南郑州高三模拟)全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2OV+V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液可得到NaOH和H2SO4,示意图如下。下列说法错误的是( )
A.全钒液流电池放电时,正极的电极反应式为V+2H++e-VO2++H2O
B.图中a电极为阴极,N物质是H2
C.全钒液流电池充电时,V3+被氧化为V
D.电解时,b电极的反应式为S+H2O-2e-S+2H+
答案C
解析根据全钒液流电池的充放电原理,放电时的电池反应为V+V2++2H+VO2++V3++H2O,放电时正极发生得电子的还原反应,正极的电极反应式为V+2H++e-VO2++H2O,A项正确;根据图示,图中b电极上S发生失电子的氧化反应生成H2SO4,b电极为阳极,a电极为阴极,由于放电顺序:H+>Na+,故a电极上的电极反应式为2H2O+2e-H2↑+2OH-,N物质是H2,B项正确;全钒液流电池充电时的反应为VO2++V3++H2OV+V2++2H+,根据“只靠拢、不交叉”,V3+被还原为V2+,VO2+被氧化为V,C项错误;电解时,b电极上S发生失电子的氧化反应生成H2SO4,电极反应式为S-2e-+H2OS+2H+,D项正确。
8
6.(2018云南师大附中高三适应性考试)在通电条件下,用如图所示装置由乙二醛(OHC—CHO)制备乙二酸(HOOC—COOH),其制备反应为OHC—CHO+2Cl2+2H2OHOOC—COOH+4HCl,下列说法不正确的是( )
A.盐酸是起提供Cl-和增强导电性的作用
B.Pt1的电极反应为2H++2e-H2↑
C.每得到1 mol乙二酸将有2 mol H+从右室迁移到左室
D.每消粍0.1 mol乙二醛在Pt1极放出4.48 L气体(标准状况)
答案C
解析HCl是电解质,在水溶液中起提供Cl-和增强导电性的作用,故A项正确;Pt1为阴极,得电子发生还原反应,故电极反应式为2H++2e-H2↑,故B项正确;Pt2为阳极,发生的电极反应式为2Cl--2e-Cl2↑,产生的Cl2再将乙二醛氧化为乙二酸。根据题中给出的乙二醛和Cl2反应的化学方程式,可知每得到1 mol乙二酸将有4 mol H+从右室迁移到左室,故C项错误;每消粍0.1 mol乙二醛将转移0.4 mol电子,在Pt1极放出0.2 mol H2,0.2 mol H2在标准状况下的体积为4.48 L,故D项正确。
7.(2018福建三明高三质量检查)有一种钌(Ru)基配合物光敏染料敏化太阳能电池,其原理如图所示。下列说法不正确的是( )
A.电池工作时,能量的转化形式至少有三种
B.放电时,I-和的浓度均减小
C.Y电极为电池的正极,发生的反应为+2e-3I-
D.电池工作时,X电极上发生氧化反应
答案B
解析电池工作时,能量的转化形式至少有三种:太阳能转化为化学能,化学能转化为电能及热能,A项正确;放电时,正极电极反应式为+2e-3I-,I-浓度增大,的浓度减小,B项错误;Y电极为电池的正极,电极反应式为+2e-3I-,C项正确;电池工作时,X电极为负极,发生氧化反应,D项正确。
8
二、非选择题(本题包括2个小题,共44分)
8.(2018北京四中高三期中)(22分)某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置
分别进行的操作
现象
ⅰ.连接好装置一段时间后,向烧杯中滴加酚酞溶液
ⅱ.连接好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液
铁片表面产生蓝色沉淀
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验ⅰ中的现象是 。
②用化学用语解释实验ⅰ中的现象: 。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ⅱ中现象不能证明铁发生了电化学腐蚀,理由是 。
②进行下列实验,在实验几分钟后的记录如下:
实验
滴管
试管
现象
0.5 mol·L-1
K3[Fe(CN)6]
溶液
ⅲ.蒸馏水
无明显变化
ⅳ.1.0 mol·L-1 NaCl溶液
铁片表面产生大量蓝色沉淀
ⅴ.0.5 mol·L-1 Na2SO4溶液
无明显变化
a.以上实验表明:在 条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验ⅲ,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是 。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ⅱ结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是 (填字母序号)。
实验
试剂
现象
A
酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2)
产生蓝色沉淀
B
酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2)
产生蓝色沉淀
C
铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2)
产生蓝色沉淀
D
铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2)
产生蓝色沉淀
(4)综合以上实验分析,利用实验ⅱ中试剂,设计能证实铁发生了电化学腐蚀的实验方案。
8
答案(1)①碳棒附近溶液变红 ②O2+4e-+2H2O4OH-
(2)①K3[Fe(CN)6]可能氧化Fe生成Fe2+,会干扰由于电化学腐蚀在负极生成Fe2+的检验 ②Cl-存在 破坏了铁片表面的氧化膜
(3)AC
(4)连接好装置一段时间后,取铁片(负极)附近溶液置于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则说明负极附近溶液中产生了Fe2+,即发生了电化学腐蚀
解析(1)铁、碳棒及氯化钠溶液可组成吸氧腐蚀的原电池,铁为负极,碳棒为正极,正极反应为O2+4e-+2H2O4OH-,所以正极附近溶液显碱性,滴加酚酞溶液会变红。(2)①仅仅通过加入K3[Fe(CN)6]有蓝色沉淀只能说明溶液中有亚铁离子,由于K3[Fe(CN)6]具有氧化性,因此亚铁离子是来自于铁的腐蚀还是K3[Fe(CN)6]的氧化,此时还无法确定。②a:通过实验ⅲ得到K3[Fe(CN)6]不能氧化单质铁,根据实验ⅴ得到Na+对实验过程无影响,所以实验ⅳ的结果说明Cl-对于K3[Fe(CN)6]溶液与铁片的反应有一定影响。因此可得结论:K3[Fe(CN)6]溶液与铁的反应需要有Cl-。b:加入硫酸清洗铁的目的是除去表面的氧化膜,此时产生了蓝色沉淀,说明K3[Fe(CN)6]溶液可以与铁片发生反应,前面的实验中没有看到蓝色沉淀的原因是铁表面有氧化膜,所以前面的实验中Cl-的作用是破坏了氧化膜。(3)从题中的实验看出,实验的目的是排除氧气可能对实验的影响,即要证明前面的反应中不是氧气在氧化单质铁,所以实验中一定要排除氧气,因此选项B一定错误。而选项D中加入盐酸,盐酸与单质铁反应会生成亚铁离子,不能证明是K3[Fe(CN)6]溶液与铁片发生了反应,则选项D错误。选项A的实验证明了K3[Fe(CN)6]溶液可以与铁片发生反应,选项C的实验证明了在Cl-存在下,K3[Fe(CN)6]溶液可以与未除去氧化膜的铁片发生反应,两个实验综合,证明Cl-破坏了铁片表面的氧化膜,所以正确的是AC。(4)前面的(1)的主要问题在于,加入的K3[Fe(CN)6]可以与单质铁接触,有可能是发生了K3[Fe(CN)6]溶液与铁片的反应,所以应该取负极附近溶液置于试管中,再向其中加入K3[Fe(CN)6]溶液,观察是否有蓝色沉淀,这样就避免了发生K3[Fe(CN)6]溶液与铁片的反应。
9.(22分)(1)高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂。从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图甲所示。
①电解过程中阳极的电极反应式为 。
②图甲装置中的电源采用NaBH4(硼元素的化合价为+3价)和H2O2作原料的燃料电池,该电池工作原理如图乙所示。工作过程中该电源的正极反应式为 ,Na+由 (填“a”或“b”,下同)极区移向 极区。
(2)如图所示X是直流电源。Y槽中c、d均为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。
8
①电源上b为 (填“正”或“负”)极。
②Z槽中e为 (填“阴”或“阳”)极。
③连接Y、Z槽线路中,电子流动的方向是d (填“→”或“←”)e。
④写出c极的电极反应式: 。
⑤写出e极的电极反应式: 。
(3)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天设备。如图1所示装置,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-(O2+4e-2O2-)。
①c电极的名称为 ,d电极上的电极反应式为 。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1 CuSO4溶液,a电极上的电极反应式为 。若a电极产生56 mL(标准状况)气体,则所得溶液的pH= (不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入 (填序号)。
a.CuO b.Cu(OH)2
c.CuCO3 d.Cu2(OH)2CO3
答案(1)①Fe+8OH--6e-Fe+4H2O
②H2O2+2e-2OH- a b
(2)①负 ②阳 ③← ④2Cl--2e-Cl2↑
⑤Cu-2e-Cu2+
(3)①正极 CH4-8e-+4O2-CO2+2H2O ②4OH--4e-2H2O+O2↑ 1 ac
解析(1)①电解时阳极Fe失电子被氧化为Fe,结合电解质溶液为碱性可得阳极电极反应式为Fe+8OH--6e-Fe+4H2O;②电池工作时正极发生还原反应,结合图示原理知正极反应为H2O2得电子,被还原为OH-;电解质溶液中的阳离子(Na+
8
)应由负极区(a极)移向正极区(b极)。(2)d极附近显红色,说明d为阴极,电极反应式为2H2O+2e-H2↑+2OH-,c为阳极,电极反应式为2Cl--2e-Cl2↑;直流电源中a为正极,b为负极,Z槽中f为阴极,e为阳极,活性电极作阳极,电极本身失电子发生氧化反应,则e电极反应式为Cu-2e-Cu2+,连接Y、Z槽线路中,电子流动方向为e→d。(3)①根据电流的方向,电流从正极流向负极,即c为正极,d为负极,通入的B为CH4,电解质传导O2-,因此负极电极反应式为CH4+4O2--8e-CO2+2H2O;②a连接电源的正极,a为阳极,a电极反应式为4OH--4e-2H2O+O2↑;电解CuSO4溶液总反应方程式为2Cu2++2H2O2Cu+O2↑+4H+,假设Cu2+全部被电解成Cu,此时产生氧气的物质的量为 mol=0.025 mol,体积为0.025×22.4 L=0.56 L>56 mL,因此Cu2+没有完全电解,因此有n(H+)= mol=0.01 mol,c(H+)= mol·L-1=0.1 mol·L-1,则所得溶液的pH=1;根据上述分析,只电解部分Cu2+,因此要恢复到电解前的状态,应加入CuO或CuCO3,即ac正确。
8