- 908.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
值得关注的高考无机推断题
镇江市教研室 姚建军2008.12.2
一、无机推断题的特点
1.它集元素化合物知识、基本概念和基本理论知识为一体。具有考查知识面广、综合性强、思考容量大的特点。这种题型不但综合性考查学生在中学阶段所学的元素及其化合物知识以及物质结构、元素周期律、电解质溶液、化学平衡、氧化还原反应、化学用语等知识,而且更重要的是它能突出考查学生的综合分析判断能力、逻辑推理能力。且结构紧凑、文字表述少,包含信息多,思维能力要求高。
2.无机推断题与双基知识、有机、实验、计算均可联系,出题比较容易。在少题量的情况下,可考多个知识点,多方面的能力,从而更好地突出学科内综合,这就受到了理综卷的青睐。
3.无机推断题层次明显,区分度高,有一步推错,整题失分的可能,很容易拉分。具有很高的区分度和很好的选拔功能。
尽管它考的内容广,能力全面,层次高,但它还是离不开大纲和考纲。知识点必须是高中阶段强调掌握的基础知识和主干知识。
例题1(2005年高考湖南理综卷)26.(15分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
(1)D的化学式(分子式)是 ______________ ,E的化学式(分子式)是 ____________________
(2)A和B反应生成C的化学方程式是 ________________________________________________
(3)E和F反应生成D、H和G的化学方程式是 __________________________________________
这道题就是以NH3的实验室制法,NH3、HCl的性质为知识点出的,涉及到的知识点高中阶段相当重要,但比较简单。
答案 (1)NH3 NH4Cl (2)H2+Cl2 2HCl
(3)2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2
例题2(2004年高考湖南理综卷)28.(14分)
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为_____________________。
(2)阴极上的电极反应式为_____________________。
(3)原上层液体是_____________________________。
(4)原下层液体是_____________________________。
(5)搅拌后两层液体颜色发生变化的原因是_______。
(6)要检验上层液体中含有的金属离子,其方法是____________________,现象是_____________________。
它立意的知识点也相当基础,就是将简单的电化学,基本的卤族性质,萃取,焰色反应揉合在一起了,当时可考倒了许多考生,这道题目的得分相当低。
答案:(1)2I- - 2e- I2 (2)2H+ + 2e- H2↑
(3)KI(或NaI等)水溶液 (4)CCl4(或CHCl3等)
(5)I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
(6)焰色反应 透过蓝色钴玻璃观察火焰呈紫色(其它合理答案同样给分。例如,若③中答NaI水溶液,这里答火焰呈黄色。)
因而教师和学生在复习时都必须把握好高中阶段的基础知识和主干知识。
二、无机推断题的解题思路与技巧
1.基础知识的梳理
(1)元素周期表、元素周期律和物质结构
熟悉元素周期表和元素周期律(电子排布和周期表的关系,化合价和最外层电子数、元素所在的族序数的关系(包括数的奇偶性),微粒的半径大小和元素周期表的关系,非金属氢化物的稳定性、酸性和元素周期表的关系)。熟悉常见的分子或单质、化合物的物质结构(水、氨气、二氧化碳、金刚石、二氧化硅的结构特点,相同电子数的微粒(10电子微粒:OH-、NH4+、H3O+等;18电子微粒:H2O2和H2S、 C2H4、F2、CH3OH等)。
(2)元素化合物的性质
这里包括物理性质(颜色、状态、密度)和化学性质,因此要熟记一些典型(特殊)物质的性质、反应的条件和现象。掌握一些常见的反应形式:化合物→单质,化合物+化合物→化合物+单质,化合物→3种气体等;重要的反应:铝热反应、过氧化钠性质、Mg+CO2→、Fe3+→Fe2+、漂白粉性质、常见气体的实验室制法、电解熔融氧化铝、电解饱和食盐水、化工上的反应(硅酸盐工业、石油化工、硫酸工业、硝酸工业)。
2.无机推断题的一般解题思路
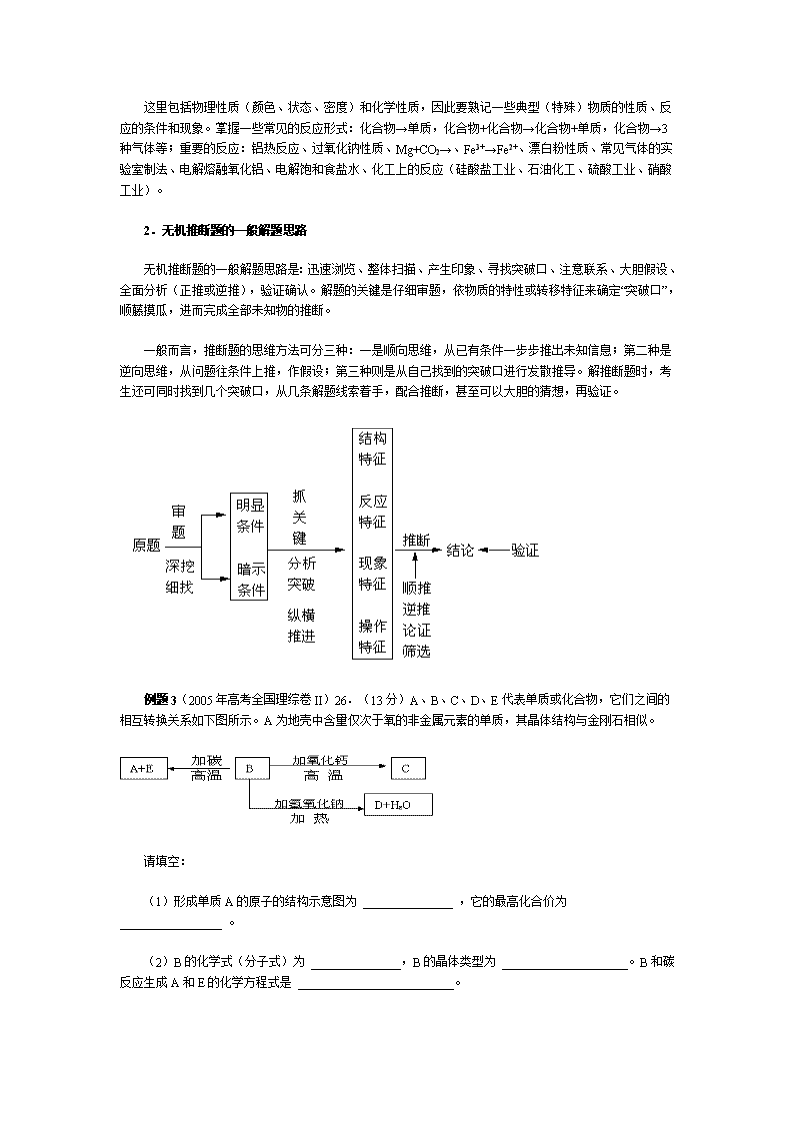
无机推断题的一般解题思路是:迅速浏览、整体扫描、产生印象、寻找突破口、注意联系、大胆假设、全面分析(正推或逆推),验证确认。解题的关键是仔细审题,依物质的特性或转移特征来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。
一般而言,推断题的思维方法可分三种:一是顺向思维,从已有条件一步步推出未知信息;第二种是逆向思维,从问题往条件上推,作假设;第三种则是从自己找到的突破口进行发散推导。解推断题时,考生还可同时找到几个突破口,从几条解题线索着手,配合推断,甚至可以大胆的猜想,再验证。
例题3(2005年高考全国理综卷II)26.(13分)A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
请填空:
(1)形成单质A的原子的结构示意图为 _______________ ,它的最高化合价为 _________________ 。
(2)B的化学式(分子式)为 _______________,B的晶体类型为 _____________________。B和碳反应生成A和E的化学方程式是 __________________________。
(3)C的化学式(分子式)为 __________________,D的化学式(分子式)为 ________________________。
这就是一个简单以硅的元素化合物知识来命题的无机推断题,我们可迅速阅读题目,找出明显条件:“A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。”分析得出A是Si;B是SiO2的结纶,其它就好解了。
3.无机推断题的解题技巧——找“题眼”或“突破口”
无机推断题“题眼”主要有以下几方面:
(1)解题突破口是“物质的特有颜色”
常见的有颜色的物质
淡黄色固体
S、Na2O2、AgBr、Ag3PO4、 AgI、FeS2
浅绿色溶液
Fe2+
红色固体
Cu、Cu2O
蓝色溶液
Cu2+
黑色块状固体
FeS
紫红色溶液
MnO4-
紫黑色固体
KMnO4、I2
棕黄色溶液
Fe3+
红棕色粉末
Fe2O3、红磷
血红色溶液
[Fe(SCN)]2+
黑色粉末,晶体
MnO2、Fe3O4、CuS、C、CuO
橙红色溶液
Br2(水)
红褐色沉淀
Fe(OH)3
蓝色晶体
CuSO4·5H2O
白色沉淀
BaSO4、BaCO3、CaCO3、AgCl
红棕色气体
Br2、NO2
蓝色沉淀
Cu(OH)2
黄绿色气体
Cl2
例题4(1999年全国高考试题)提示:某些金属氧化物跟熔融烧碱反应可生成盐,根据图2化学反应方框图填空:
图2
(1)单质F是________;
(2)写出由E生成G的离子方程式(或化学方程式)________________________________________ ;
(3)溶液I中所含金属离子是________________;
(4)由 若改用浓酸,则不能选用的浓酸是(写分子式)_____________。
【命题意图】考查铝、铁及其化合物、硝酸知识以及综合应用能力,同时考查分析判断与逻辑推理能力。
【解题思路】从题设最初条件看,其意义并不明确,但从转化关系方框图中找到“题眼”“红褐色沉淀G”可知,其含义明确,故从此入手运用逆推。由红褐色沉淀G逆推可知溶液E中含Fe2+,再由E逆推知单质C为Fe,单质F为H2;又由单质F(H2)逆推知单质B可为金属Al或者为非金属单质Si,另由溶液I加NH3·H2O转化为沉淀J,J溶于强碱溶液,可确定单质B为Al,化合物A为铁的氧化物。
【正确答案】
(1)H2 (2)4Fe2++8NH3·H2O+O2+2H2O=4Fe(OH)3↓+8NH4+
[或Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+;4Fe(OH)2+O2+2H2O=4Fe(OH)3]
(3)Al3+和Na+ (4)H2SO4(或HNO3)
例题5 根据下图所示的关系
(1)确定A、B、C、D、E、F的化学式,A为 __________,B为 _________,C为___________,D为_________,E为_____________,F为 ___________________。
(2)写有关方程式 _______________________________________________。
【命题意图】考查铁及其化合物、硫酸的知识以及综合应用能力,同时考查分析判断与逻辑推理能力。
【解题思路】从最初条件看,框图很模糊,直接得不出结论,但找到“题眼”“红褐色固体F”“ 黑色晶体B”就可迅速得出红褐色固体F是Fe(OH)3 从而得出A为Fe,B为Fe3O4,C为FeSO4,D为Fe2(SO4)3,E为Fe(OH)2。
(2)解题突破口是“特征反应现象”
常见的特征反应现象及对应物质
(a)焰色反应显黄色的元素是Na,显紫色(透过钴玻璃)的元素是K
(b)有臭鸡蛋气味或能使湿润的Pb(Ac)2试纸变黑的气体是H2S
(c)在空气中由无色迅速变为红棕色的气体是NO
(d)使品红溶液褪色的往往是SO2 (Cl2使品红溶液褪色后不恢复)
(e)能使淀粉变蓝的是I2
(f)与碱溶液反应生成白色沉淀且放置空气中变灰绿色最终变红褐色的离子是Fe2+
(g)滴入SCN- 溶液显血红色以及遇苯酚显紫色的离子是Fe3+
(h)既能跟酸反应又能跟碱反应且生成气体的物质一般是Al,NH4HCO3 ,(NH4)2CO3 ,NH4HSO3,(NH4)2SO3,(NH4)2S,NH4HS
(i)能使湿润的红色石蕊试纸变蓝的气体是NH3
(j)与碱反应产生气体的物质是Al、Si、铵盐,产生气体一般是H2、NH3
(k)与水反应产生气体的物质一般是Na 、F2 、Na2O2
(l)既能酸反应又能与碱反应的物质是Al 、Al2O3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐
(m)既产生沉淀又产生气体的物质一般是CaC2、Al2S3、Mg3N2 与H2O; S2O32-与H+;CO32-、HCO3-、 SO32-、 HSO3-、 S2-、HS- 与Al3+;CO32-、HCO3-与Fe3+
例题6 A、B、C、D四种元素原子核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:
1.写出B、D形成化合物电子式__________________。
2.写出下列有关物质化学式:E _____________, J _________________。
3.写出C单质与H水溶液反应的离子方程式_____________________________。
【命题意图】考查盐类的双水解,两性氢氧化物,卤离子的检验,焰色反应等知识以及综合应用能力、分析判断与逻辑推理能力,同时考查学生的化学用语等。
【解题思路】从题干看,基本得不出什么直接的结论。但框图中有几个“特征的反应现象”作“题眼”:a 臭鸡蛋气味气体;b 白色胶状沉淀溶于NaOH溶液;c 先加AgNO3溶液,再加稀HNO3产生白色沉淀;d 焰色反应:紫色;可分别得出气体是H2S、白色胶状沉淀是Al(OH)3、无色溶液I是KCl,从而迅速得出其他结论。
【正确答案】
1. 2.AlCl3 NaAlO2 3.Cl2+H2S=S↓+2H++2Cl-
(3)解题突破口是“特征反应转化关系”
掌握一些特征反应转化关系:
(a)A为NH3、H2S、S、CH4、C、Na,D为O2;A为Cl2,D为Fe;A为Al3+,D为OH-;A为AlO2-,D为H+;A为C,D为H2O
(b)注意几个典型转化关系
例题7 下列关系图中,A是一种正盐,D的分子式比C的大16,E是酸,当X是强酸或强碱时都有如下反应关系:
当X是强酸时,A、B、C、D、E均含同一元素;当X是强碱时,A、B、C、D、E均含另一元素。回答下列问题(用化学式)
1、A是______,Y是______ ,Z是______。
2、当X是强酸时,E是 ______ ; 当X是强碱时,E是 ______。
【命题意图】考查一种物质能与酸与碱作用产生气体,考氮与硫等元素化合物的知识,以及推理、综合运用知识的能力。
【解题思路】突破口是:a.当X无论是强酸或强碱都有如下反应关系 b.B、C、D中间两次与Y作用特殊关系,再利用其他已知就容易解了。
【正确答案】1.(NH4)2S;O2;H2O 2.H2SO4 ;HNO3
(4)解题突破口是“特殊反应条件”
(a)高温:铝热反应,制玻璃,烧石灰,炼铁,制水煤气,制粗硅,水与Fe反应等。
(b)高温高压、催化剂
(c)加热、催化剂
(d)放电 等等。
例题8 物质A—F有如下转化关系,反应均是高温下进行,(必要时要用催化剂)A是常见金属单质,B是最常见溶剂,E分子与N2电子数相同。
1.写出①化学方程式:__________________________
2.写出③化学方程式:______________________________
3.写出一个B作为还原剂的方程式:___________________
4.写出一个F作为氧化剂的方程式:____________________
【命题意图】本题以高温时的常见反应为载体,考查的是高温时铁与水的反应,CO与水的的反应,氧化物被H2的还原。既考了高中的主干知识,又考了科内知识综合,还考了综合的推理判断能力。
【解题思路】本题题干和框图都很模糊,根本得不出什么结论。但如果熟悉高温下常见反应,就可以此为突破口,再根据A是常见金属单质、B是最常见溶剂,就可以得出相应的答案。
【正确答案】
1.3Fe+4H2O(气) Fe3O4+4H2↑ 2.CO+H2O(气) CO2+H2
3.2F2+2H2O=4HF+O2 4.2Mg+CO2 2MgO+C
(5)解题突破口是“重要工业生产反应”
中学重要工业生产反应
1.煅烧石灰石 2.煅烧黄铁矿 3.二氧化硫的催化氧化 4.氨的催化氧化 5.合成氨 6.电解饱和食盐水 7.工业制盐酸 8.高炉炼铁 9.工业制取漂粉精 10.工业制水煤气 11.硅酸盐工业等。
例题9 根据下列框图关系填空,已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为无色液体,H与E相对分子质量之间的关系为:Mr(H) -Mr(E) =34,又知C焰色反应火焰呈黄色。
(1)化合物A中所包含的化学键有:_________________________ 。
(2)反应④的离子方程式:_________________ 。反应⑤的化学方程式:_____________________ 。
(3)已知每生成16g E,放出106.5 kJ热量,则反应①的热化学方程式为:_____________________ 。
【命题意图】考查中学所学的一工业生产原理,并结合元素化合物的知识,综合考查过氧化钠、铁的化合物的性质,有一定的综合性。题目有一定难度,除有扎实的基本功外,还要有一定灵活运用知识的能力,强的推理能力。
【解题思路】抓住反应①、③是工业生产中的重要反应这个突破口,再结合A是固体,X是无色液体得出反应①是煅烧制SO2,③是制SO3,固体B与水作用产生O2,则固体B为过氧化钠,其他就好解了。
【正确答案】
(1)离子键、非极性键
(2)Fe2O3 + 6H+ = 2Fe3+ + 3H2O Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓+3Na2SO4
(3)FeS2(s) + 11/4 O2(g) = 1/2 Fe2O3(s)+ 2SO2(g); △H=-852kJ/mol
(6)解题突破口是“特征数据”(反应物物质的量比、相对分子质量、化合物中离子个数比、电子总数、化合价等)
例题10 已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见的化合物,Y的摩尔质量数值比Z的小16,乙、丙的摩尔质量相同,B的摩尔质量比D的小2,B、X的摩尔质量相同,各物质转化关系如下:
1、写出下列有关物质化学式:丙_________;B _________。
2、写出Y→Z反应化学方程式__________________________。
【命题意图】本题以两单质为起点,考查中学所学常见单质化合物的化学性质,并把所有反应设置为氧化还原反应,考查中学的主干知识,有一定的综合性,有一定难度。要求学生必须有一定的基本功,还要有一定灵活运用知识的能力。
【解题思路】这类题从转化图上各物质得不出什么重要结论,但要善于抓住物质转化时相对分子质量的变化(例CO→CO2,NO → NO2,SO2→SO3转化时分子中都增加1个氧原子,相对分子质量变化均为16),并把这一重要信息作为突破口;同时要有大胆的猜测能力;Y的摩尔质量数值比Z的小16就可认为丙为O2,再由乙、丙的摩尔质量相同,推出乙为硫,从而问题就简单了。
【正确答案】 1.O2 Na2O2 2. 2Na2SO3 +O2 = 2Na2SO4
(7)解题突破口是“物质结构和元素周期律的知识”
例题11 A、B、C、D、E是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
(1)写出元素符号:A____________,E____________。
(2)D在周期表中位于第_________周期第____________族。
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示)
________________________________________________________________。
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式___________。
(5)A、B、D可形成A2B2D4型化合物,该化合物的名称是__________________。
【命题意图】本题是一类典型考查物质结构和元素周期律的知识题目,以常见的短周期元素为载体,考查学生的推理判断能力,同时考查学生在无机推断中有碳元素时会与一些有机物联系。
【解题思路】抓短周期元素,原子序数依次增大,E的阳离子与D的阴离子都比A阳离子多2个电子层,并以此为突破口,结合D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物,B是形成化合物种类最多的元素,各元素就很好推了。
【正确答案】(1)H,Na (2)2,VI A (3)E > B > C > D > A
(4)NH4HCO3 NH3↑+H2O+CO2↑
(5)乙二酸 (草酸)
(8)以化学计算结论为突破口
例题12 (2005年高考化学试题江苏卷II)26.(10分)水垢可以看作由多种物质组成的混合物,为研究含有Ca2+、Mg2+、HCO的水所形成水垢的化学组成,取干燥的水垢6.32g,加热使其失去结晶水,得到5.78g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到11.82g沉淀。
(1)通过计算确定A中是否含有碳酸镁;
(2)5.78g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82g,通过计算确定A中各成分的物质的量,并计算出水垢中碳酸盐的质量分数。
【解题思路】以计算的结果一步一步得出结论
(1)根据题意
n(CO2) = n(BaCO3) =11.82g ÷197g/mol = 0.06 mol
若CO2全部来自CaCO3的分解,
则m(CaCO3) = 0.06mol × 100g/mol = 6.00g> 5.78g
不合题意,所以,A中一定含有MgCO3
(2)m(CO2) = 0.06 mol × 44g/mol = 2.64g
m(H2O) = 2.82g — 2.64g = 0.18g
n[Mg(OH)2] = n(H2O) = 0.18g÷18g/mol = 0.01 mol
m[Mg(OH)2] = 0.01 mol×58g/mol = 0.58g
n(CaCO3) + n(MgCO3) = 0.06 mol n(CaCO3)×100g/mol + n(MgCO3)×84 g/mol + 0.58g = 5.78g
解得:n(CaCO3) = 0.01 mol n(MgCO3) = 0.05 mol
三、无机推断题的教学体验
无机推断题考查知识面广,考题内容多为常见元素及其化合物知识,常与双基知识、有机、实验、计算联系,试题的容量比较大。但推断的物质不会超出中学范围所学的元素及其化合物知识,要学生书写的内容也不过是常用的化学用语。这类试题学生失分的原因有以下几点:
一是学生对元素及其化合物的知识不够全面与熟悉;
二是学生的分析判断能力与逻辑推理能力欠缺;三是学生的化学用语掌握不够;四是学生对这种试题练习不够,有一种恐惧心理;五是学生缺乏对这种题型的解题思路。因此,要想帮助学生解好推断题,教师要指导学生对这种试题做专题训练,在专题训练的时候,一要做学生的思想工作,让他们了解无机推断题的特点与考查的知识点与能力要求;二要求学生自己整理或帮助学生整理归纳元素及其化合物知识,要让他们熟练掌握一些特征的性质与变化;三要通过示例分析总结出常见的解题思路与方法;五要让学生训练考查不同知识点与不同解题思路的的各种试题,让他们在训练中找感觉,同时教师要认真批改学生的练习,并及时纠正他们的化学用语的表达,以求达到科学化、标准化。
注意学生答这类题时常见的错误:如把答案写在密封线内,阅卷时无法看到答案而不给分;要求写元素名称而错写成元素符号,而要求写元素符号又答成元素名称或分子式;要求写物质名称而错写成分子式;要求写结构简式的错写成分子式或名称;要求写离子方程式而错写成化学方程式;要求画离子结构示意图而错答为原子结构示意图;把相对原子质量、相对分子质量、摩尔质量的单位写成“克”;把物质的量、摩尔浓度、气体体积、质量、溶解度、密度、压强等的单位漏掉;化学方程式、离子方程式不配平;热化学方程式不注明物质的状态等;还有的没把整题看懂,能答得出的有些问都不答。因此答题时必须按题目要求来回答,规范学生的答题行为,同时要鼓励学生敢于答这种题。
相关文档
- 新课标备战高考数学理二轮专题复习2021-05-1310页
- 北京市2012年高考数学最新联考试题2021-05-1315页
- 2020-2021年高考生物一轮复习知识2021-05-1315页
- 2020版高考历史一轮总复习专题七考2021-05-136页
- 全国高考文综试题及答案福建卷2021-05-1315页
- 山东省春季高考 语文 第一册 复习2021-05-139页
- 虚拟语气2018高考专项复习讲解练习2021-05-138页
- 2012高考二轮复习生物学案10现代生2021-05-138页
- 2018高考语文考前知识梳理2021-05-1312页
- 2020版高考生物二轮复习 非选择题2021-05-134页