- 1.13 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第8讲电化学基础
[主干知识·数码记忆]
一、小试能力知多少(判断正误)
(1)(2013·浙江高考)多孔碳可用作氢氧燃料电池的电极材料(√)
(2)(2012·江苏高考)Zn具有还原性和导电性,可用作锌锰干电池的负极材料(√)
(3)(2012·广东高考)锂碘电池,该电池反应为: 2Li(s)+I2(s)===2LiI(s)则碘电极作该电池的负极(×)
(4)(2013·福建高考)以CO和O2构成的碱性燃料电池的负极反应式为 CO+4OH--2e-===CO+2H2O(√)
(5)(2012·海南高考)锌与稀硫酸反应时,要加大反应速率可滴加少量硫酸铜(√)
二、必备知识掌握牢
1.明确原电池构成的条件
2.原电池正负极判断的四种方法
(1)根据构成原电池两极的电极材料判断,一般是较活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极;
(2)根据电子流动方向或电流方向判断,电子流动方向:由负极流向正极;电流方向:由正极流向负极。
(3)根据原电池电解质溶液中离子的移动方向判断,阳离子向正极移动,阴离子向负极移动。
(4)根据原电池两极发生的变化判断,原电池的负极发生氧化反应;正极发生还原反应。
三、常考题型要明了
考查电极反应式的书写及原电池原理
典例
考查原电池的工作原理
演练1
考查新型电池的工作原理
演练2
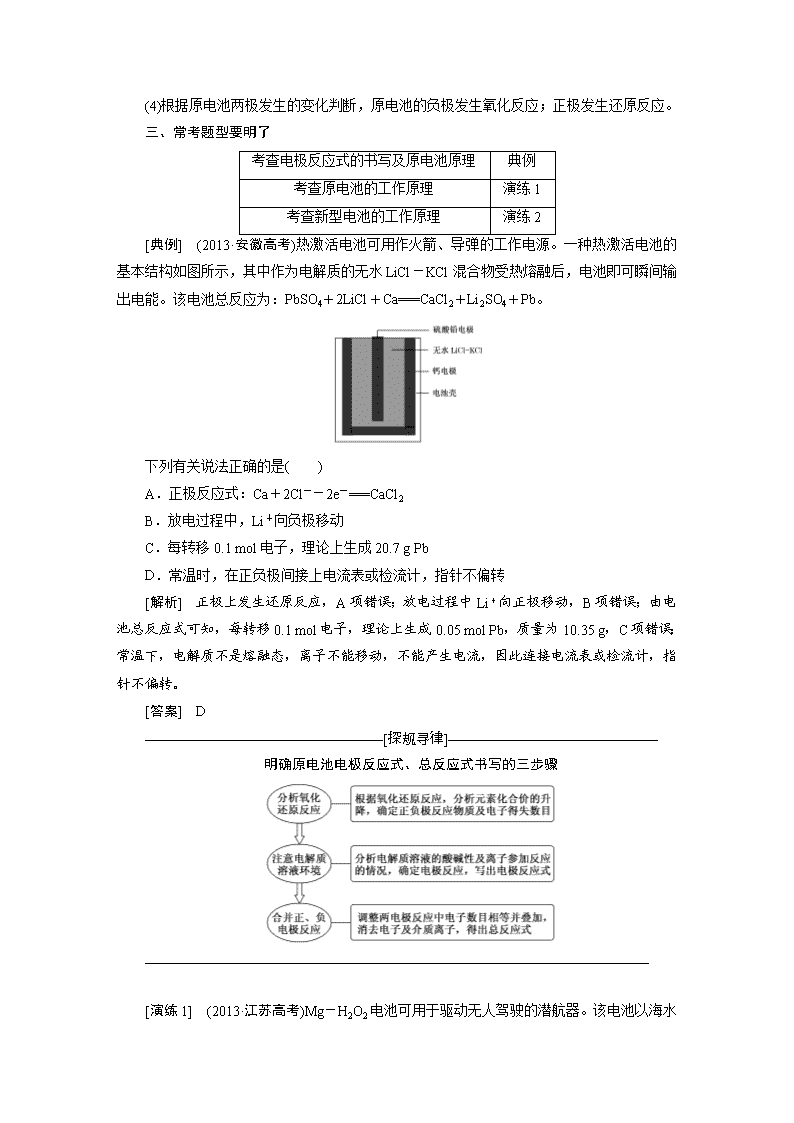
[典例] (2013·安徽高考)热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
下列有关说法正确的是( )
A.正极反应式:Ca+2Cl--2e-===CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
[解析] 正极上发生还原反应,A项错误;放电过程中Li+向正极移动,B项错误;由电池总反应式可知,每转移0.1 mol电子,理论上生成0.05 mol Pb,质量为10.35 g,C项错误;常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转。
[答案] D
————————————————————————————————
明确原电池电极反应式、总反应式书写的三步骤
————————————————————————————————————
[演练1] (2013·江苏高考)Mg-H2O2
电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工作时,下列说法正确的是( )
A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
解析:选C 本题考查原电池原理,意在考查考生对电
化学知识的迁移和运用能力。根据题意可知电池的总反应为:Mg+H2O2+2H+===Mg2++2H2O。Mg电极是该电池的负极,A错误。H2O2在正极发生还原反应,B错误。石墨电极的电极反应式为:H2O2+2H++2e-===2H2O,由于水电离出的H+不断被消耗,所以该电极附近溶液的pH增大,C正确。在原电池中,阴离子向负极移动,D错误。
[演练2] (2013·新课标卷Ⅱ)“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )
A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三价铝离子
C.正极反应为:NiCl2+2e-===Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
解析:选B 负极是液体金属Na,电极反应式为:Na-e-===Na+;正极是Ni,电极反应式为NiCl2+2e-===Ni+2Cl-;总反应是2Na+NiCl2===2NaCl+Ni。所以A、C、D正确,B错误。
一、小试能力知多少(判断正误)
(1)(2013·江苏高考)电解法精炼铜时,以粗铜作阴极,纯铜作阳极(×)
(2)(2012·山东高考)以CuSO4
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,溶液中的Cu2+向阳极移动(×)
(3)(2011·山东高考)电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al(×)
(4)(2012·山东高考)电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA阿伏加德罗常数)(×)
(5)(2011·新课标全国卷)电解58.5 g熔融的NaCl,能产生标准状况下22.4 L氯气,23.0 g金属钠(×)
二、必备知识掌握牢
1.牢记电解池的电极反应及其放电顺序
(1)阳离子在阴极上的放电顺序:Ag+>Fe3+>Cu2+>H+>……
(2)阴离子在阳极上的放电顺序:S2->I->Br->Cl->OH->……
2.判断电解池阴阳极的四种方法
(1)根据所连接的外加电源判断,与直流电源正极相连的为阳极,与直流电源负极相连的为阴极。
(2)根据电子流动方向判断,电子流动方向为:电源负极流向阴极,阳极流向电源正极。
(3)根据电解池里电解质溶液中离子的移动方向判断,阳离子向阴极移动,阴离子向阳极移动。
(4)根据电解池两极产物判断,一般情况下:
①阴极上的现象是:析出金属(质量增加)或有无色气体(H2)放出;
②阳极上的现象是:有非金属单质生成,呈气态的有Cl2、O2或电极质量减小(活性电极作阳极)。
3.掌握电解的四大类型及规律
类型
电极反应特点
实例
电解物质
电解液
浓度
pH变化
电解液复原
电解水型
阴极:
4H++4e-===
2H2↑
NaOH
H2O
增大
增大
加H2O
阳极:4OH--4e-
===2H2O+O2↑
H2SO4
减小
Na2SO4
不变
电解电
解质型
电解质的阴、阳离子分别在两极放电
HCl
电解质
减小
增大
通HCl气体
CuCl2
……
加CuCl2
放H2
生碱型
阴极:放H2生成碱
阳极:电解质阴离子放电
NaCl
电解质
和水
生成新
电解质
增大
通HCl
气体
放O2
生酸型
阴极:电解质阳离子放电
阳极:放O2生成酸
CuSO4
减小
加CuO
三、常考题型要明了
考查电解原理及氧化还原反应
典例
考查电解原理的应用
演练1
考查电解规律及电极的判断
演练2
[典例] (2013·全国大纲卷)电解法处理酸性含铬废水(主要含有Cr2O)时,以铁板作阴、阳极,处理过程中存在反应Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是( )
A.阳极反应为Fe-2e- ===Fe2+
B.电解过程中溶液pH不会变化
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol Cr2O被还原
[解析] 以铁板作阴、阳极,所以铁在阳极被氧化,A项正确;由题目提示的离子方程式可知,阳极产生的Fe2+被氧化,同时有氢离子参与反应,所以电解过程中溶液的pH会升高,B项错误;因为氢离子在阴极放电,不断产生氢氧根离子,所以反应过程中会有Fe(OH)3沉淀生成,C项
正确;从题目提供的离子方程式可知,1 mol Cr2O参与反应转化成Cr3+时,需6 mol Fe2+,故电路中需转移12 mol电子,D项正确。
[答案] B
—————————————————————————————————
电解池中电极反应式的书写步骤
——————————————————————————————————————
[演练1] (2013·北京高考)用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是( )
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-===Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
解析:选A 通过图中离子的运动状态可判断连接a的为阴极,连接b的为阳极,故a端为直流电源的负极,b端为直流电源的正极,A项正确;CuCl2在水溶液中就能发生电离,而不是通电的结果,B项错误;阳极发生氧化反应,即2Cl--2e-=== Cl2↑,C项错误;阴极发生还原反应,析出Cu,阳极发生氧化反应,在阳极附近可观察到黄绿色气体,D项错误。
[演练2] (2013·海南高考)下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b②>①>③ B.②>①>③>④
C.④>②>③>① D.③>②>④>①
[解析] ②中Fe作原电池的负极,Fe的腐蚀加快;③
中Fe作原电池的正极,铁受到保护;④中Fe作电解池的阳极,Fe的腐蚀比②更快。故Fe的腐蚀由快到慢的顺序为④>②>①>③。
[答案] A
————————————————————————————————
金属腐蚀快慢的判断
—————————————————————————————————————
[演练1] (2013·北京高考)下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A.水中的钢闸门连接电源的负极
B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜
D.地下钢管连接镁块
解析:选A 水中的钢闸门连接电源的负极,钢闸门为阴极,从而得以保护,A项正确;金属护栏表面涂漆的原理是隔绝金属护栏与空气接触,从而减缓金属护栏的腐蚀,B项错误;汽车底盘喷涂高分子膜的原理也是隔绝与空气的接触,C项错误;地下钢管连接镁块,形成了原电池,属于牺牲阳极的阴极保护法,D项错误。
[演练2] (2012·山东高考)下列与金属腐蚀有关的说法正确的是( )
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
解析:选B 图a中,铁棒发生电化学腐蚀,靠近底端的部分与氧气接触少,腐蚀程度较轻, 选项A错误;图b中开关置于M时,Cu-Zn合金作负极,由M改置于N时,Cu-Zn合金作正极,腐蚀速率减小,选项B正确;图c中接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt极上放出,选项C错误;图d中Zn-MnO2干电池自放电腐蚀主要是由Zn的氧化反应引起的,选项D错误。
将原电池和电解池结合在一起,综合考查化学反应中的能量变化、氧化还原反应、化学实验和化学计算等知识,是高考试卷中电化学部分的重要题型。该类题目的考查内容通常有以下几个方面:电极的判断、电极反应方程式的书写、实验现象的描述、溶液中离子的移动、pH的变化以及电解质溶液的恢复、运用电子守恒处理相关数据等。
[例题] (2012·海南高考)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为________________________________、
________________________________________________________________________;
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是________,电解氯化钠溶液的总反应方程式为____________________________________________________;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为________________________(法拉第常数F=9.65×104 C·mol-1,列式计算),最多能产生的氯气体积为________L(标准状况)。
[解析] (1)总反应式为:CH4+2O2+2OH-===CO+3H2O,正极反应式为2O2+4H2O+8e-===8OH-
,则负极反应式由总反应式减正极反应式得到;(2)三个池可看出一二两池为串联的电源,其中甲烷与氧气反应是还原剂,所在电极为负极,因而与之相连的b电极为阴极,产生的气体为氢气;(3)1 mol甲烷氧化失去电子8 mol,电量为8×96 500 C,因题中虽有两个燃料电池,但电子的传递只能用一个池的甲烷量计算,1 L为1/22.4 mol,可求电量;甲烷失电子是Cl-失电子数的8倍,则得到氯气为4 L(CH4——8Cl-——4Cl2)
[答案] (1)2O2+4H2O+8e-===8OH-,CH4+10OH--8e-===CO+7H2O
(2)H2 2NaCl+2H2O电解,2NaOH+H2↑+Cl2↑
(3)×8×9.65×104 C·mol-1=3.45×104 C 4
[名师支招]
多池串联装置中电池类型的判断方法
1.直接判断
非常直观明显的装置,如燃料电池、铅蓄电池等在电路中,则其他装置为电解池。如图所示,A为原电池,B为电解池。
2.根据电池中的电极材料和电解质溶液判断
原电池一般是两种材料不同的电极;而电解池则一般都是两个惰性电极。原电池中的电极材料和电解质溶液能发生自发氧化还原反应,电解池的电极材料一般不能和电解质溶液自发反应。如图所示,B为原电池,A为电解池。
3.根据电极反应现象判断
在某些装置中根据电极反应或反应现象可判断电极,并由此判断电池类型,如图所示,若C极溶解,D极上析出Cu,B极附近溶液变红,A极上放出黄绿色气体,则可知乙是原电池,D是正极, C是负极;甲是电解池, A是阳极,B是阴极。B、D极发生还原反应,A、C极发生氧化反应。
[针对训练]
1.(2012·安徽高考)某兴趣小组设计如下图所示的微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。
下列有关描述正确的是( )
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-通电,Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应式为:Cl2+2e-===2Cl-
D.断开K1,闭合K2时,石墨电极作正极
解析:选D 断开K2,闭合K1时,该装置为电解池,由两极均有气泡产生可知铜电极为阴极,总反应的离子方程式为2Cl-+2H2OCl2+H2+2OH-,A项错;由此可知铜电极附近溶液中因有OH-生成,溶液变红色,B项错;断开K1,闭合K2时,装置为原电池,铜极上产生的氢气发生氧化反应,电极反应式为H2-2e-+2OH-===2H2O,C项错;由此可知铜电极为负极,石墨电极为正极,故D项正确。
2.如图是一个电化学过程的示意图。
请回答下列问题:
(1)图中甲池是________(填“原电池”、“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”、“负极”、“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:
________________________________________________________________________________
________________________________________________________________________。
(4)乙池中反应的化学方程式为_____________________________________________,
当乙池中B(Ag)极质量增加5.4 g,甲池中理论上消耗O2的体积为________L(标准状况下),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是________。
A.MgSO4溶液 B.CuSO4溶液
C.NaCl溶液 D.AgNO3溶液
解析:(1)根据图中信息,甲池是燃料电池,即为原电池,通入氧气的电极为电池的正极,通入CH3OH的电极为负极,其他两个装置为电解池。
(2)A与电池的正极相连接,故为阳极。
(3)通CH3OH的电极为负极,发生氧化反应,电极反应为CH3OH—6e-+8OH-===CO+6H2O。
(4)乙池是电解AgNO3溶液,电解方程式为4AgNO3+2H2O4Ag+4HNO3+O2↑;当乙池中B(Ag)极质量增加5.4 g时,得到电子的物质的量为 mol=0.05 mol,由电子守恒可知,生成氧气的物质的量为 mol=0.012 5 mol,在标准状况下的体积为0.012 5 mol×22.4 L/mol=0.28 L。此时丙池中某电极析出1.6 g某金属,设该金属显示+2价,则M=1.6 g/(0.5 mol/2)=64 g/mol,则该金属为Cu,故选B。
答案:(1)原电池 (2)阳极
(3)CH3OH-6e-+8OH-===CO+6H2O
(4)4AgNO3+2H2O4Ag+O2↑+4HNO3 0.28 B
1.(2013·海南高考)Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+ Mg===Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C.不能被KCl 溶液激活
D.可用于海上应急照明供电
解析:选D 根据氧化还原判断,Mg为还原剂是负极、失电子,所以A、B都错误,电解质溶液可用KCl 溶液代替,C错误。
2.(2012·海南高考)下列叙述错误的是( )
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀
解析:选C A、B选项,都是原电池原理,铁作负极,使铁更易腐蚀;D是牺牲阳极的阴极保护法。
3.(2012·大纲全国卷)①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②
相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④ B.①③④②
C.③④②① D.③①②④
解析:选B ①②相连时,外电路电流从②流向①,说明①为负极;①③相连时,①为负极;②④相连时,②上有气泡,说明④为负极;③④相连时,③的质量减少,说明③为负极。综上所述可知,这四种金属活动性由大到小的顺序为①③④②,选项B正确。
4.(2012·海南高考)下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
A.HCl、CuCl2、Ba(OH)2
B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2
D.NaBr、H2SO4、Ba(OH)2
解析:选C 电解基本原理考查。电解时只生成氧气和氢气,则电解质所含阳离子在金属活动性顺序表中位于铜之前,阴离子不是简单离子。
5.工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )
A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-===Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
解析:选B 由图可知装置1和2都是原电池。而在图1装置铜电极上产生大量的无色气泡,说明此时铜电极是正极,溶液中的氢离子放电,即金属Cr的活泼性强于Cu的。而图2装置中铜电极上无气体产生,说明此时铜电极是负极。这是由于电解质发生了变化,Cr在硝酸中不反应,类似于钝化,而铜可以被氧化。所以A、C、D均是错误的。
6.(2013·新课标卷Ⅰ)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是( )
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S===6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
解析:选B 本题考查电化学知识在生活中的应用,意在考查考生运用电化学原理解决实际问题的能力。根据信息可知在银器处理过程中运用了原电池原理,铝质容器作负极,电极反应为2Al-6e-===2Al3+;银器作正极,电极反应为3Ag2S+6e-===6Ag+3S2-;继而Al3+和S2-发生互相促进的水解反应:2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑,故原电池的总反应为:3Ag2S+2Al+6H2O===6Ag+2Al(OH)3+3H2S↑,故C错误。黑色褪去的原因是Ag2S被还原为Ag,此过程中银器质量逐渐减小,故A、D错误,B正确。
7.如下图所示,用铅蓄电池电解100 g 10.0%的硫酸钠溶液,经过一段时间后,测得溶液质量变为95.5 g。下列说法正确的是( )
A.电路中转移0.25 mol电子
B.铅蓄电池中消耗0.5 mol H2SO4
C.铅蓄电池的负极反应式为:PbSO4+2H2O-2e-===PbO2+4H++SO
D.Fe电极发生的电极反应为Fe-2e-===Fe2+
解析:选B 电解硫酸钠溶液时,铁作阴极,D项错误;电解硫酸钠溶液其实质上是电解水,根据题意可知有4.5 g水被电解,转移电子的物质的量为4.5 g/18 g·mol-1×2=0.5 mol,A项错误;铅蓄电池的负极应为Pb失去电子,C项错误。用排除法可知B正确。
8.(2013·天津高考)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l)
电解池:2Al+3H2OAl2O3+3H2↑
电解过程中,以下判断正确的是( )
电池
电解池
A
H+移向Pb电极
H+移向Pb电极
B
每消耗3 mol Pb
生成2 mol Al2O3
C
正极:PbO2+4H++2e-===Pb2++2H2O
阳极:2Al+3H2O-6e-===Al2O3+6H+
D
解析:
选D 本题考查电化学知识,意在考查考生提取信息的能力、判断能力和知识的迁移能力。原电池中阳离子向正极移动,所以H+移向PbO2极,电解池中,阳离子移向阴极,即H+移向Pb极,A项错误;原电池中消耗3 mol Pb,转移6 mol e-,在电解池中转移6 mol e-生成1 mol Al2O3,B项错误;原电池中正极反应为PbO2+2e-+4H++SO===PbSO4+2H2O,C项错误;原电池中Pb失电子转化为PbSO4,所以Pb电极质量增加,而电解池中Pb作阴极,不参与反应,所以质量不变,D项正确。
9.(2013·浙江高考)电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
已知:3I2+6OH-===IO+5I-+3H2O
下列说法不正确的是( )
A.右侧发生的电极反应式:2H2O+2e-===H2↑+2OH-
B.电解结束后,右侧溶液中含有IO
C.电解槽内发生反应的总化学方程式:KI+3H2OKIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变
解析:选D 本题考查了电化学知识,意在考查考生对新型电池的分析能力。装置图中左侧电极为阳极,I-失去电子生成I2,右侧电极为阴极,H2O得到电子生成H2,A、C项正确;电解结束后,左侧溶液中的IO经阴离子交换膜进入右侧,B项正确;D项,如果将阴离子交换膜换为阳离子交换膜,那么阴极产生的OH-不会与I2发生反应,故电解槽内发生的总化学反应要变化,D项错误。
10.(1)如图1是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。
回答下列问题:
①写出A极发生的电极反应式_____________________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应与________极相连(填“C”或“D”)。
③当消耗标准状况下2.24 L CO时,C电极的质量变化为________。
(2)工业上,可用铁作阳极,电解KOH溶液制备K2FeO4。
①电解过程中,OH-向_____________ (填“阴”或“阳”)极移动,阳极的电极反应式为________________________________________________。
②若阳极有28 g Fe溶解,则阴极析出的气体在标准状况下的体积为________L。
解析:(1)由图可知A为负极,B为正极,D为阳极,C为阴极。
(2)根据电解原理,阴离子向阳极移动,阳极发生氧化反应,可确定阳极反应式为Fe-6e-+8OH-===FeO+4H2O,阴极反应式为2H++2e-===H2↑。
答案:(1)①CO-2e-+CO===2CO2 ②D ③增加6.4 g
(2)①阳 Fe-6e-+8OH-===FeO+4H2O
②33.6
11.(2013·山东高考)金属冶炼与处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是________。
a.Fe2O3 b.NaCl
c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2===4CuSO4+2H2O,该反应的还原剂是________。当1 mol O2发生反应时,还原剂所失电子的物质的量为________mol。向CuSO4溶液中加入镁条时有气体生成,该气体是________。
(3)右图为电解精炼银的示意图,________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为_____________________________。
(4)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用是_____________________________________________。
解析:本题考查金属冶炼与处理,意在考查考生对金属冶炼及处理中化学原理的理解能力。(1)Na、Al的金属活动性较强,冶炼时选择电解法。(2)该反应中Cu、S的化合价升高,因此还原剂为Cu2S。反应中O2中O由0价变为-2价,1 mol O2发生反应,得4 mol电子,根据得失电子守恒,则还原剂失电子为4 mol。CuSO4溶液中由于Cu2+水解显酸性,加入镁条,产生的气体为H2。(3)电解精炼银时,粗银作阳极,与电源正极相连。b极产生的红棕色气体为NO2,电极反应式为NO+e-+2H+===NO2+H2O。(4)食盐水的作用是做电解质溶液,形成原电池。
答案:(1)b、d (2)Cu2S 4 H2 (3)a NO+2H++e-===NO2+H2O (4)做电解质溶液(或导电)
12.Ⅰ.(2012·福建高考)(1)电镀时,镀件与电源的________极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成镀层。若用铜盐进行化学镀铜,应选用________(填“氧化剂”或“还原剂”)与之反应。
Ⅱ.(2012·重庆高考)尿素[CO(NH2)2]是首个由无机物人工合成的有机物。人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图:
(1)电源的负极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为________、________。
(3)电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
解析:Ⅰ.(1)电镀时,镀层金属作电解池的阳极,镀件作电解池的阴极,与电源的负极相连。
(2)镀铜是将Cu2+变成Cu,需要加入还原剂与之反应。
Ⅱ.(1)图中产生氢气的电极为阴极,与阴极相连的电极为负极,所以B为负极。
(2)根据信息,阳极上先产生氯气,氯气具有氧化性,尿素中的氮原子为-3价,具有还原性,两者相遇发生氧化还原反应。
(3)反应过程中实际上发生两个反应(条件略去):2NaCl+2H2O2NaOH+Cl2↑+H2↑、CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl,两方程式相加消去中间产物可得总反应方程式:CO(NH2)2+H2O===N2↑+CO2↑+3H2↑,由此可知反应的最终结果是没有酸或者是碱生成,阴极室的酸碱性不会发生改变;两极产生的气体是氢气、氮气和二氧化碳,根据化学方程式若设氢气的量为x,氮气和二氧化碳各为,则x+x+x=,解得x=0.36 mol。
m[CO(NH2)2]=×60 g·mol-1=7.2 g。
答案:Ⅰ.(1)负 (2)还原剂
Ⅱ.(1)B (2)2Cl--2e-===Cl2↑ CO(NH2)2+H2O+3Cl2===N2↑+CO2↑+6HCl
(3)不变 7.2
13.如图所示三套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀,表明铁被________(填“氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应式为____________
________________________________________________________________。
(2)装置2中的石墨是________极(填“正”或“负”),该装置发生的总反应的离子方程式为________________________________________________________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为________极;甲烧杯中铁电极的电极反应式为_____________________。
②乙烧杯中电解反应的离子方程式为_______________________________________。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体标准状况下的体积为________mL。
解析:(1)装置1,由石墨棒附近的溶液变红可知,石墨棒作正极,电极反应式为O2+4e-+2H2O===4OH-,铁钉作负极,发生氧化反应。
(2)由装置2两电极活泼性强弱得Cu一定是负极,总反应的离子方程式即该装置中自发的氧化还原反应:2Fe3++Cu===2Fe2++Cu2+。
(3)①由甲中石墨电极附近首先变红可知该极H+放电,即该极为阴极,Fe为阳极,电极反应式为Fe-2e-===Fe2+,由此可知,电源M端为正极;
②电源M端为正极,N端为负极,乙中Cu为阴极,石墨为阳极,发生反应的离子方程式为2Cu2++2H2O2Cu+O2↑+4H+;
③由两池中的对应关系Cu~2e-~H2↑
64 g 1 mol
0.64 g 0.01 mol
即224 mL H2。
答案:(1)氧化 O2+4e-+2H2O===4OH- (2)正 2Fe3++Cu===2Fe2++Cu2+
(3)①正 Fe-2e-===Fe2+ ②2Cu2++2H2O2Cu+O2↑+4H+ ③224