- 117.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
总题数:22 题
第1题(2006年普通高等学校夏季招生考试理综全国卷I(新课程))
题目
11.在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:
CH3COOHCH3COO-+H+
对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
答案
B
解析:根据勒夏特列原理:当改变影响平衡的一个条件,平衡会向着能够减弱这种改变的方向移动,但平衡的移动不能完全消除这种改变。A加入水时,c(CH3COOH)+c(CH3COO-)+c(H+)减小,平衡向其增大的方向(也就是正方向)移动;B加入NaOH与H+反应,c(H+)变小,平衡向正方向移动;C加入HCl时c(H+)变大,平衡向其减小的方向(也就是逆方向)移动,但最终c(H+)比未加HCl前还是要大;D加入CH3COONa,c(CH3COO-)增大,平衡向逆方向移动。
第2题(2006年普通高等学校夏季招生考试理综全国卷Ⅱ(新课程))
题目
6.反应2A(g)+B(g)2C(g);△H>0。下列反应条件有利于生成C的是
A 低温、低压 B 低温、高压
C 高温、高压 D 高温、低压
答案
C
解析:正反应为气体体积缩小的反应,且为吸热反应,升高温度、增大压强均会使平衡向正方向移动,有利于生成C。
第3题(2006年普通高等学校夏季招生考试理综天津卷(新课程))
题目
11.某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g)Z(g)+W(s);ΔH>0
下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的ΔH增大
答案
B
解析:W为固体,改变其用量不影响化学反应速率,也不影响化学平衡;该可逆反应向正方向进行时气体压强减小、向逆方向进行时气体压强增大,若气体压强不变,证明反应达到平衡;正反应为吸热反应,升高温度平衡正向移动;△H由反应物、生成物能量决定,与加入反应物多少无关。
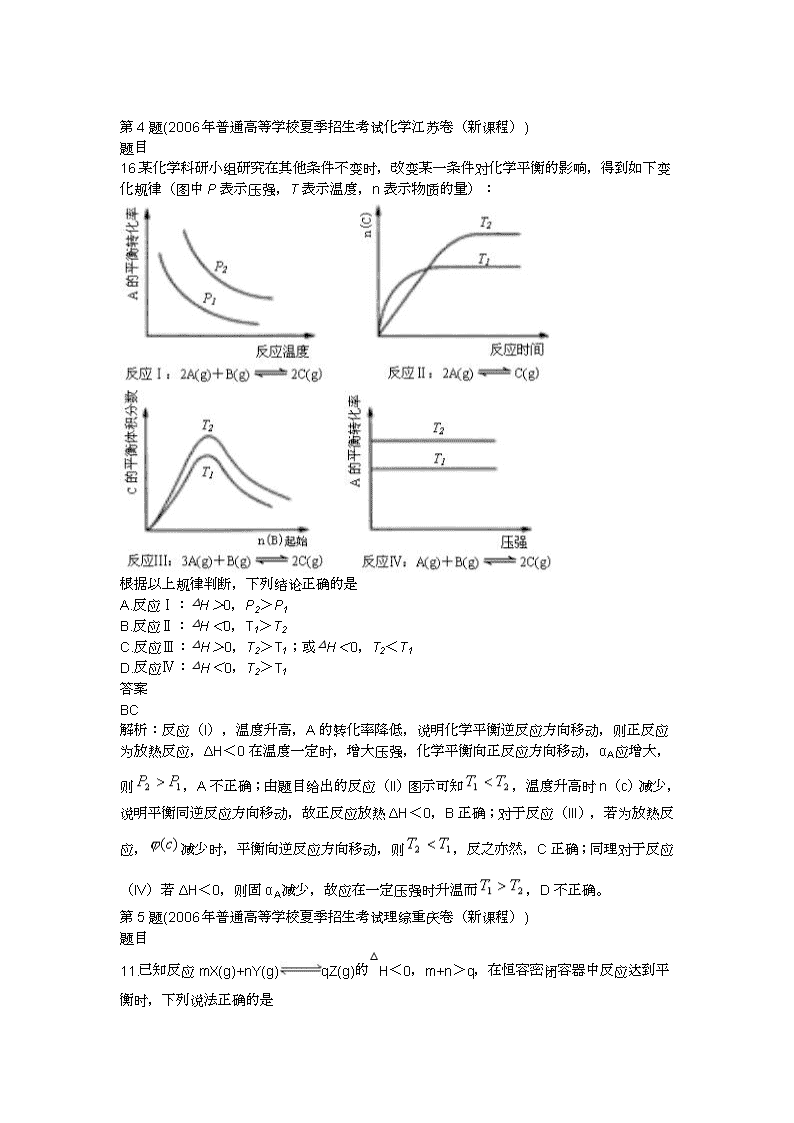
第4题(2006年普通高等学校夏季招生考试化学江苏卷(新课程))
题目
16.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
答案
BC
解析:反应(I),温度升高,A的转化率降低,说明化学平衡逆反应方向移动,则正反应为放热反应,ΔH<0在温度一定时,增大压强,化学平衡向正反应方向移动,αA应增大,则,A不正确;由题目给出的反应(II)图示可知,温度升高时n(c)减少,说明平衡同逆反应方向移动,故正反应放热ΔH<0,B正确;对于反应(III),若为放热反应,减少时,平衡向逆反应方向移动,则,反之亦然,C正确;同理对于反应(IV)若ΔH<0,则固αA减少,故应在一定压强时升温而,D不正确。
第5题(2006年普通高等学校夏季招生考试理综重庆卷(新课程))
题目
11.已知反应mX(g)+nY(g)qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
答案
B
解析:恒容密闭容器中通入稀有气体,X、Y、Z浓度均不变,平衡不移动,A错误。达到平衡时正、逆反应速率相等,即、;由“速率数值之比等于物质系数之比”得:,B正确。降低温度平衡正向移动,气体物质的量减少,而气体总质量不变,根据,平均相对分子质量变大,C错误。增加X平衡正向移动,Y的转化率升高,D错误。
第6题(2005年普通高等学校夏季招生考试理综全国卷Ⅰ(新课程))
题目
12.下图是温度和压强对X+Y2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种气态,Z为气态
D.上述反应的逆反应△H>0
答案
C
解析:根据题图,在压强不变的情况下,例如1 000 kPa时,随着温度的升高,Z的体积分数增大,即随着温度的升高,平衡向正反应方向移动。所以,正反应为吸热反应,ΔH>0;逆反应为放热反应,ΔH<0。所以A、D错误。同样,在温度不变的情况下,从1 000→100→10 kPa,随着压强的减小,Z的体积分数增大,即随着压强的减小,平衡向正反应方向移动,正反应为气体体积增大的反应,所以C正确。
第7题(2005年普通高等学校夏季招生考试理综全国卷Ⅱ(新课程))
题目
11.已知反应A2(g)+2B2(g)2AB2(g)的△H<0,下列说法正确的是
A.升高温度,正向反应速率增加,逆向反映速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
答案
B
解析:A2(g)+2B2(g)2AB2(g)是放热反应,且是气体体积减小的反应。所以升高温度,平衡向逆反应方向移动;增大压强,平衡向正反应方向移动,C、D均错误。升高温度,正、逆反应速率均加快,达到平衡需要的时间减少,A错误,正确答案为B。
第8题(2005年普通高等学校夏季招生考试理综全国卷Ⅲ(新课程))
题目
8.在体积可变的密闭容器中,反应mA(气)+nB(固)pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是
A. (m+n)必定小于p B. (m+n)必定大于p
C. n必定小于p D .m必定大于P
答案
C
解析:压缩容器的体积,A的转化率降低,说明压强增大时平衡向逆反应方向移动,逆反应是气体体积缩小的反应,即m<p。
第9题(2005年普通高等学校夏季招生考试理综北京卷(新课程))
题目
7.在一定温度不同压强(p1<p2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数()与反应时间(t)的关系有以下图示,正确的是
A B C D
答案
B
解析:对2X(g)2Y(g)+Z(g),压强越大,正、逆反应速率越大,达到化学平衡所需时间越短,在-t图中表现为曲线从上升(表示体系在达到平衡过程中)到水平的转折点(表示体系刚好达到平衡)再到水平(表示体系处于平衡状态)。因为p1<p2,可知A、C错误。
对2X(g)2Y(g)+Z(g),压强越大,形成的平衡中Z的体积分数越小,在-t图中表现为曲线的水平部分越低,所以B正确。
第10题(2005年普通高等学校夏季招生考试理综天津卷(新课程))
题目
9.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)N2(g)+CO2(g);
ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A 加催化剂同时升高温度 B 加催化剂同时增大压强
C 升高温度同时充入N2 D 降低温度同时增大压强
答案
B
解析:提高反应速率的一般做法有:①升高温度,②增大反应物浓度,③对有气体参加的反应增大压强,④加入催化剂。要提高NO的转化率,即让平衡向正反应方向移动,可采用的做法有:①降低温度,②增大压强,③增大CO的浓度等。综合以上的分析,正确答案为B。
第11题(2005年普通高等学校夏季招生考试化学江苏卷(新课程))
题目
18.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A.2mol C B.2molA、1molB和1molHe(不参加反应)
C.1molB和1molC D.2molA、3molB和3molC
答案
AB
解析:本题主要考查有关化学平衡的相关问题。
由于在等温等容的条件下,对于气体总体积不变的反应2A(g)+B(g)3C(g),充入任意物质的量的C,都与充入2 mol A和1 mol B等效,且平衡时A的体积分数大于a%;A符合题意;而充入He时对所给化学平衡没有影响,则B选项中A的体积分数亦大于a%,而C、D皆相当于在2 mol A和1 mol B达到平衡的基础上,增大B的浓度使化学平衡向右移动,A的体积分数减小,故本题答案为A、B。
第12题(2005年普通高等学校夏季招生考试化学广东卷(新课程))
题目
14.在一定条件下,固定容积的密闭容器中反应:2NO2(g) 2NO(g) + O2(g);△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
答案
AB
解析:本题主要考查外界条件对化学平衡移动的影响规律。根据所给图示,量Y随X的增大而减小。由于反应吸热,温度升高,化学平衡向右移动,n(NO2)减小,A正确;反应2NO2
(g)O2(g)+2NO(g)为气体总体积增大的反应,当压强增大时,所给化学平衡向逆反应方向移动,NO2转化率降低,B正确。反应一旦达到平衡,混合气体的密度一定与时间长短无关,故C不正确;增大NO2的物质的量在容积不变时c(NO2)增大,平衡向正反应方向移动,n(O2)增大,D不正确,答案为A、B。
第13题(2005年普通高等学校夏季招生考试化学广东卷(新课程))
题目
17.对可逆反应4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
答案
A
解析:本题综合考查化学平衡的建立及外界条件对化学反应速率的影响。
根据不同物质表示同一反应时的速率关系可知,v(O2)逆∶v(NO)逆=5∶4,v(NO)逆=v(O2)逆,代入A中表达式知v(O2)正=v(O2)逆,A正确;NO的生成与NH3的消耗同时表示正反应在任意时刻都成比例,故B不正确;达到平衡时,增加容器体积,反应物、生成物浓度同时减小,正逆反应速率同时减小,C不正确。在反应的任意状态总有v正(NH3)∶v正(H2O)=4∶6即3v正(NH3)=2v正(H2O),D不正确。
第14题(2005年普通高等学校春季招生考试理综北京卷(新课程))
题目
14.一定条件下,在密闭容器中,能表示反应X(气)+2Y(气) 2Z(气)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1︰2︰2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①②
B.①④
C.②③
D.③④
答案
C
第15题(2004年普通高等学校夏季招生考试理综全国卷Ⅰ(旧课程))
题目
13.某温度下在密闭容器中发生如下反应:
2M(g)+N(g)2E(g)
若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为( )
A.20%
B.40%
C.60%
D.80%
答案
C
第16题(2004年普通高等学校夏季招生考试理综北京卷(旧课程))
题目
14.在一定温度下,一定体积的密闭容器中有如下平衡:H2(气)+I2(气)2HI(气)。已知H2和I2的起始浓度均为0.10 mol·L-1,达平衡时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1时,则平衡时H2的浓度(mol·L-1)是( )
A.0.16
B.0.08
C.0.04
D.0.02
答案
C
第17题(2004年普通高等学校夏季招生考试理综天津卷(新课程))
题目
13.一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
A.保持温度和容器体积不变,充入1 mol SO3(g)
B.保持温度和容器内压强不变,充入1 mol SO3(g)
C.保持温度和容器内压强不变,充入1 mol O2(g)
D.保持温度和容器内压强不变,充入1 mol Ar(g)
答案
B
第18题(2004年普通高等学校夏季招生考试化学江苏卷(新课程))
题目
18.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)2C(g);ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是………………………………………( )
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
答案
AB
第19题(2004年普通高等学校夏季招生考试化学广东卷(新课程))
题目
5.在恒温时,一固定容积的容器内发生如下反应:
2NO2(g)N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )
A.不变
B.增大
C.减小
D.无法判断
答案
C
第20题(2004年普通高等学校夏季招生考试化学广东卷(新课程))
题目
9.一定温度下,反应2SO2+O22SO3达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )
A.0.4 mol
B.0.6 mol
C.0.8 mol
D.1.2 mol
答案
A
第21题(2003年普通高等学校夏季招生考试理综全国卷(新课程))
题目
12.某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半
B.均加倍
C.均增加1 mol
D.均减少1 mol
答案
C
第22题(2003年普通高等学校夏季招生考试理综全国卷(旧课程))
题目
11.某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半
B.均加倍
C.均增加1 mol
D.均减少1 mol
答案
C