- 70.06 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学反应与能量练习卷
1.HBr被O2氧化依次由如下Ⅰ、Ⅱ、Ⅲ、三步反应组成,1molHBr被氧化为Br2放出12.67kJ热量,其能量与反应进程曲线如图所示。
(Ⅰ)HBr(g)+O2(g)==HOOBr(g)
(Ⅱ)HOOBr(g)+ HBr(g)==2HOBr(g)
(Ⅲ)HOBr(g)+ HBr(g)== H2O(g)+ Br2(g)
下列说法正确的是
A. 三步反应均为放热反应
B. 步骤(I)的反应速率最慢
C. HOOBr比HBr和O2稳定
D. 热化学方程式为4HBr(g)+O2(g)==2H2O(g)+2Br2(g) △H=-12.675kJ•mol-1
【答案】B
2.下列说法正确的是
A. 在25℃、101KPa,1mol S(s)和2molS(s) 的燃烧热相等
B. 1mol H2SO4 (浓)与1mol Ba(OH)2完全中和所放出的热量为中和热
C. CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2 ,所以CO的燃烧反应一定是吸热反应
D. 101KPa时,1mol H2燃烧所放出的热量为氢气的燃烧热
【答案】A
3.在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2O2(g)===SO2(g)+H2O(g) ΔH1
2H2S(g)+SO2(g)===3/2 S2(g)+2H2O(g) ΔH2
H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3
2S(g)===S2(g) ΔH4
则ΔH4的正确表达式为
A. ΔH4=2/3 (ΔH1+ΔH2-3ΔH3) B. ΔH4=2/3 (3ΔH3-ΔH1-ΔH2)
C. ΔH4=3/2 (ΔH1+ΔH2-3ΔH3) D. ΔH4=3/2 (ΔH1-ΔH2-3ΔH3)
【答案】A
4.下列说法正确的是
A. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
B. 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色,该溶液一定是钠盐溶液
C. 用玻璃棒蘸取NaC1O 溶液点在干燥的pH试纸上,试纸呈蓝色,证明HC1O是弱酸
D. 取久置的Na2O2 粉末,向其中滴加过量的盐酸,产生无色气体,不能说明Na2O2是否变质
【答案】D
5.已知热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=- 890.3 kJ/mol;
②N2(g)+O2(g)=2NO(g) △H= +180kJ/mol.则CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l)的△H为
A. -1250.3kJ/mol B. -2500.6kJ/mol C. +1250.3kJ/mol D. +2 500.6kJ /mol
【答案】A
6.化学中有许多的“守恒或相等“下列说法不正确的是
A. 化学反应中,反应物总能量与生成物总能量
B. 溶液中,阳离子电荷总数与阴离中电荷总数
C. 溶液中,稀释前后溶质质量与稀释后溶质质量
D. 化学反应中,参加反应物总质量与生成物总质量
【答案】A
7.下列四组热化学方程式,△Hl>△H2的是
①C(s)+O2(g)=CO2(g) △Hl C(s)+l/2O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △Hl S(g)+O2(g)=SO2(g) △H2
③CaCO3(s)=CaO(s)+CO2(g) △Hl CaO(s)+H2O(l)=Ca(OH)2(s) △H2
④HCl+NaOH=NaCl+H2O △Hl HC1+NH3·H2O=NH4C1+H2O △H2
A. ①③ B. ①④ C. ②③ D. ②④
【答案】C
8.己知:A(g)+B(g)=C(g)+D(l) △H <0,下列图示能表示该反应能量变化的是 (图中E表示能量)
【答案】B
9.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:ΔH>0,p2>p1月 B. 反应Ⅱ:ΔH<0,T1>T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2T1
【答案】C
10.一定条件下,密闭容器中发生反应M(g)N(g),反应过程中的能量变化如图中曲线1所示。下列说法错误的是
A. 该反应正反应活化能为(E3-E2)kJ•mol-1
B. 该反应的反应热为(E1-E2) kJ•mol-1
C. 曲线II表示其他条件不变,升高温度时的能量变化
D. 曲线III表示其他条件不变,加入催化剂时的能量变化
【答案】C
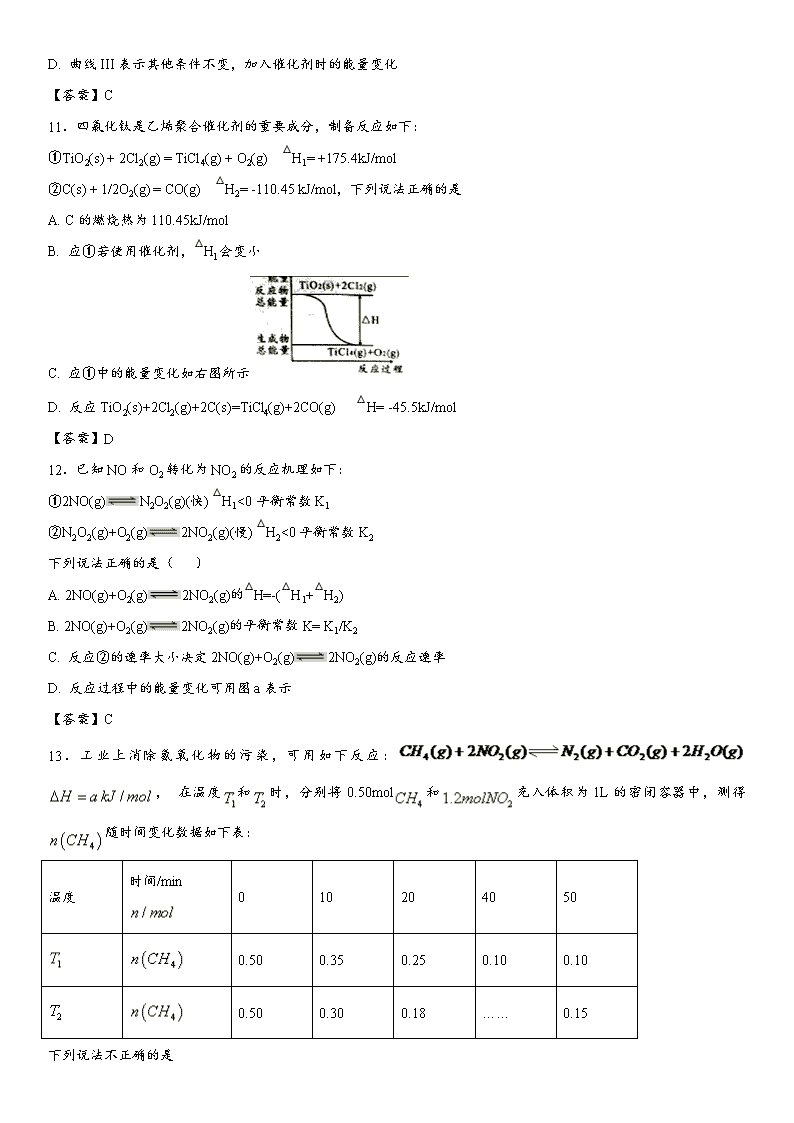
11.四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s) + 2Cl2(g) = TiCl4(g) + O2(g) △H1= +175.4kJ/mol
②C(s) + 1/2O2(g) = CO(g) △H2= -110.45 kJ/mol,下列说法正确的是
A. C的燃烧热为110.45kJ/mol
B. 应①若使用催化剂,△Hl会变小
C. 应①中的能量变化如右图所示
D. 反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H= -45.5kJ/mol
【答案】D
12.已知NO和O2转化为NO2的反应机理如下:
①2NO(g)N2O2(g)(快) △H1<0平衡常数K1
②N2O2(g)+O2(g)2NO2(g)(慢) △H2<0平衡常数K2
下列说法正确的是( )
A. 2NO(g)+O2(g)2NO2(g)的△H=-(△H1+△H2)
B. 2NO(g)+O2(g)2NO2(g)的平衡常数K= K1/K2
C. 反应②的速率大小决定2NO(g)+O2(g)2NO2(g)的反应速率
D. 反应过程中的能量变化可用图a表示
【答案】C
13.工业上消除氮氧化物的污染,可用如下反应: , 在温度和时,分别将0.50mol和充入体积为1L的密闭容器中,测得随时间变化数据如下表:
温度
时间/min
0
10
20
40
50
0.50
0.35
0.25
0.10
0.10
0.50
0.30
0.18
……
0.15
下列说法不正确的是
A. 10min内, 时比时小 B. 温度:
C. D. 平衡常数:
【答案】D
14.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的如图所示,下列说法正确的是
A. 状态I→状态III表示CO与O2反应的过程
B. CO和O生成了具有极性共价键的CO2
C. 在该过程中,CO断键形成C和O[来源:1]
D. CO和O生成CO2是吸热反应
【答案】B
15.三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热ΔH=-3677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法不正确的是()
A. 分子中每个原子最外层均达到8电子稳定结构
B. P4S3中硫元素为-2价,磷元素为+3价
C. 一个P4S3分子中含有三个非极性共价键
D. 热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol
【答案】B
16.已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ 能量,根据图中的能量图,回答下列问题:
(1)分别写出①②的数值:①___________KJ;②____________KJ。
(2)生成H2O(g)中的1 mol H—O键放出_____________kJ的能量。
(3)已知:H2O(l)==H2O(g) ΔH = + 44 kJ·mol-1,试写出2 mol氢气在足量氧气中完全燃烧生成液态水的热化学方程式__________________。
【答案】 1370 1852 463 2H2(g)+O2(g)=2H2O(g) △H=-570kJ/mol
17.甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g) ΔH1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键
H﹣H
C﹣O
C≡O
H﹣O
C﹣H
E/( kJ•mol-1)
436
343
1076
465
413
由此计算ΔH1=______。已知ΔH2=﹣58 kJ•mol-1,则ΔH3=______。
(2)合成气中的氢气是发展中的新能源,它的利用包括制备、储存和应用三个环节。与汽油相比,氢气作为燃料的优点是___________________________(写出两点),缺点是_________________(写出两点)。
【答案】 -99 kJ•mol-1 +41 kJ•mol-1 资源丰富,可再生;燃烧热值高;产物无毒、无污染 氢气的储存和运输困难;以水为原料获得廉价、丰富的氢能技术还有待突破。
18.NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 ________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为________。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为________。
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:________。
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx 进行选择性反应:4NH3 + 4NO + O2 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
(5)判断该反应为________(填“吸热”或“放热”)反应,说明理由:________ 。
【答案】 3NO(g) + O3(g) 3NO2(g) ΔH= -317.3 kJ•mol﹣1 SO32- + H2O HSO3- + OH- CaSO3 + 2NO2 + H2O 2HNO2 + CaSO4 CaSO3浊液中存在:CaSO3(s) Ca2+(aq) + SO32-(aq),加入Na2SO4固体,由于CaSO4的Ksp较小,SO42-与Ca2+结合生成CaSO4沉淀,c(Ca2+)减小,平衡正向移动,导致c(SO32-)增大,从而使NO2的吸收速率加快 放热 由图像中T1下反应先达平衡可推断T1>T2,由T1(高温)时NO的平衡浓度高可推断正反应是放热反应
19.碳和氮是地球上含量丰富的两种元素。其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
(1)下图是25℃,101kPa时,1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出该反应的热化学方程式____________________________________。
(2)在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)N2(g)+CO2(g),达到平衡时的数据如下:
温度
n(C)/mol
n(CO2)/mol
T1
0.3
T2
0.6
请回答下列问题:
①T1℃时,该反应的平衡常数K=___________。
②T2℃时,下列能判断该反应达到平衡状态的是___________(填序号)。
A.v(CO2)正=2v(NO)逆 B.混合气体的平均相对分子质量不再变化
C.混合气体的密度不再变化 D.N2、CO2的物质的量之比不再变化
③T2℃时,若达平衡后再充入0.4molNO和0.3molCO2,平衡向___________(填“正向”“逆向“或“不”)移动。
④若△H”或“<”)。
(3)电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示:
①若用NO2气体进行模拟电解法吸收实验,写出NO2发生反应的电极反应式________________。
②若有标况下2.24LNO被吸收,通过阳离子交换膜的H+为___________mol。
【答案】 NO2(g)+CO(g)=CO2(g)+NO(g) △H=-(b-a)kJ/mol BC 正向 > NO2-e-+H2O=NO3-+2H+ 0.3
20.Ⅰ.SF6是一种优良的绝缘气体,分子结构中,只存在S—F键,已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,F—F键能为160 kJ·mol-1,S—F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式_______________________________。
Ⅱ.V、W、X、Y、Z是由四种短周期元素中的2种或3种组成的5种化合物,其中W、X、Z均由2种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素A和两种非金属元素B与C组成,其化学式构成为A(BC3)3 。它们之间的反应关系如下图:
(1)写出物质W的一种用途:__________________________________________________。
(2)写出V与足量NaOH溶液反应的化学方程式:________________________________。
(3)将少量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为________________________。
(4)写出气体X的结构式__________。
(5)以Z为燃料,活性炭为电极,熔融碳酸盐(如熔融K2CO3)环境下制成燃料电池的负极反应式为____________________________。
【答案】 S(s)+3F2(g)===SF6(g) ΔH=-1 220 kJ·mol-1 作高温耐火材料或冶炼金属铝 Al(CH3)3+NaOH+H2O===NaAlO2+3CH4↑ CO2+2AlO+3H2O===2Al(OH)3↓+CO32─ CH4+4CO-8e-===5CO2+2H2O
相关文档
- 2020版高考地理一轮总复习 第二单2021-05-138页
- 全国名校高考数学专题训练平面向量2021-05-134页
- 高考高三地理一轮复习气候类型习题2021-05-133页
- 全国高考理科数学全国一卷试题及答2021-05-1310页
- 高考历史一轮复习阶段性测试题4岳2021-05-1314页
- 2020高考物理第一轮复习 专题 电学2021-05-133页
- 全国各地高考数学试题及解答分类汇2021-05-1317页
- 2013高考风向标文科数学一轮课时知2021-05-133页
- 2015苏教版本高考化学1.5(氧化还原2021-05-135页
- 2011高考生物试题汇编2021-05-1352页