- 124.71 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考化学第一轮总复习试卷(六)
晶体的类型和性质
第Ⅰ卷 (选择题 共60分)
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.与现代足球(如图6-1)有很相似的结构,它与石墨互为 ( )
A.同位素 B.同素异形体
C.同分异构体 D.同系物
2.下列物质为固态时,必定是分子晶体的是 ( )
A.酸性氧化物 B.非金属单质 C.碱性氧化物 D.含氧酸
3.金属的下列性质中,不能用金属晶体结构加以解释的是 ( )
A.易导电 B.易导热 C.有延展性 D.易锈蚀
4.氮化硅()是一种新型的耐高温耐磨材料,在工业上有广泛的用途,它属于 ( )
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体
5.水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是 ( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.玻璃态水是分子晶体
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分)
6.下列各组物质中,按熔点由低到高排列正确的是 ( )
A.、、Hg、Mg B.、KCI、
C.Na、K、Rb、Cs D.SiC、NaCl、
7.下列每组物质发生状态变化所克服的微粒间的相互作用力属于同种类型的是 ( )
A.食盐和蔗糖熔化 B.金属钠和晶体硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
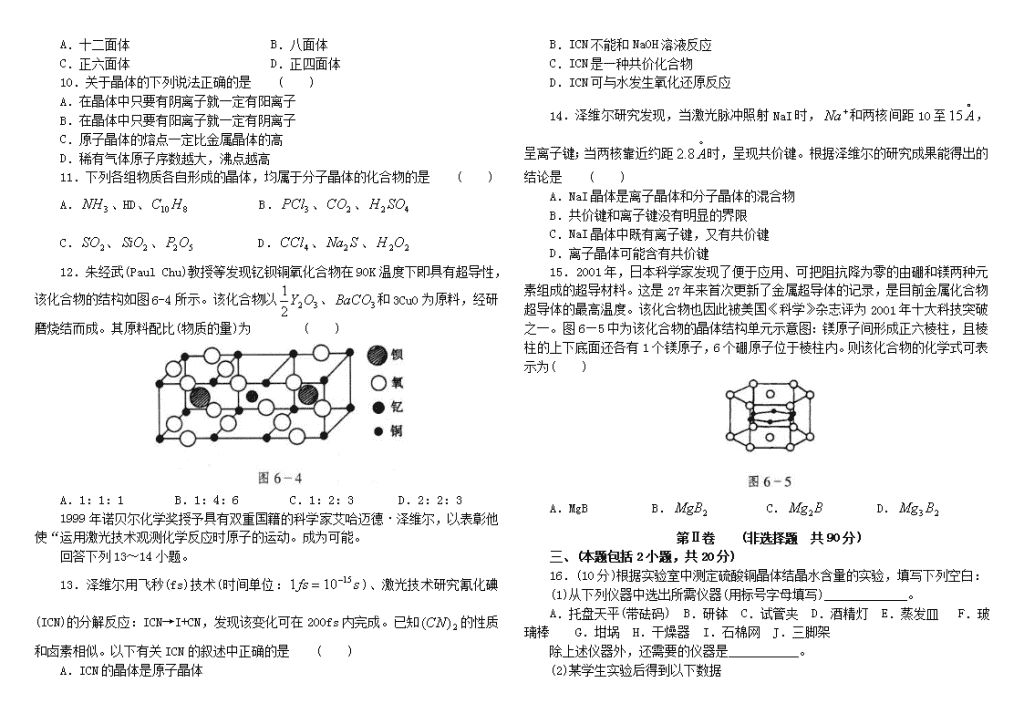
8.原子序数小于18的八种连号元素,它们的单质熔点随原子序数增大而变大的趋势如图6-2所示,图中X元素应属 ( )
A.族 B.族
C.族 D.族
9.如图6-3所示在氯化钠晶体中,与每个等距离且最近的几个所围成的空间几何构型为 ( )
A.十二面体 B.八面体
C.正六面体 D.正四面体
10.关于晶体的下列说法正确的是 ( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.稀有气体原子序数越大,沸点越高
11.下列各组物质各自形成的晶体,均属于分子晶体的化合物的是 ( )
A.、HD、 B.、、
C.、、 D.、、
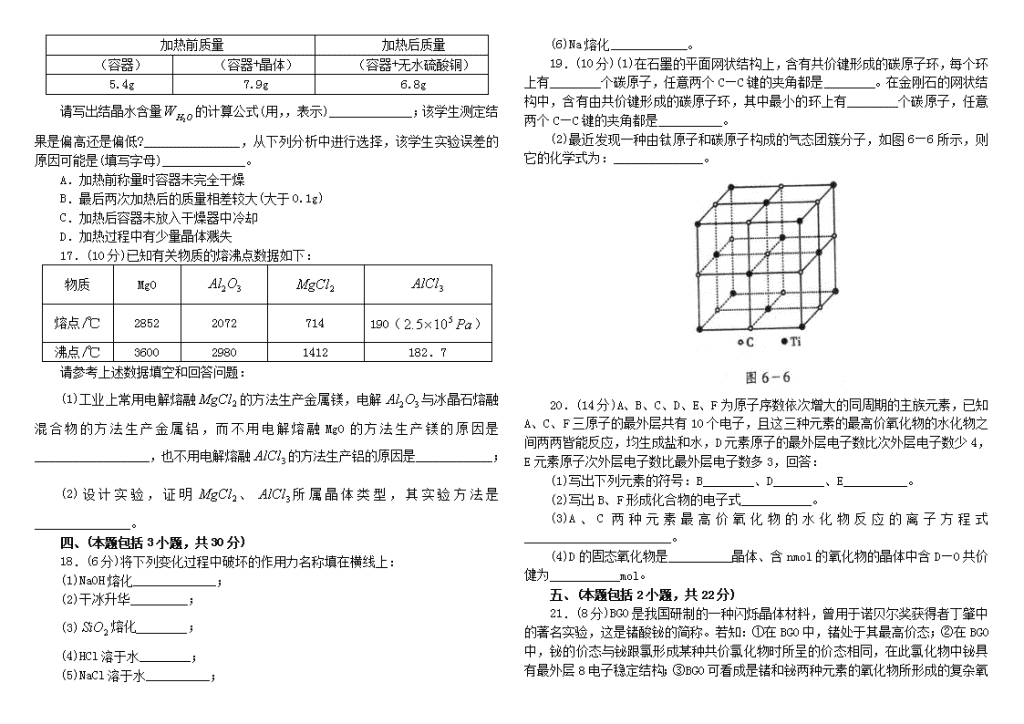
12.朱经武(Paul Chu)教授等发现钇钡铜氧化合物在90K温度下即具有超导性,该化合物的结构如图6-4所示。该化合物以、和3CuO为原料,经研磨烧结而成。其原料配比(物质的量)为 ( )
A.1:1:1 B.1:4:6 C.1:2:3 D.2:2:3
1999年诺贝尔化学奖授予具有双重国籍的科学家艾哈迈德·泽维尔,以表彰他使“运用激光技术观测化学反应时原子的运动。成为可能。
回答下列13~14小题。
13.泽维尔用飞秒(fs)技术(时间单位:)、激光技术研究氰化碘(ICN)的分解反应:ICN→I+CN,发现该变化可在200fs内完成。已知的性质和卤素相似。以下有关ICN的叙述中正确的是 ( )
A.ICN的晶体是原子晶体
B.ICN不能和NaOH溶液反应
C.ICN是一种共价化合物
D.ICN可与水发生氧化还原反应
14.泽维尔研究发现,当激光脉冲照射NaI时,和两核间距10至,呈离子键;当两核靠近约距时,呈现共价键。根据泽维尔的研究成果能得出的结论是 ( )
A.NaI晶体是离子晶体和分子晶体的混合物
B.共价键和离子键没有明显的界限
C.NaI晶体中既有离子键,又有共价键
D.离子晶体可能含有共价键
15.2001年,日本科学家发现了便于应用、可把阻抗降为零的由硼和镁两种元素组成的超导材料。这是27年来首次更新了金属超导体的记录,是目前金属化合物超导体的最高温度。该化合物也因此被美国《科学》杂志评为2001年十大科技突破之一。图6—5中为该化合物的晶体结构单元示意图:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为( )
A.MgB B. C. D.
第Ⅱ卷 (非选择题 共90分)
三、(本题包括2小题,共20分)
16.(10分)根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写)_____________。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是___________。
(2)某学生实验后得到以下数据
加热前质量
加热后质量
(容器)
(容器+晶体)
(容器+无水硫酸铜)
5.4g
7.9g
6.8g
请写出结晶水含量的计算公式(用,,表示)_____________;该学生测定结果是偏高还是偏低?_______________,从下列分析中进行选择,该学生实验误差的原因可能是(填写字母)_____________。
A.加热前称量时容器未完全干燥
B.最后两次加热后的质量相差较大(大于0.1g)
C.加热后容器未放入干燥器中冷却
D.加热过程中有少量晶体溅失
17.(10分)已知有关物质的熔沸点数据如下:
物质
MgO
熔点/℃
2852
2072
714
190()
沸点/℃
3600
2980
1412
182.7
请参考上述数据填空和回答问题:
(1)工业上常用电解熔融的方法生产金属镁,电解与冰晶石熔融混合物的方法生产金属铝,而不用电解熔融MgO的方法生产镁的原因是__________________,也不用电解熔融的方法生产铝的原因是____________;
(2)设计实验,证明、所属晶体类型,其实验方法是_______________。
四、(本题包括3小题,共30分)
18.(6分)将下列变化过程中破坏的作用力名称填在横线上:
(1)NaOH熔化_____________;
(2)干冰升华_________;
(3)熔化________;
(4)HCl溶于水________;
(5)NaCl溶于水__________;
(6)Na熔化____________。
19.(10分)(1)在石墨的平面网状结构上,含有共价键形成的碳原子环,每个环上有________个碳原子,任意两个C—C键的夹角都是________。在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有________个碳原子,任意两个C—C键的夹角都是__________。
(2)最近发现一种由钛原子和碳原子构成的气态团簇分子,如图6—6所示,则它的化学式为:______________。
20.(14分)A、B、C、D、E、F为原子序数依次增大的同周期的主族元素,已知A、C、F三原子的最外层共有10个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3,回答:
(1)写出下列元素的符号:B________、D________、E__________。
(2)写出B、F形成化合物的电子式___________。
(3)A、C两种元素最高价氧化物的水化物反应的离子方程式_______________________。
(4)D的固态氧化物是__________晶体、含nmol的氧化物的晶体中含D—O共价健为___________mol。
五、(本题包括2小题,共22分)
21.(8分)BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,这是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态;②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构;③
BGO可看成是锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。
请填空:
(1)锗和铋元素符号分别是_________和_________。
(2)BGO晶体的化学式__________。
(3)BGO晶体中所含铋氧化物的化学式是___________。
22.(14分)单质硼有无定形和晶体两种,参考下表数据。
金刚石
晶体硅
晶体硼
熔点/K
>3823
1683
2573
沸点/K
5100
2628
2823
硬度/Moh
10
7.0
9.5
(1)晶体硼的晶体类型属于_________,理由是__________;
(2)已知晶体的结构单元是由硼原子组成的正二十面体(如图6—7所示),其中有20个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由_____________个硼原子构成,其中B—B键的键角为____________,共含有____________个B—B键;
(3)若将晶体硼结构单元中的每一个顶角均削去,余下部分结构就与的结构相同,则由_____________个正六边形和___________个正五边形构成。
六、(本题包括2小题,共18分)
23.(8分)某离子晶体晶胞结构如图6—8所示,X位于立方体的顶点,Y位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着_____________个X,每个X同时吸引着____________个Y,该晶体化学式为_____________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有____________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为_____________________(填角的度数)。
(4)设该晶体的摩尔质量为,晶体密度为,阿伏加德罗常数为,则晶体中两个距离最近的X中心间的距离为_________cm。
24.(10分)(1)中学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,与最邻近的核间距离为cm,计算NiO晶体的密度。(已知NiO的摩尔质量为)
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图6—9所示的缺陷:一个空缺,另有两个被两个所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为,试计算该晶体中与的离子数之比。
参考答案
1.B 和石墨是由碳元素形成的不同单质。
2.D 酸性氧化物如为原子晶体,非金属单质:金刚石、晶体硅等为原子晶体。
3.D 金属的锈蚀与其化学活泼性有关。
4.A 耐高温、耐磨(硬度大)是原子晶体的性质。
5.C 据“密度与普通液态水的密度相同”知A、B错,“不存在晶体结构”知D错。
6.B 物质的熔点一般与其晶体类型有关,原子晶体最高,离子晶体(或金属晶体)次之,分子晶体最低。应注意的是汞虽然是金属晶体,但其常温下为液态。
7.C 根据构成晶体的粒子种类以及它们之间的相互作用的强弱不同来判断。A项中食盐为离子晶体,蔗糖为分子晶体;B项中钠为金属晶体,硫为分子晶体;D项中二氧化硅为原子晶体,氧化钠为离子晶体。选项C,碘和干冰均属于分子晶体,它们升华是克服很弱的分子间作用力,属于同种类型。
8.B X为Si,形成原子晶体熔点最高。
9.B 若处于中心的为(在中,和的位置一样),则包围它的6个围成八面体。
10.AD 金属晶体无阴离子,C项不确切,如钨的熔点比硅高。
11.B 注意:HD为单质。
12.B 该晶体中含:,Ba:2个,Y:1个,即化学式为。
据原子守恒知:
13.C 类似于卤素,属分子晶体,可与、溶液反应,如,因化合价未发生改变,不属氧化还原反应。
14.B 是离子晶体,其化学键与核间距有关。
15.B 位于顶点的镁原子为6个晶胞共有。面上的为两个晶胞共有,而硼原子位于棱柱内只为一个晶胞所有。
16.(1)A、B、D、F、G、H、J;坩埚钳、泥三角、药匙
(2);偏高;A、D
17.(1)的熔点太高,熔融时耗费大量能量;不是离子晶体而是分子晶体,熔融的不导电
(2)熔融后,看是否导电,导电者为离子晶体,否则为分子晶体
18.(1)离子键 (2)分子间作用力 (3)共价键 (4)共价键
(5)离子键 (6)金属阳离子与自由电子间的较强作用
19.(1)6;120°;6;109°28′ (2)
20.(1)Mg;Si;P (2) (3)
(4)原子;
21.(1)Ge;Bi (2)
(3)
22.(1)原子晶体;其晶体熔、沸点高,硬度大 (2)12;60°;30 (3)20;12
提示:从表中可知,晶体硅的熔、沸点以及硬度与金钢石相近,应属原子晶体,从图6-7可得出,每个顶角上的硼原子均分属于5个正三角形共有,故分归到每个三角形均为,每个三角形含有个硼原子,每个结构单元含硼原子数为(个),而B-B键即棱为两个三角形共有,每个结构单元含B-B键为:个。削去12个顶角,每个顶角即形成一个正五边形,原来的20个三角形即形成20个六边形。
23.(1)4;8;(或) (2)12 (3)109°28′ (4)
24.(1)因为的晶体结构与
晶体结构相同,均为正方体。设其晶胞是一个正方体,在这个晶胞中含,含,所以是0.5mol具有的体积,则。解题的关键是确定晶胞的组成后,通过晶体组成计算出存在的微粒数。
(2)设中,含有,为,根据晶体显电中性,即,解得为,则离子数之比为。