- 1.25 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2010福建卷
6. 下列关于有机物的正确说法是
A.聚乙烯可发生加成反应 B.石油干馏可得到汽油、煤油等
C.淀粉、蛋白质完全水解的产物互为同分异构体
D.乙酸乙酯、油脂与NaOH溶液反应均有醇生成
【解析】答案:D
本题考查必修2中有机化学方面有关的知识点,涉及的知识点较细,较广。目前在“福建必修考有机化学”框架下此题是无奈的设计。
7. NA表示阿伏伽德罗常数,下列判断正确的是
A.在18 g18O2中含有NA个氧原子
B.标准状况下,22.4L空气含有NA个单质分子
C.1 mol Cl2参加反应转移电子数一定为2 NA
D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为mol·L—1
【解析】答案:A
本题是有关NA的常规考题,选项B设计有点新意,空气这一混合物这样来设问以前没见过。
(2010福建,)8. 下列有关化学研究的正确说法是
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
【解析】答案:B
本题侧重考查反应速率、盖斯定律、分散系、元素周期律等,这题大多是纯文字表述。A选项“同时改变两个变量来研究反应速率的变化”是有当前“科学探究”的大环境影响,比较新颖,但有许多模拟题有出现,D选项切合一线教学,许多教师在比较HX性质时肯定会补充它们酸性比较,这样对学生头脑中“判断元素非金属性非金属性强弱依据时,是以最高价氧化物对应水化物的酸性强弱为判断依据”产生干扰,此项设问甚好!
(2010福建,)9.下列各组物质中,满足下图物质一步转化关系的选项是
选项
X
Y
Z
A.
Na
NaOH
NaHCO3
B.
Cu
CuSO4
Cu(OH)2
C.
C
CO
CO2
D.
Si
SiO2
H2SiO3
【解析】答案:C
本题涉及常见元素化合物知识考点,涉及的化学方程式知识面也比较广,转化图形式比较新。但是二氧化碳转化为碳这知识点对有些学生不公平,4Na+3CO2=2Na2CO3+3C这个方程式对老师来说也是比较陌生的。
10.下列关于电解质溶液的正确判断是
A. 在pH = 12的溶液中,K+、Cl—、HCO3—、Na+可以常量共存
B.在pH= 0的溶液中,Na+、NO3—、SO32—、K+可以常量共存
C. 由0.1 mol·L—1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH—
D. 由0.1 mol·L—1一元碱HA溶液的pH=3, 可推知NaA溶液存在A— + H2OHA + OH—
【解析】答案:D
本题考查有关电解质溶液知识,涉及常见离子共存、弱电解质溶液的电离和水解。考查知识点与解题方法都比较常规。
此题提出了“常量共存”而不是“大量共存”,两者有没有区别?厦门2010届期末考有一试题也是提“常量共存”。我觉得两者还有一定差别的,但在这一题设问中两者含意可认为一致。我想查找了“常量共存”究竟浓度是多少,但没找到。有一个“常量元素是指在有机体内含量占体重 0 . 01 %以上的元素”可供参考,或者是不是与分析化学中的“常量分析”有联系。
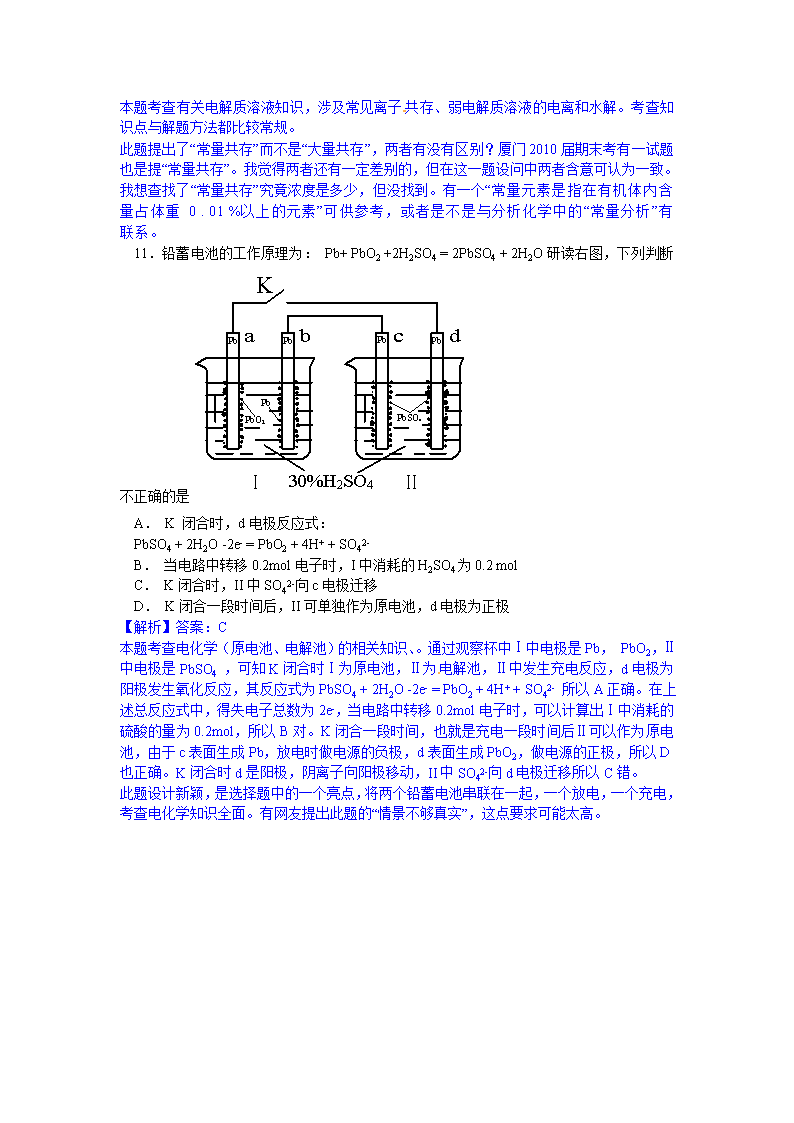
11.铅蓄电池的工作原理为: Pb+ PbO2 +2H2SO4 = 2PbSO4 + 2H2O研读右图,下列判断不正确的是
A. K 闭合时,d电极反应式:
PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42-
B. 当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C. K闭合时,II中SO42-向c电极迁移
D. K闭合一段时间后,II可单独作为原电池,d电极为正极
【解析】答案:C
本题考查电化学(原电池、电解池)的相关知识、。通过观察杯中Ⅰ中电极是Pb, PbO2,Ⅱ中电极是PbSO4 ,可知K闭合时Ⅰ为原电池,Ⅱ为电解池,Ⅱ中发生充电反应,d电极为阳极发生氧化反应,其反应式为PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42- 所以A正确。在上述总反应式中,得失电子总数为2e-,当电路中转移0.2mol电子时,可以计算出Ⅰ中消耗的硫酸的量为0.2mol,所以B对。K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时做电源的负极,d表面生成PbO2,做电源的正极,所以D也正确。K闭合时d是阳极,阴离子向阳极移动,II中SO42-向d电极迁移所以C错。
此题设计新颖,是选择题中的一个亮点,将两个铅蓄电池串联在一起,一个放电,一个充电,考查电化学知识全面。有网友提出此题的“情景不够真实”,这点要求可能太高。
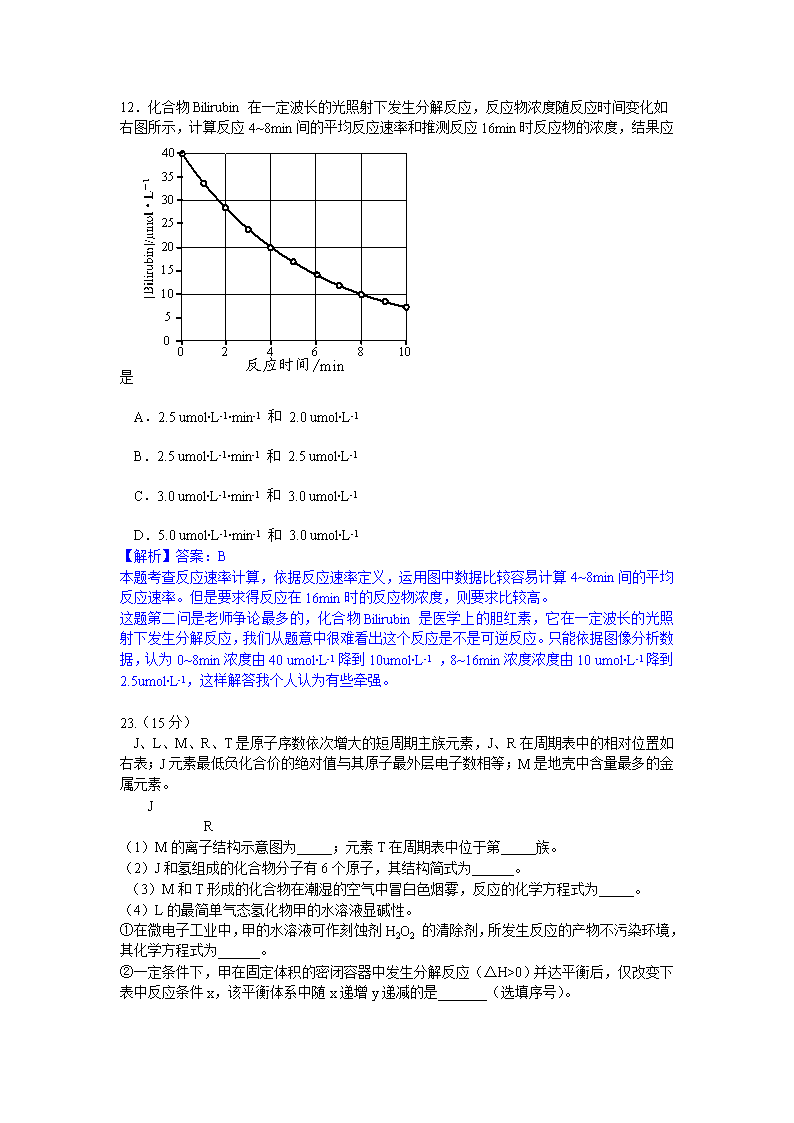
12.化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如右图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是
A.2.5 umol∙L-1∙min-1 和 2.0 umol∙L-1
B.2.5 umol∙L-1∙min-1 和 2.5 umol∙L-1
C.3.0 umol∙L-1∙min-1 和 3.0 umol∙L-1
D.5.0 umol∙L-1∙min-1 和 3.0 umol∙L-1
【解析】答案:B
本题考查反应速率计算,依据反应速率定义,运用图中数据比较容易计算4~8min间的平均反应速率。但是要求得反应在16min时的反应物浓度,则要求比较高。
这题第二问是老师争论最多的,化合物Bilirubin是医学上的胆红素,它在一定波长的光照射下发生分解反应,我们从题意中很难看出这个反应是不是可逆反应。只能依据图像分析数据,认为0~8min浓度由40 umol∙L-1 降到10umol∙L-1 ,8~16min浓度浓度由10 umol∙L-1 降到2.5umol∙L-1,这样解答我个人认为有些牵强。
23.(15分)
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
J
R
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
选项
a
b
c
d
x
温度
温度
加入H2的物质的量
加入甲的物质的量
y
甲的物质的量
平衡常数K
甲的转化率
生成物物质的量总和
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为________。
【解析】答案:(1);VⅡA
(2)CH2=CH2
(3)AlCl3+3H2O=Al(OH)3+3HCl↑(或AlCl3+H2O=Al(OH)Cl2+HCl↑其他合理答案)
(4)①2NH3·H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O ②a和c;a或c
(5)CS2(l)+3O2(g)=CO2(g)+2SO2(g) ΔH=-1075kJ/mol
本题是常规元素推断题,结合元素位置,元素性质,元素特性可以很快推出为C,N,Al,S,Cl。其中N, Cl两种元素要结合下面小题题干才能推出。这点也是近年来推断题的变化之处。
设计问题进行“拼盘式”考查,一考查化学用语,其中氯化铝在潮湿的空气中冒白色烟雾涉及铝离子的水解,学生根据冒白色烟雾可以推出。氨气与H2O2反应涉及氧化还原反应知识,学生根据反应的产物不污染环境可以推出产物为氮气,再配平方程式。二是考查化学平衡移动知识,比较基础。三是考查热化学方程式书写,学生可以根据题意可顺利写出来。建议第(5)小问标准答案改成CS2(l)+3O2(g)=CO2(g)+2SO2(g) ΔH=-1075kJ/mol可能更恰当。
24. 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1)将菱锌矿研磨成粉的目的是_____。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____=□Fe(OH)3 +□CI—
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
Mg(OH)2
Zn(OH)2
MgCO3
CaCO3
开始沉淀的pH
10.4
6.4
—
—
沉淀完全的pH
12.4
8.0
—
—
开始溶解的pH
—
10.5
—
—
Ksp
5.6×
—
6.8×
2.8×
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
【解析】答案:(1)增大反应物接触面积或增大反应速率或使反应更充分
(2)2Fe(OH)2+ClO-+H2O===2Fe(OH)3+Cl-
(3)FeO(OH)(或其它合理答案)
(4)8.0≤pH<10.4(或其它合理答案)
(5)b或(b和d);d
(6)蒸发浓缩、冷却结晶(或其它合理答案)
(7) 125m2/81m1(或其它合理答案)
本题是流行的化工工艺流程题,主要依据流程图中涉及的化学知识、化学原理来设计问题。
第(2)小问涉及也是氧化还原反应方程式配平,流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO—,观察方程式前后可以推出还要加入水分子。最后配平。
第(4)小问调节“滤液2”的pH想要产生Zn(OH)2,而不产生Mg(OH)2观察表格数据可以推出pH范围是8.0≤pH<10.4。
第(5)小问从“滤液3”制取MgO过程中,说明要产生Mg(OH)2,溶液的碱性要增强,所以加入石灰乳或烧碱溶液。
第(6)小问觉得设计的不好,考生做化学试题进行应试时都会背“蒸发浓缩、冷却结晶”这几个字,纯属送分。
第(7)小问要计算菱锌矿粉中ZnCO3 的质量分数,有点难度,考生经过课改后一碰到计算题就胆怯。其实此问计算非常简单。
ZnCO3————ZnO
125 81
125 m2/81 m2
ZnCO3 的质量分数为125 m2/81m1
25.工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体
Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应先用 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c..浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是 。
(7)若要测定限定体积气体Y中H2的含量(标准状况下约有28mL H2),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
【解析】答案:(1)铁钉表面被钝化(或其它合理答案)
(2)①d ②66.7%(或其它合理答案)
(3)检验SO2是否除尽
(4)C+H2SO4(浓) CO2↑+SO2↑+2H2O
(5)c
(6)D中固体由黑变红和E中固体由白变蓝
(7)否 ,用托盘天平无法称量D或E的差量;可,用分析天平称量D或E的差量
本题是实验题,也是拼盘式。涉及铁离子,亚铁离子检验,SO2的定量计算,SO2 ,CO2 ,H2等混合气体的性质综合探究。
第(2)小问Fe3+中含有Fe2+的检验,不能用KSCN溶液,因为有Fe3+存在。用酸性KMnO4溶液产生褪色现象说明存在Fe2+。SO2的定量计算也比较简单,n(SO2)=n(BaSO4)=
0.01mol,SO2的体积分数为224 mL/336mL=66.7%。
本题第二部分仪器串接有点象2005年全国理综化学实验题,也是常规的化学仪器串接题。A是除去SO2,B是检验SO2是否除尽,题目中“碳素钢”这个隐藏点说明还存在C与浓硫酸反应。推出Q为CO2要检验它的存在,M中为澄清石灰水,添加M于B-C间就可以 排除SO2的干扰。
检验氢气,通过盛有氧化铜装置,实验现象是由黑变红,生成的水使无水硫酸铜由白变蓝。标况下28mL H2通过反应造成D中质量差只有0.02g,所以托盘天平无法称量,用分析天平可以。最后一问设计巧妙,涉及定量计算与分析,要求较高。
30.[化学-物质结构与性质] (13分)
(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+ 3C+SA+N2↑+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为 。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,Q2+的未成对电子数是 。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+
交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 ml,可知该配离子的化学式为 。
【解析】答案:(1)①O>N>C>K
②离子晶体;sp ③1:1
(2)3d84s2;4
(3)[CrCl(H2O)5]2+
本题是物质结构与性质选考题,设问比较常规,只有第(3)小问比较新颖,加大了难度。
第(1)小问中通过方程式可推出A为K2S,是离子晶体。含极性共价键的分子指的是CO2其空间构型是直线型。CN-与N2结构相似是三键,HCN结构式为H—C≡N,σ键为2个,π键为2 个。
第(2)小问原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,可以推出是Ⅷ族,原子序数T比Q多2,Q为Fe,T为Ni。Ni的基态原子外围电子(价电子)排布为3d84s2,Q2+外围电子排布为3d6,未成对电子数是4。
第(3)小问通过NaOH算出n(H+)=0.0030mol,则X为0.0030mol/0.0015 mol=2。Cr为+3价,说明n=1, 该配离子的化学式为[CrCl (H2O)5]2+。通过上述计算过程发现此问其实不难。但考生在此处估计不容易得分。还有题中所给的方程式:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+有点问题,方程式电荷不守恒,可能要改成[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]+xH+这样可能更好一些。
31.[化学-有机化学基础](13分)
从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
分子式
C16H14O2
部分性质
能使Br2/CCl4退色
能在稀H2SO4中水解
(甲)
(乙)
(丙)
(1)甲中含氧官能团的名称为 。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
其中反应Ⅰ的反应类型为 ,反应Ⅱ的化学方程式为 (注明反应条件)。
(3)已知:RCH=CHR'RCHO+R'CHO;
2HCHOHCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
①下列物质不能与C反应的是 (选填序号)
a. 金属钠 b. HBr c. Na2CO3溶液 d.乙酸
②写出F的结构简式 。
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式 。
a. 苯环上连接着三种不同官能团
b.能发生银镜反应
c.能与Br2/CCl4发生加成反应
d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为 。
【解析】答案:(1)羟基
(2)加成反应;
(3)①c
②
③(或其它合理答案)
④
本题是有机化学基础选考题,设问层次分明,逐步加大难度。福建本省考虑到学生选考有机的同学较少,整道题只有一个有机化学方程式书写,第(3)小问要利用题给信息进行推断,稍加了些难度。
(1)很明显甲中含氧官能团的名称为羟基—OH;
(2)甲在一定条件下双键断开变单键,应该发生加成反应;
催化氧化生成Y为;Y在强氧化钠的醇溶液中发生消去反应。
(1) ①C的结构简式为,不能与碳酸钠反应
②F是E(HOCH2COOH)通过缩聚反应生成
③D能发生银镜反应,含有醛基,能与Br2/CCl4发生加成反应,说明含有不饱和双键;遇FeCl3溶液显示特征颜色,属于酚。综合一下可以写出D的结构简式
④丙是C和D通过酯化反应得到的产物,有上面得出C和D的结构简式,可以得到丙的式子。
通过与2009年福建试题比较发现,今年高考理综化学选择题“模式化”也比较严重!
2010年
2009年
第6题有关有机化学常识题
第9题有关有机化学常识题
第7题NA考查
第8题NA考查
第8题有关化学基本概念考查
第6题
第9题有关元素化合物钠,铜,碳,硅知识
第7题有关元素化合物硅,硫,铜,铁知识
第10题关于电解质溶液知识
第10题有关水解平衡移动知识
第11题有关电化学知识
第11题有关电化学知识
第12题有关反应速率计算
第12题有关反应速率计算
大题更是都与人们意料的一样中规中矩,但还是看出命题人的变化。
一、加大物构选考题的难度,降低有机选考题的难度,意在纠正全省考生选考物构的导向。尤其是物构选考第(3)小问情景陌生,又要求计算来确定配离子组成。可两题还是很难做到难度相当,分值等价。
二、计算要求提高,除了有机试题,每道大题中都有小问涉及到计算,计算难度虽说不大,但对考生造成心理上的压力不容小视。
三、对于氧化还原反应方程式配平考查加重,在几道大题中有重复出现。
总体上觉得今年试题好于去年,难度有所加大,思维能力、计算能力要求较高,考生反映也是如此,但题目中有些小瑕疵,比如选择题12,30题第(3)小问老师们都有争论,31题中能使Br2/CCl4退色是不是应为褪色。