- 642.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
提升训练26 元素与物质推断(第27题)
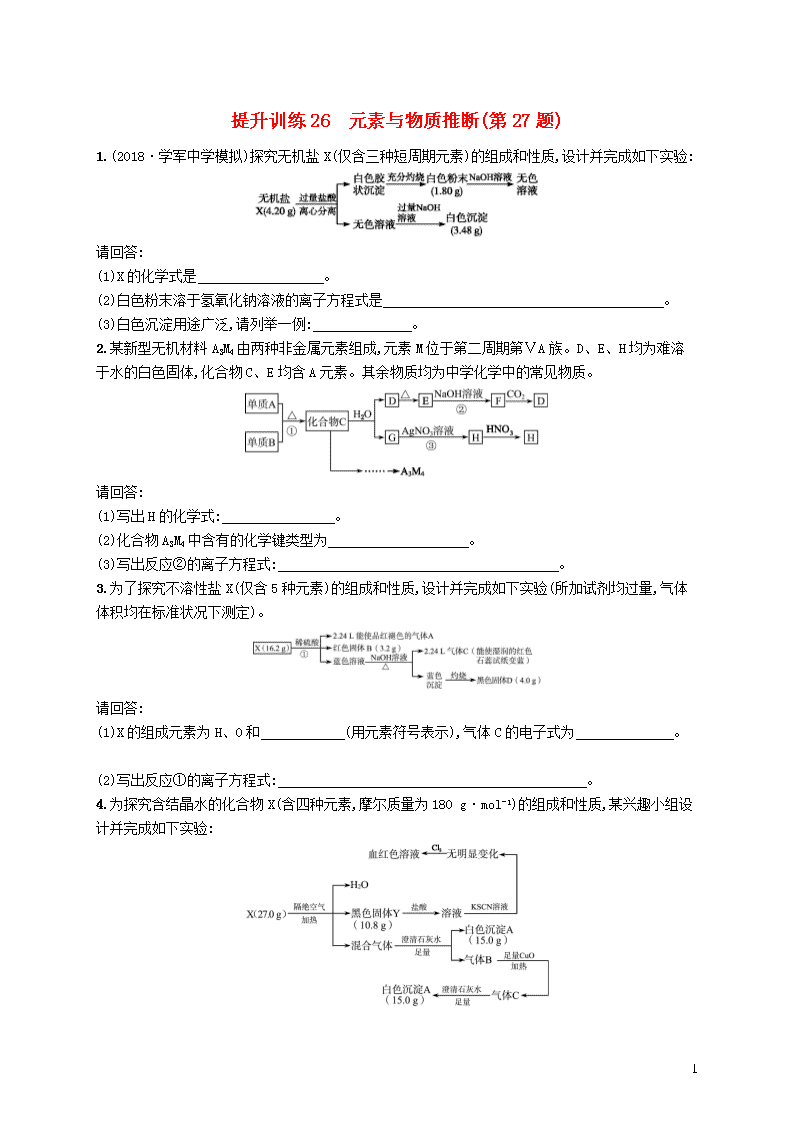
1.(2018·学军中学模拟)探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
请回答:
(1)X的化学式是 。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是 。
(3)白色沉淀用途广泛,请列举一例: 。
2.某新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期第ⅤA族。D、E、H均为难溶于水的白色固体,化合物C、E均含A元素。其余物质均为中学化学中的常见物质。
请回答:
(1)写出H的化学式: 。
(2)化合物A3M4中含有的化学键类型为 。
(3)写出反应②的离子方程式: 。
3.为了探究不溶性盐X(仅含5种元素)的组成和性质,设计并完成如下实验(所加试剂均过量,气体体积均在标准状况下测定)。
请回答:
(1)X的组成元素为H、O和 (用元素符号表示),气体C的电子式为 。
(2)写出反应①的离子方程式: 。
4.为探究含结晶水的化合物X(含四种元素,摩尔质量为180 g·mol-1)的组成和性质,某兴趣小组设计并完成如下实验:
5
请回答:
(1)黑色固体Y的化学式为 ,气体C的电子式为 。
(2)晶体X隔绝空气受热分解的化学方程式为 。
5.某盐A是由三种元素组成的化合物,某研究小组按如图流程探究其组成:
请回答:
(1)写出红棕色固体C的化学式: 。
(2)写出A受热分解反应的化学方程式: 。
(3)写出检验A中阳离子的实验方案: 。
6.为探究某矿物X(仅含三种元素)的组成,设计并完成了如下实验:
已知:气体A能使品红溶液褪色,固体B中仅含CuO、Fe2O3。
请回答:
(1)X的化学式为 。
(2)溶液C中存在的阳离子有 。
参考答案
提升训练26 元素与物质推断(第27题)
1.答案: (1)Mg2SiO4或2MgO·SiO2
(2)SiO2+2OH-Si+H2O
(3)优良的阻燃剂(答案合理即可)
解析: 无机盐X(仅含三种短周期元素),加入过量盐酸溶解,离心分离得到白色胶状沉淀和无色溶液,白色胶状沉淀为硅酸,硅酸充分灼烧得到白色粉末1.80 g为SiO2,其物质的量==0.03 mol,溶于氢氧化钠溶液得到无色溶液为硅酸钠溶液,说明无机盐X中含Si或Si,且物质的量为0.03 mol,若为Si,则其质量=0.03 mol×76 g·mol-1=2.28 g,金属质量=4.20 g-2.28 g=1.92 g
5
,无色溶液中加入过量氢氧化钠溶液生成白色沉淀,则沉淀为Mg(OH)2,则无机盐X中含镁元素的物质的量==0.06 mol,质量为0.06 mol×24 g·mol-1=1.44 g,不符合要求,则无机盐X中含Si,其物质的量为0.03 mol,质量=0.03 mol×92 g·mol-1=2.76 g,金属质量为4.20 g-2.76 g=1.44 g,其物质的量=1.44 g÷24 g·mol-1=0.06 mol,得到X为Mg2SiO4,则(1)X的化学式为Mg2SiO4或2MgO·SiO2;(2)白色粉末溶于氢氧化钠溶液的离子方程式是SiO2+2OH-Si+H2O;(3)氢氧化镁是优良的阻燃剂。
2.答案: (1)AgCl
(2)共价键
(3)SiO2+2OH-Si+H2O
解析: 根据题中各物质转化关系,D受热得E,E能与氢氧化钠溶液反应生成F,F与过量的二氧化碳反应生成D,说明D为弱酸且能受热分解;新型无机材料A3M4由两种非金属元素组成,元素M位于第2周期ⅤA族,应为氮元素,A元素在A3M4中显+4价,化合物C、E均含A元素,D、E、H均为难溶于水的白色固体,可知A3M4应为Si3N4,可以确定A为Si,E为SiO2,F为Na2SiO3,则D为H2SiO3,G与硝酸银溶液反应生成不溶于稀硝酸的沉淀H,则可知G中有Cl-,H为AgCl,故C为SiCl4,B为Cl2;由SiCl4+3H2O4HCl↑+H2SiO3↓,生成G(HCl)。
(1)H的化学式为AgCl;
(2)化合物Si3N4中含有的化学键类型为共价键;
(3)SiO2溶解于NaOH溶液发生反应的离子方程式为SiO2+2OH-Si+H2O。
3.答案: (1)N、S、Cu H····H (2)2NH4CuSO3+4H+Cu+Cu2++2SO2↑+2H2O+2N
解析: A气体能使品红溶液褪色,应是SO2,物质的量是0.1 mol,说明X中含有亚硫酸根或亚硫酸氢根离子。B是红色固体,应该是铜,物质的量是0.05 mol;蓝色溶液和氢氧化钠反应生成能使湿润的红色石蕊试纸变蓝的气体C和蓝色沉淀,说明C是氨气,物质的量是0.1 mol,即X中含有铵根;蓝色沉淀灼烧生成黑色固体D,D是氧化铜,物质的量是0.05 mol。则X中铜离子、铵根和亚硫酸根(或亚硫酸氢根)的物质的量之比是1∶1∶1且均为0.1 mol,而0.1 mol NH4CuSO3的质量恰好是16.2 g。
(1)根据以上分析可知X的组成元素为H、O、N、S、Cu,氨气的电子式为H····H。
5
(2)根据以上分析可知反应①的离子方程式为2NH4CuSO3+4H+Cu+Cu2++2SO2↑+2H2O+2N。
4.答案: (1)FeO ······C······
(2)FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O
解析: 黑色固体Y与盐酸反应的产物遇KSCN溶液无明显现象,通入氯气后,溶液变为血红色,可知Y为FeO,则FeO的物质的量n(FeO)==0.15 mol;混合气体与足量澄清石灰水反应生成15.0 g白色沉淀和气体B,B与足量的CuO反应生成气体C,C能与足量澄清石灰水反应生成15.0 g白色沉淀,根据原子守恒,可知混合气体中含有等物质的量的CO2和CO,即:n(CO)=n(CO2)=n(CaCO3)==0.15 mol。结合X的物质的量n(X)==0.15 mol,X中含有H2O物质的量:n(H2O)=
=
=0.3 mol,则n(X)∶n(FeO)∶n(CO)∶n(CO2)∶n(H2O)=0.15 mol∶0.15 mol∶0.15 mol∶0.15 mol∶0.3 mol=1∶1∶1∶1∶2,推出:X的分子式为FeC2O4·2H2O。
(1)黑色固体Y的化学式为FeO,气体C(CO2)的电子式为······C······;(2)晶体X(FeC2O4·2H2O)隔绝空气受热分解的化学方程式为FeC2O4·2H2OFeO+CO↑+CO2↑+2H2O。
5.答案: (1)Fe2O3
(2)2FeSO4Fe2O3+SO3↑+SO2↑
(3)取少量试样配成溶液,滴入KSCN溶液,若不变色,再滴加少量氯水,出现血红色,证明有亚铁离子
解析: 标准状况下448 mL气体B能与足量BaCl2溶液反应,产生2.33 g白色沉淀,则该气体中有SO3,2.33 g白色沉淀是BaSO4,物质的量为0.01 mol,SO3的物质的量为0.01 mol,448 mL气体B的物质的量为0.02 mol,则气体B中还有0.01 mol SO2
5
,红棕色固体C与盐酸反应生成黄色溶液,则红棕色固体C为Fe2O3,物质的量为1.6 g÷160 g·mol-1=0.01 mol,氧化铁与盐酸反应生成氯化铁和水,氯化铁溶液呈黄色,化合物A中铁原子与硫原子的物质的量之比为1∶1,铁元素、硫元素质量和为(56+32) g·mol-1×0.02 mol=1.76 g,则盐A是由三种元素组成的化合物,另一种元素应为氧,质量为3.04 g-1.76 g=1.28 g,物质的量为0.08 mol,所以化合物中Fe、S、O的物质的量之比为1∶1∶4,A是FeSO4。
(1)根据上述分析,红棕色固体C为氧化铁,化学式为Fe2O3。(2)根据上述分析,A为FeSO4,受热分解生成氧化铁、SO2和SO3,反应的化学方程式为2FeSO4Fe2O3+SO3↑+SO2↑。(3)A为FeSO4,根据Fe2+的检验方法,检验FeSO4中Fe2+的实验方案是取少量试样配成溶液,滴入KSCN溶液,若不变色,再滴加少量氯水,溶液变为血红色,证明有亚铁离子。
6.答案: (1)Cu5FeS4 (2)Fe3+、Cu2+、H+
解析: (1)气体A能使品红溶液褪色,气体A应为SO2,固体B中仅含CuO、Fe2O3,并结合X中含有三种元素,可知X为S、Fe、Cu组成的化合物;固体B溶于足量稀盐酸生成FeCl3和CuCl2,往溶液C中加入5.0 g Cu,剩余1.8 g Cu,则溶解3.2 g Cu,其物质的量为0.05 mol,根据Cu+2Fe3+Cu2++2Fe2+,可知固体B中含有Fe3+的物质的量为0.1 mol,Fe2O3的物质的量为0.05 mol,质量为0.05 mol×160 g·mol-1=8 g,则固体B中CuO的质量为40 g,其物质的量为0.5 mol,原固体X中S的物质的量为=0.4 mol,则化合物X中n(Fe)∶n(Cu)∶n(S)=0.1 mol∶0.5 mol∶0.4 mol=1∶5∶4,X的化学式为Cu5FeS4;
(2)CuO、Fe2O3溶于足量稀盐酸生成FeCl3和CuCl2溶液,则所得溶液C中存在的阳离子有Fe3+、Cu2+、H+。
5