- 229.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考化学实验知识必备
一、基本操作
1、仪器洗涤
(1)内有油脂的试管 NaOH溶液 或洗衣粉或汽油 (2)附有银镜的试管 HNO3溶液
(3)还原CuO后的试管 硝酸 (4)粘有硫磺、白磷、碘的试管 CS2
(5)久置KMnO4溶液的试剂瓶 浓盐酸 (6)熔化硫的试管 NaOH溶液或CS2
(7)久置石灰水的试剂瓶 盐酸 (8)熔化苯酚的试管 酒精或NaOH溶液
(9)盛放乙酸乙酯的试管 NaOH溶 酒精(10)做过Cl—,Br—检验的试管 氨水
2、试纸的使用
红色石蕊试纸 测试碱性试剂或气体 蓝色石蕊试纸 测试酸性试剂或气体
KI淀粉试纸 测试氧化性气体 PH试纸 测试溶液酸碱性
使用方法:检验溶液 取试纸放在表面皿上,玻棒蘸取液体,沾在试纸中心,观察颜色的变化,判断溶液的性质。
注意:使用PH试纸不能用蒸馏水润湿。
3、各种装置的气密性检查方法归纳
(1)、基本方法:
①受热法:将装置只留下1个出口,并先将该出口的导管插入水中,后采用微热(手捂、热毛巾捂、酒精灯微热等),使装置内的气体膨胀。观察插入水中的导管是否有气泡。停止微热后,导管是否出现水柱。
②压水法:如启普发生器气密性检查 ③吹气法
(2)、基本步骤:
①形成封闭出口 ②采用加热法、水压法、吹气法等进行检查
③观察气泡、水柱等现象得出结论。
注:若连接的仪器很多,应分段检查。
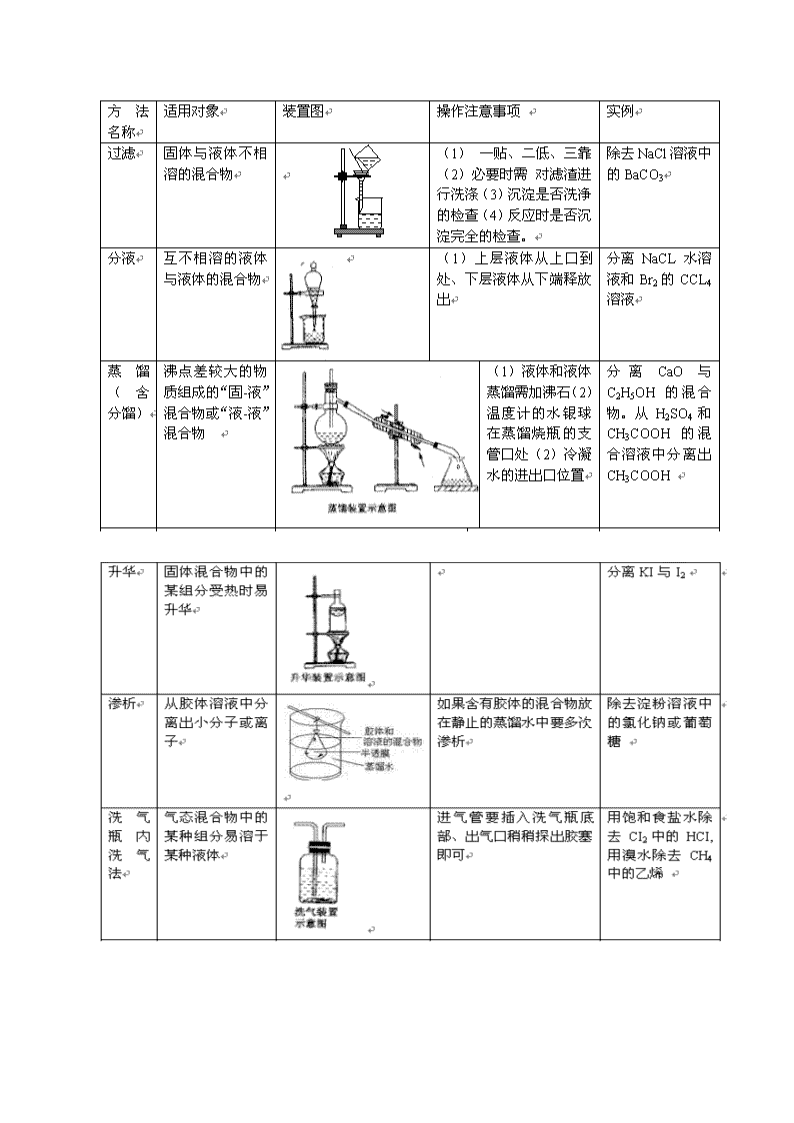
二、混合物分离、提纯常用的方法:
按实验操作方法分类,将有关常用方法及其适应对象列表如下
Ⅱ.常见物质除杂方法
序号
原物
所含杂质
除杂质试剂
主要操作方法
1
N2
O2
灼热的铜丝网
用固体转化气体
2
CO2
H2S
CuSO4溶液
洗气
3
CO
CO2
NaOH溶液
洗气
4
CO2
CO
灼热CuO
用固体转化气体
5
CO2
HCI
饱和的NaHCO3
洗气
6
H2S
HCI
饱和的NaHS
洗气
7
SO2
HCI
饱和的NaHSO3
洗气
8
CI2
HCI
饱和的食盐水
洗气
9
CO2
SO2
饱和的NaHCO3
洗气
10
炭粉
MnO2
浓盐酸(需加热)
过滤
11
MnO2
C
--------
加热灼烧
12
炭粉
CuO
稀酸(如稀盐酸)
过滤
13
AI2O3
Fe2O3
NaOH(过量),CO2
过滤
14
Fe2O3
AI2O3
NaOH溶液
过滤
15
AI2O3
SiO2
盐酸`氨水
过滤
16
SiO2
ZnO
HCI溶液
过滤,
17
BaSO4
BaCO3
HCI或稀H2SO4
过滤
18
NaHCO3溶液
Na2CO3
CO2
加酸转化法
19
NaCI溶液
NaHCO3
HCI
加酸转化法
20
FeCI3溶液
FeCI2
CI2
加氧化剂转化法
21
FeCI3溶液
CuCI2
Fe 、CI2
过滤
22
FeCI2溶液
FeCI3
Fe
加还原剂转化法
23
CuO
Fe
(磁铁)
吸附
24
Fe(OH)3胶体
FeCI3
蒸馏水
渗析
25
CuS
FeS
稀盐酸
过滤
三、气体的制备
1、气体实验装置的设计
(4)装置气密性的检验 【见专题】
3、净化、干燥与反应装置
(
常用的气体干燥剂按酸碱性可分为三类:
①酸性干燥剂,如浓硫酸、五氧化二磷、硅胶。酸性干燥剂能够干燥显酸性或中性的气体,如CO2、SO2、NO2、HCI、H2、Cl2 、O2、CH4等气体。
②碱性干燥剂,如生石灰、碱石灰、固体NaOH。碱性干燥剂可以用来干燥显碱性或中性的气体,如NH3、H2、O2、CH4等气体。
③中性干燥剂,如无水氯化钙等,可以干燥中性、酸性气体,如O2、H2、CH4等。
在选用干燥剂时,显碱性的气体不能选用酸性干燥剂,显酸性的气体不能选用碱性干燥剂。有还原性的气体不能选用有氧化性的干燥剂。能与气体反应的物质不能选作干燥剂,如不能用CaCI2来干燥NH3(因生成 CaCl2·8NH3),不能用浓 H2SO4干燥 NH3、H2S、HBr、HI等。
法,将它转化为CO2气体。
4、收集装置
5、尾气处理装置-安全装置
防止倒吸装置的设计
(3)防污染安全装置:燃烧处理或袋装
三、检验
离子的检验
离子
试剂
现象
注意
沉淀法
Cl-、Br-、I-、
AgNO3+HNO3
AgCl↓白、AgBr↓淡黄、AgI↓黄
SO42-
稀HCl和BaCl2
白色沉淀
须先用HCl酸化
Fe2+
NaOH溶液
白色沉淀→灰绿色→红褐色沉淀
Fe3+
NaOH溶液
红褐色沉淀
Al3+
NaOH溶液
白色沉淀→溶解
不一定是Al3+
气体法
NH4+
浓NaOH溶液和湿润的红色石蕊试纸
产生刺激性气体,使试纸变蓝
要加热
CO32-
稀盐酸+石灰水
石灰水变浑浊
SO32-也有此现象
SO32-
稀H2SO4和品红溶液
品红溶液褪色
显色法
I-
Cl2水(少量),CCl4
下层为紫色
Fe2+
KSCN溶液,再滴Cl2水
先是无变化,滴Cl2水后变红色
Fe3+
①KSCN溶液
红色
②苯酚溶液
紫色
Na+、K+
Pt丝+HCl
火焰为黄色、浅紫色
K+要透过蓝色钴玻璃片