- 271.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考必记的重要的有机化学方程式
一、烃
1.甲烷
▲烷烃通式:CnH2n+2(n ≥1)
点燃
(1)氧化反应
甲烷的燃烧:CH4+2O2 CO2+2H2O 甲烷(烷烃)不可使酸性高锰酸钾溶液及溴水褪色。
光
(2)取代反应
光
一氯甲烷:CH4+Cl2 CH3Cl+HCl (一氯甲烷呈气态,其余三种均为油状液体)
光
二氯甲烷:CH3Cl+Cl2 CH2Cl2+HCl
光
三氯甲烷:CH2Cl2+Cl2 CHCl3+HCl(CHCl3又叫氯仿)
四氯甲烷:CHCl3+Cl2 CCl4+HCl(CCl4又叫四氯化碳,可作灭火剂,是一种重要的有机溶剂)
浓硫酸
170℃
2.乙烯
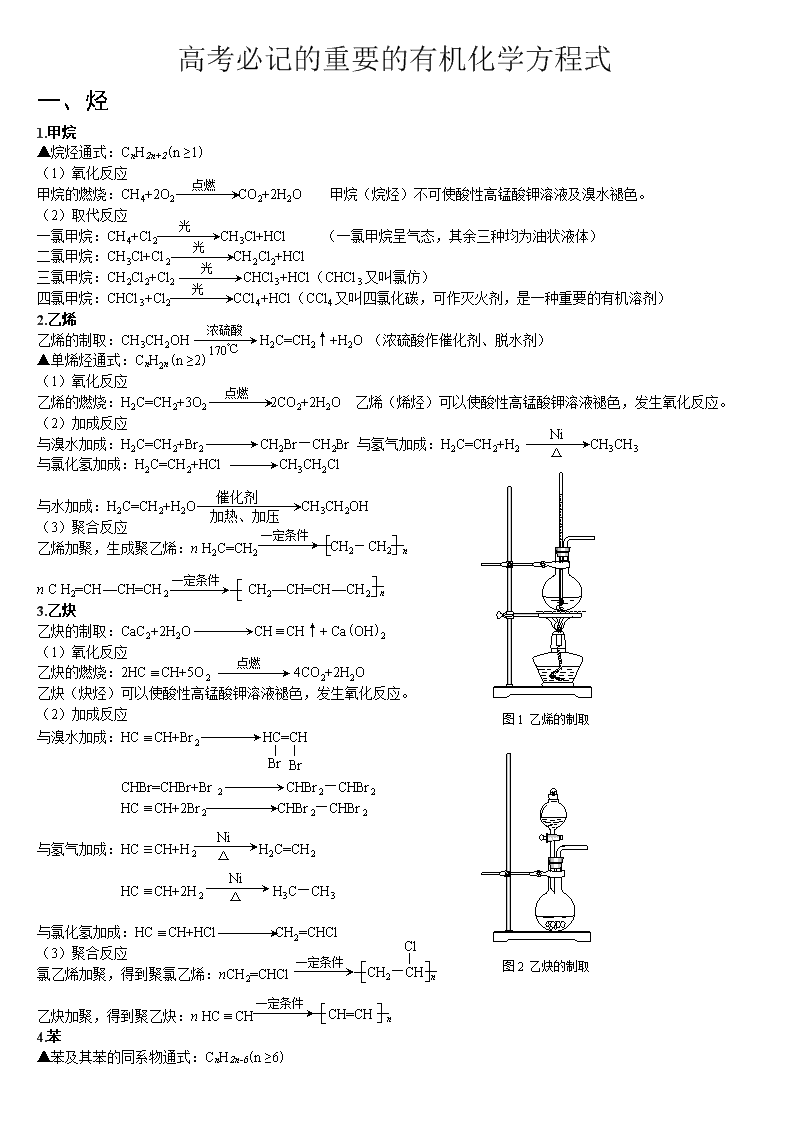
乙烯的制取:CH3CH2OH H2C=CH2↑+H2O (浓硫酸作催化剂、脱水剂)
▲单烯烃通式:CnH2n(n ≥2)
点燃
(1)氧化反应
乙烯的燃烧:H2C=CH2+3O2 2CO2+2H2O 乙烯(烯烃)可以使酸性高锰酸钾溶液褪色,发生氧化反应。
Ni
△
(2)加成反应
与溴水加成:H2C=CH2+Br2 CH2Br—CH2Br 与氢气加成:H2C=CH2+H2 CH3CH3
图1 乙烯的制取
与氯化氢加成:H2C=CH2+HCl CH3CH2Cl
催化剂
加热、加压
与水加成:H2C=CH2+H2O CH3CH2OH
CH2-CH2
一定条件
(3)聚合反应
乙烯加聚,生成聚乙烯:n H2C=CH2 n
一定条件
n C H2=CH—CH=CH2 CH2—CH=CH—CH2 n
3.乙炔
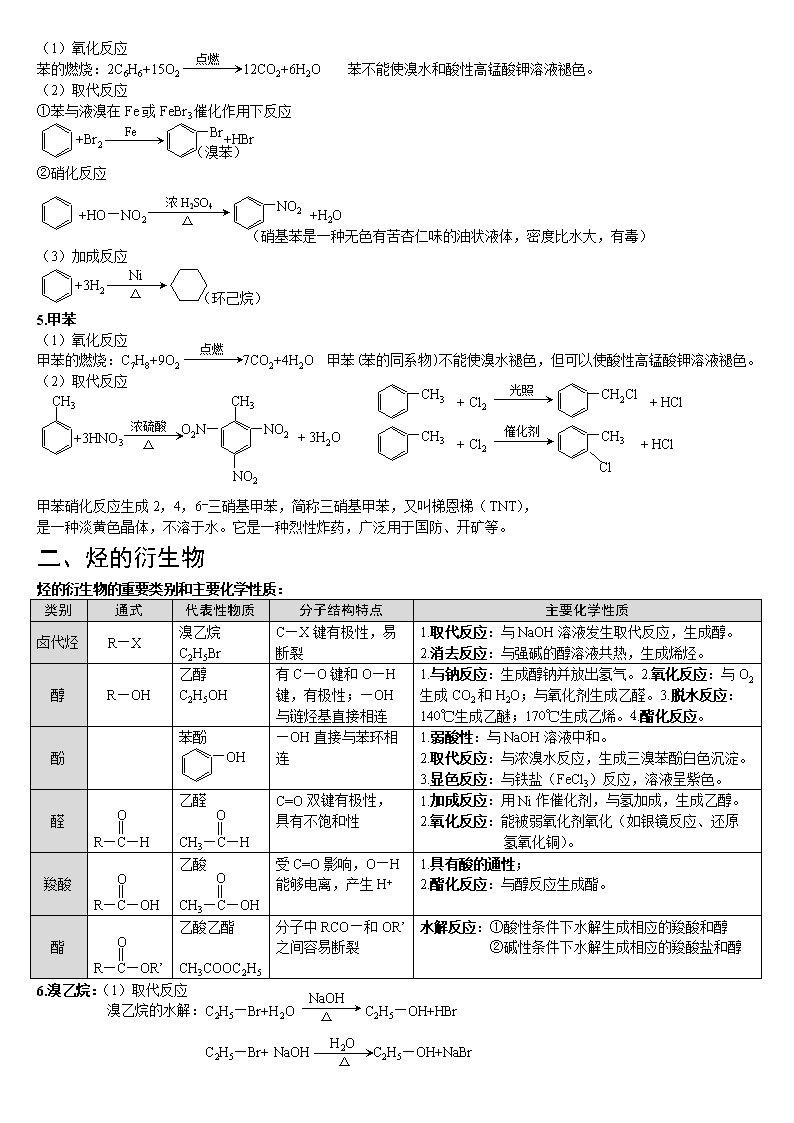
乙炔的制取:CaC2+2H2O CHCH↑+ Ca(OH)2
点燃
(1)氧化反应
乙炔的燃烧:2HCCH+5O2 4CO2+2H2O
乙炔(炔烃)可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应
Br
与溴水加成:HCCH+Br2 HC=CH
图2 乙炔的制取
Br
CHBr=CHBr+Br2 CHBr2—CHBr2
HCCH+2Br2 CHBr2—CHBr2
Ni
△
与氢气加成:HCCH+H2 H2C=CH2
Ni
△
HCCH+2H2 H3C—CH3
Cl
与氯化氢加成:HCCH+HCl CH2=CHCl
CH2—CH
一定条件
(3)聚合反应
氯乙烯加聚,得到聚氯乙烯:nCH2=CHCl n
CH=CH
一定条件
乙炔加聚,得到聚乙炔:n HCCH n
4.苯
▲苯及其苯的同系物通式:CnH2n-6(n ≥6)
点燃
(1)氧化反应
苯的燃烧:2C6H6+15O2 12CO2+6H2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(2)取代反应
Fe
—Br
①苯与液溴在Fe或FeBr3催化作用下反应
+Br2 +HBr
(溴苯)
②硝化反应
—NO2
浓H2SO4
△
+HO—NO2 +H2O
(硝基苯是一种无色有苦杏仁味的油状液体,密度比水大,有毒)
Ni
△
(3)加成反应
+3H2
(环己烷)
5.甲苯
点燃
(1)氧化反应
甲苯的燃烧:C7H8+9O2 7CO2+4H2O 甲苯(苯的同系物)不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
—CH3
—CH2Cl
光照
CH3
|
+3HNO3
浓硫酸
△
O2N—
CH3
|
—NO2
|
NO2
+ 3H2O
(2)取代反应
+ Cl2 + HCl
—CH3
催化剂
—CH3
Cl
+ Cl2 + HCl
甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),
是一种淡黄色晶体,不溶于水。它是一种烈性炸药,广泛用于国防、开矿等。
二、烃的衍生物
烃的衍生物的重要类别和主要化学性质:
类别
通式
代表性物质
分子结构特点
主要化学性质
卤代烃
R—X
溴乙烷
C2H5Br
C—X键有极性,易
断裂
1.取代反应:与NaOH溶液发生取代反应,生成醇。
2.消去反应:与强碱的醇溶液共热,生成烯烃。
醇
R—OH
乙醇
C2H5OH
有C—O键和O—H
键,有极性;—OH
与链烃基直接相连
1.与钠反应:生成醇钠并放出氢气。2.氧化反应:与O2
生成CO2和H2O;与氧化剂生成乙醛。3.脱水反应:
140℃生成乙醚;170℃生成乙烯。4.酯化反应。
酚
—OH
苯酚
—OH直接与苯环相
连
1.弱酸性:与NaOH溶液中和。
2.取代反应:与浓溴水反应,生成三溴苯酚白色沉淀。
3.显色反应:与铁盐(FeCl3)反应,溶液呈紫色。
醛
O
||
R—C—H
O
||
乙醛
CH3—C—H
C=O双键有极性,
具有不饱和性
1.加成反应:用Ni作催化剂,与氢加成,生成乙醇。
2.氧化反应:能被弱氧化剂氧化(如银镜反应、还原
氢氧化铜)。
羧酸
O
||
R—C—OH
O
||
乙酸
CH3—C—OH
受C=O影响,O—H
能够电离,产生H+
1.具有酸的通性;
2.酯化反应:与醇反应生成酯。
酯
O
||
R—C—OR’
乙酸乙酯
CH3COOC2H5
分子中RCO—和OR’
之间容易断裂
水解反应:①酸性条件下水解生成相应的羧酸和醇
②碱性条件下水解生成相应的羧酸盐和醇
NaOH
△
6.溴乙烷:(1)取代反应
溴乙烷的水解:C2H5—Br+H2O C2H5—OH+HBr
H2O
△
C2H5—Br+ NaOH C2H5—OH+NaBr
醇
△
(2)消去反应
溴乙烷与NaOH醇溶液反应:CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
7.乙醇
(1)与钠反应
乙醇与钠反应:2CH3CH2OH+2Na 2CH3CH2ONa+H2↑(乙醇钠)
点燃
(2)氧化反应
乙醇的燃烧: CH3CH2OH+3O2 2CO2+3H2OCu/Ag
△
乙醇的催化氧化:2CH3CH2OH+O2 2CH3CHO+2H2O (乙醛)
2Cu+O2=2CuO (红变黑) CH3CH2OH + CuO CH3CHO+Cu+H2O(黑变红)
乙醇也可被酸性KMnO4溶液(紫红色褪去)、K2Cr2O7溶液(橙红色变绿色)等强氧化剂氧化成羧酸。
浓硫酸
170℃
(3)消去反应
乙醇在浓硫酸作催化剂的条件下,加热到170℃生成乙烯。CH3CH2OH CH2 = CH2↑+ H2O
注意:该反应加热到140℃时,乙醇进行另一种脱水方式,生成乙醚。
浓硫酸
140℃
2C2H5OH C2H5—O—C2H5+H2O (乙醚)
△
(4)取代反应
①乙醇与浓的氢卤酸反应: C2H5OH+HX C2H5X+ H2O ②酯化反应
8.苯酚 苯酚俗称石炭酸,是一种弱酸,不能使指示剂褪色。纯净的苯酚是无色晶体,露置在空气中会因氧化显粉红色。苯酚具有特殊的气味,熔点43℃,常温下水中溶解度不大,当温度高于65℃时可与水以任意比互溶。苯酚易溶于有机溶剂,故常用乙醇清洗苯酚。苯酚有毒,是一种重要的化工原料。
—OH
+NaOH +H2O
—ONa
(1)苯酚的酸性
—O-
—OH
+ H+
—ONa
熔融
+2Na 2 + H2↑
—OH
(苯酚钠)
2
—OH
+ Na2CO3 + NaHCO3
—ONa
苯酚与Na2CO3反应:
—OH
—ONa
▲苯酚钠与CO2反应: +CO2+H2O + NaHCO3
▲酚醛缩聚反应:
—OH
—Br
Br—
OH
|
Br
|
(2)取代反应(可发生酯化反应)
+3Br2 ↓+3HBr
(三溴苯酚,白色沉淀。此反应可用于酚羟基的定性、定量检验)
(3)显色反应:
酚类物质遇Fe3+ 溶液显紫色。显色反应可用于酚羟基的检验)
(4)加成反应:
—OH
Ni
△
—OH
+3H2 (环己醇)
9.乙醛
O
||
乙醛是无色,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发。
Ni
△
(1)加成反应
O
||
乙醛与氢气反应:CH3—C—H+H2 CH3CH2OH
催化剂
△
(2)氧化反应
乙醛与氧气反应:2CH3—C—H+O2 2CH3COOH (乙酸)
水浴
乙醛的银镜反应:
CH3CHO +2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O (乙酸铵)
注意:硝酸银与氨水配制而成的银氨溶液中含有Ag(NH3)2OH(氢氧化二氨合银),
这是一种弱氧化剂,可以氧化乙醛,生成Ag。有关制备的方程式:
Ag++NH3·H2O===AgOH↓+ NH4+(现象:产生白色沉淀)
AgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O(现象:白色沉淀逐渐溶解,溶液变澄清)
△
乙醛还原氢氧化铜:CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O
乙炔水化法制乙醛:
10.乙酸
(1)乙酸的酸性(具有酸的五点通性)
乙酸的电离:CH3COOH CH3COO-+H+
O
||
O
||
(2)酯化反应:(浓硫酸作催化剂、吸水剂)
浓硫酸
△
CH3— C —OH+C2H5—OH CH3— C —OC2H5+H2O (乙酸乙酯)
11.乙酸乙酯
乙酸乙酯是一种具有香味的无色油状液体,密度比水小,难溶于水,能发生水解反应。
无机酸
▲水解反应:
△
CH3COOC2H5+H2O CH3COOH+C2H5OH
CH3COOC2H5+NaOH CH3COONa + C2H5OH
11.其它重要的化学方程式
① (脱羧反应) ②
催化剂
催化剂
③乙烯氧化法制乙醛:
④C12H22O11+H2O C6H12O6+ C6H12O6 ⑤C12H22O11 + H2O 2C6H12O6
催化剂
催化剂
△
蔗糖 葡萄糖 果糖 麦芽糖 葡萄糖
⑥(C6H10O5)n + nH2O nC6H12O6 ⑦(C6H10O5)n + nH2O nC6H12O6
酒化酶
光照、叶绿素
纤维素 葡萄糖 淀粉 葡萄糖
⑧6CO2 + 6H2O C6H12O6 +6O2 ⑨C6H12O6 2C2H5OH +2CO2↑
葡萄糖 葡萄糖 酒精
⑩☆1,3—丁二烯的加成反应:
▲1,2加成:CH2=CH—CH=CH2+Br2BrCH2CHBrCH=CH2
▲1,4加成:CH2=CH—CH=CH2+Br2BrCH2CH=CHCH2Br
▲全部加成:CH2=CH—CH=CH2+2Br2BrCH2CHBrCHBrCH2Br
n
CH2—C = CH —CH2
催化剂
☆1,3—丁二烯的加聚反应:
nCH2=C—CH=CH2
CH3
①自身加聚:
CH3
nCH2=CH—CH=CH2
+nCH=CH2
催化剂
CH2—CH=CH—CH2—CH—CH2
n
C6H5
C6H5
②与碳碳双键的加聚: