- 749.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
w.w.w.k.s.5.u.c.o.m
物质结构与性质选做题专项训练(一)
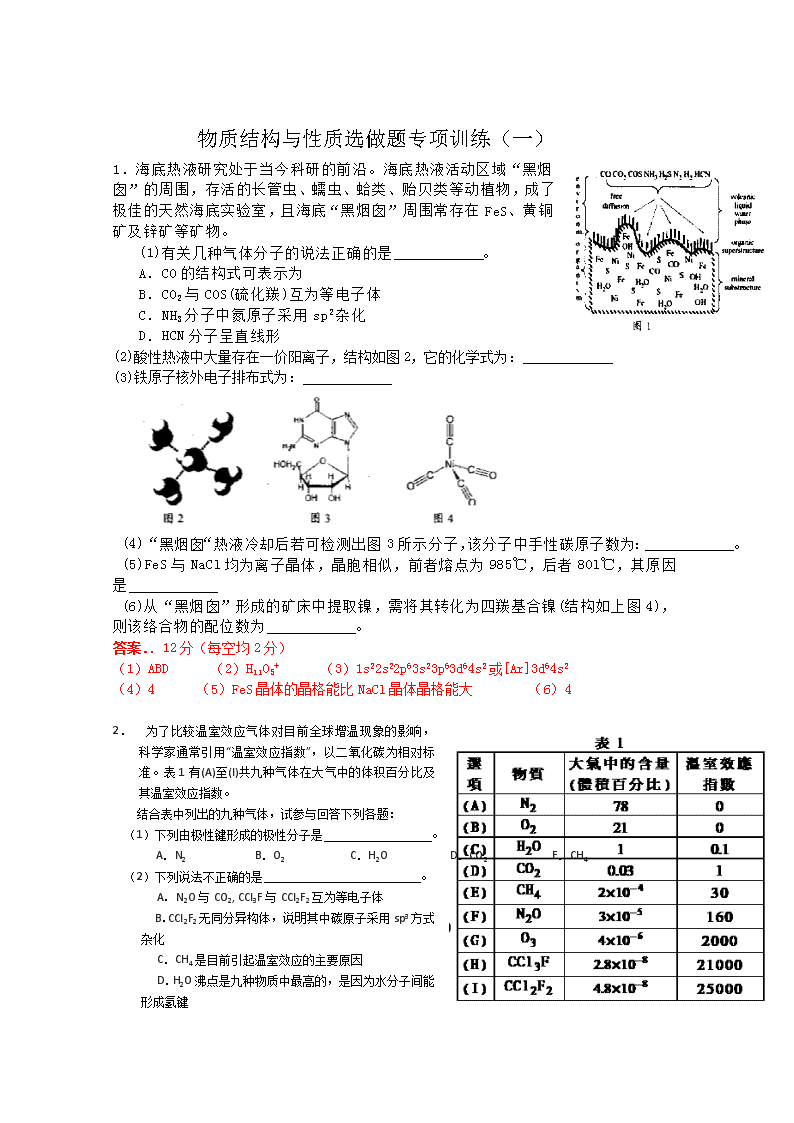
1.海底热液研究处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围,存活的长管虫、蠕虫、蛤类、 贻贝类等动植物,成了极佳的天然海底实验室,且海底“黑烟囱”周围常存在FeS、黄铜矿及锌矿等矿物。
(1)有关几种气体分子的说法正确的是 。
A.CO的结构式可表示为
B.C02与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp2杂化
D.HCN分子呈直线形
(2)酸性热液中大量存在一价阳离子,结构如图2,它的化学式为:
(3)铁原子核外电子排布式为:
(4)“黑烟囱“热液冷却后若可检测出图3所示分子,该分子中手性碳原子数为: 。
(5)FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者80l℃,其原因是
(6)从“黑烟囱”形成的矿床中提取镍,需将其转化为四羰基合镍(结构如上图4),则该络合物的配位数为 。
答案..12分(每空均2分)
(1)ABD (2)H11O5+ (3)1s22s22p63s23p63d64s2或[Ar]3d64s2
(4)4 (5)FeS晶体的晶格能比NaCl晶体晶格能大 (6)4
2. 为了比较温室效应气体对目前全球增温现象的影响, 科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:
(1)下列由极性键形成的极性分子是 。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法不正确的是 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
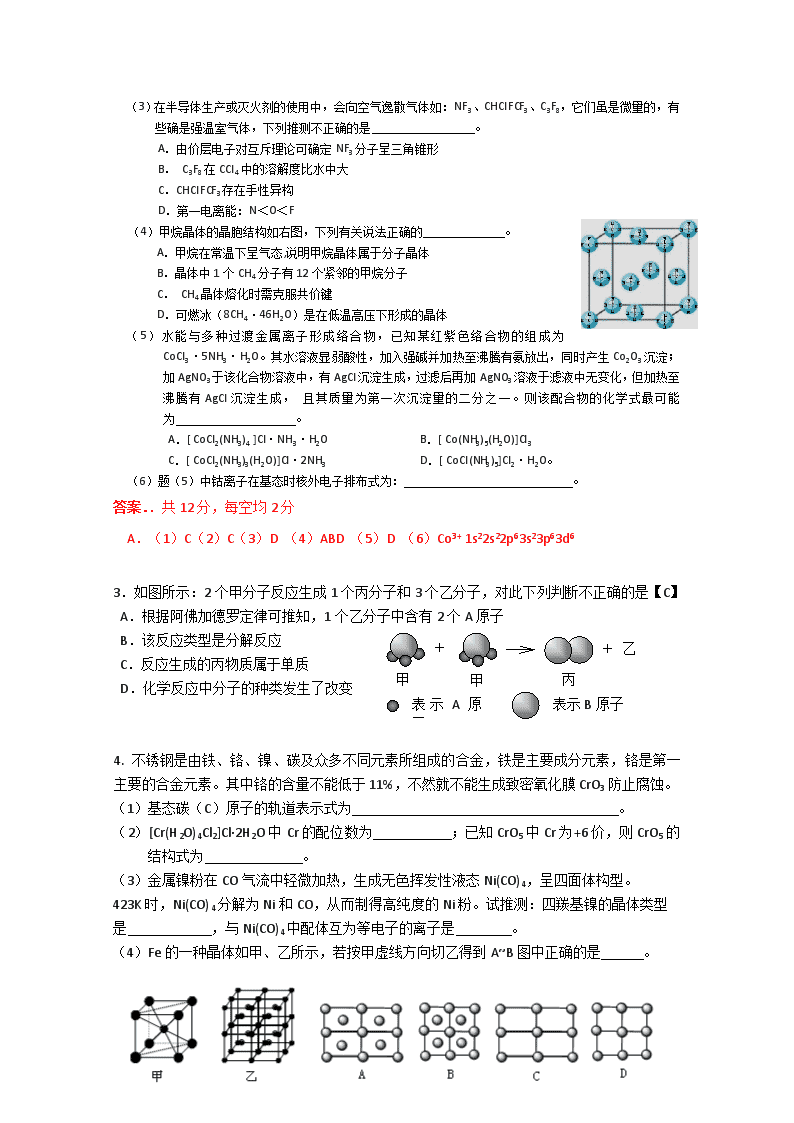
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B. C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)甲烷晶体的晶胞结构如右图,下列有关说法正确的 。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某红紫色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成, 且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为 。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ Co(NH3)5(H2O)]Cl3
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ CoCl(NH3)5]Cl2·H2O。
(6)题(5)中钴离子在基态时核外电子排布式为: 。
答案..共12分,每空均2分
A.(1)C(2)C(3)D (4)ABD (5)D (6)Co3+ 1s22s22p63s23p63d6
3.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是【C】
A.根据阿佛加德罗定律可推知,1个乙分子中含有2个A原子
+
+ 乙
甲
甲
丙
表示A原子
表示B原子
B.该反应类型是分解反应
C.反应生成的丙物质属于单质
D.化学反应中分子的种类发生了改变
4. 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀。
(1)基态碳(C)原子的轨道表示式为 。
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为 ;已知CrO5中Cr为+6价,则CrO5的结构式为 。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。
423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是 ,与Ni(CO)4中配体互为等电子的离子是 。
(4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到A~B图中正确的是 。
(5)据报道,只含镁、镍和碳三种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中每个镁原子周围距离最近的镍原子有 个。
图中:碳原子用小球,镍原子用大球,镁原子用大球
答案.(12分)A(1) (2分)
(2) 6(1分) (1分)
(3) 分子晶体 (1分) CN-、C22-(任写一个)(2分)
(4) A (2分)
(5) MgCNi3 (2分) 12 (1分)
1.
5. 均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。
请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为 (用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是 。
(3)B分子的空间构型为 形,该分子属于 分子。(填“极性”或“非极性”)
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式 ,该反应中反应物Cu原子的基态电子排布式为 。铜晶体中铜原子的堆积方式为面心立方堆积,右图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子。
(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为 。
答案.A.(1)N>O>Cl>S(2分)
(2)HF分子间形成氢键(1分)
(3)V形(或角形)(1分) 极性分子(1分)
(4)Cu+2H++H2O2=Cu2++2H2O(2分) [Ar]3d104s1(1分) 4(1分)
(5)sp3(1分) 2(1分) CO(1分)
6.已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂。E有“生物金属”之称,E离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为 。
(2)下列叙述正确的是 。(填字母)
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个键和1个键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧的配位数为 。
(4)电镀厂排放的废水中常含有剧毒的BC离子,可在Q的催化下,先用NaClO将 BC氧化成BCD,再在酸性条件下BCD继续被NaClO氧化成C2和BD2。
① A、B、C、D四种元素的电负性由小到大的顺序为 。
② 与BCD互为等电子体的分子、离子的化学式依次为 (各写1种)。
③ 上述反应中后一步反应的离子方程式是 。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3·6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为 。
答案.A.(1) 3d2阶段4s2(1分)
(2)ad (2分)
(3)TiO2(1分) 3(1分)
(4)① H