- 1.84 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考化学模拟大题综合训练
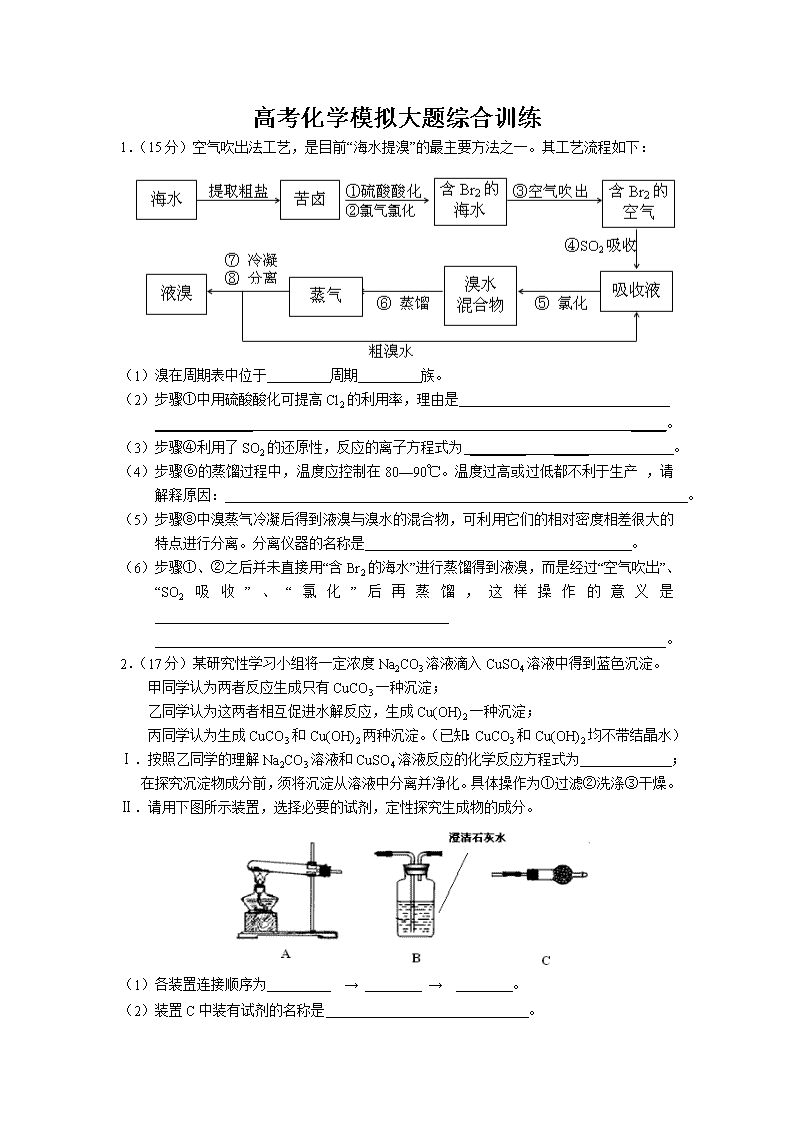
1.(15分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)溴在周期表中位于 周期 族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是
______________ _____。
(3)步骤④利用了SO2的还原性,反应的离子方程式为 ________ _____ 。
(4)步骤⑥的蒸馏过程中,温度应控制在80—90℃。温度过高或过低都不利于生产 ,请解释原因: 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是__________________________________________
_________________________________________________________________________。
2.(17分)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(已知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为 ;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(1)各装置连接顺序为 → → 。
(2)装置C中装有试剂的名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。
(1)装置C中碱石灰的作用是 ,实验开始时和实验结束时都要通入过量的空气其作用分别是 。
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:
3(15分)为了探究硫化钠晶体(Na2S•nH2O)在空气中的变化,某兴趣小组的实验步骤及现象记录如下:①将少量硫化钠晶体置于表面皿上,暴露在空气中;②三天后将样品放入盛水的烧杯中,搅拌后得无色澄清溶液;③取少量该溶液加入过量盐酸中,有气体放出,且溶液保持澄清。
(1)请你根据上述记录,对放出气体进行猜想:
猜想①:可能是H2S ; 猜想②:可能是SO2 ; 猜想③可能是CO2;
猜想④:可能是 ; 猜想⑤:可能是 。
(2)若放出的气体是两种气体的混合气,现有:浓、稀2种品红溶液,浓、稀2种溴水,澄清石灰水,浓、稀2种盐酸溶液、试管气体发生装置,洗气瓶、试管洗气装置。请设计一个组合实验分析混合气的组成,在下表中简要写出实验方法、现象和结论:
实验方案
可能的现象和相应的结论
(3)如果要检验硫化钠晶体是否被氧化生成了硫酸钠,请简要说明检验的方法、现象和结论: 。
4.(17分)某有机物甲和A互为同分异构体, 经测定它们的相对分子质量小于100;将1mol甲在O2中充分燃烧得到等物质的量的CO2和H2O (g ) ,同时消耗112LO2(标准状况);在酸性条件下将1 mol甲完全水解可以生成1 mol 乙 和1mol丙 ;而且在一定条件下,丙可以被连续氧化成为乙。
⑴.请确定并写出甲的分子式 ;与甲属同类物质的同分异构体共有 种(包含甲)。
⑵.经红外光谱测定,在甲和A的结构中都存在C=O双键和C-O单键,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系:
A
E
F
高聚物G
HBr(氢溴酸)、△
OH-/H2O
OH-/醇 △
一定条件
B
C
乙
①Ag(NH3)2OH、H2O
D
浓H2SO4、△
△ H2/Pt
HIO4
△
②酸化
.
⑶.E → F 的反应类型为 反应 ;
⑷.G 的结构简式为 ;
⑸.B →D的反应化学方程式为: _ ;
⑹.写出C在条件①下进行反应的化学方程式: 。
5.(16分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下。
Cu片
A
B
C
D
浓硫酸
K1
K2
Na2CO3溶液
和硫粉
NaOH溶液
I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
① I中,圆底烧瓶中发生反应的化学方程式是 。
② II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 。
“停止C中的反应”的操作是 。
③ III中,“过滤”用到的玻璃仪器是(填仪器名称) 。
④ 装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(2)依据反应2S2O32—+I2=S4O62—+2I—,可用I2的标准溶液测定产品的纯度。取5.5 g 产品,配制成100 mL溶液。取10 mL溶液,以淀粉溶液为指示剂,用浓度为0.050 mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
编 号
1
2
3
4
溶液的体积/mL
10.00
10.00
10.00
10.00
消耗I2标准溶液的体积/mL
19.99
19.98
17.13
20.03
① 判断达到滴定终点的现象是 。
② Na2S2O3•5H2O在产品中的质量分数是(计算结果保留1位小数) 。
(Na2S2O3•5H2O的式量为248)
6. (12分)为减小和消除CO2对环境的影响,有科学家提出“绿色自由”构想。即先把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
甲醇
高温水蒸气
N2、O2
H2
溶液
空气
盛有饱和K2CO3
溶液的吸收池
分解池
合成塔
(2×105Pa、300℃、
铬锌触媒)
(1)写出分解池中反应的化学方程式 。
(2)在合成塔中,当有4.4kg CO2与足量H2完全反应,可放热4947 kJ,写出合成塔中反应的热化学方程式 。
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式 。
当电子转移为 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)在容积为1 L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应。
有关物质的浓度随时间变化如下图所示。
c(mol/L)
0.75
1.00
0.50
0.25
0
3
10
t(min)
CO2
CH3OH
①从反应开始到平衡,H2的平均反应速率v(H2)=____________。
②若其它条件不变,只将温度提高到800℃,再次达平衡时,n(CH3OH)/n(CO2)比值 (填“增大”、“减小”或“不变”)。
MnO2
浓盐酸
7.(14分)二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰(MnCl2,可溶盐)等。下图是制取并探究Cl2化学性质的装置图。
(1)已知锰元素的常见化合价为+7、+6、+4、+2,写出圆底烧瓶中反应的化学方程式 。
(2)A中m管的作用是 ,装置F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热却不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
① 实验b的目的是 ; 实验c的目的是 。
② 实验现象:a、c、 e有黄绿色气体生成,而b、、d没有黄绿色气体生成。由此得出影响氯气生成是原因是 。
8. (12分)某工厂用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如下:
回答下列问题:
(1)利用该流程制备硫酸铵的化学方程式为________________________________。
(2)上述流程中,可以循环使用的物质是_____________、____________(写化学式)。
(3)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是____________。
a.蒸干 b.蒸发 c.冷却结晶 d.过滤
(4) 常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3g和2.1×10-1g,往CaSO4悬浊液中加入Na2CO3溶液可得到CaCO3,请解析CaSO4向CaCO3转化的原因 。
(5)取2mol的NH3,放入容积为2.0 L的密闭容器中,反应在一定条件下达到平衡时,NH3的转化率为80%。该条件下此反应的平衡常数为 。
9.(1
4分)某化学小组利用下图所示的实验装置测定生铁样品(除铁和碳外,不含其它杂质)中铁的质量分数,并探究浓硫酸的性质(某些夹持仪器已略去;忽略实验前装置中的空气和实验后残留气体)。已知酸性KMnO4溶液可以把硫 从+4价氧化为 +6价。
(1)开始时A中碳和浓硫酸发生反应的化学方程式为 。
(2)装置B中的现象是 ;装置E的作用是 。
(3)装置C的作用是 ;证明此结论的实验现象是 。
(4)此装置存在一定的缺陷,改进的方法是 。
(5)利用改进后的装置进行实验,若实验前称取m g生铁样品,实验结束后D管增重b g,则此样品中铁的质量分数为 (用数学式表示)。
10.(12分)钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要
杂质SiO2)与碳粉混合装入氯化炉中,在高温
下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4。
III.在TiCl4中加水、加热,水解得到沉淀
TiO2·xH2O。
IV.TiO2·Xh2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是 。II中所采取的操作名称是 。
②III中反应的化学方程式是 。
③如IV在实验室完成,应将TiO2·xH2O放在 (填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O,其过程大致如下:
a. O2→2O b. O2+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”部分原理。(夹持装置已略去)
①如缓通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重11g,则CO的转化率为 。
②当CO气体全部通入后,还要通一会儿空气,其目的是 。
11.(16分)
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)①废水I若采用CO2处理,离子方程式是 。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO-3)越大,净水效果越好,这 是因为 。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2++ =====CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含 Hg2+3×10-17mo1,是否达到了排放标准 (填“是”或“否”)。
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比 为5:2,则该反应的离子方程式为 。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I.取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液 滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr20,溶液的仪器是 。
②Ⅱ中,碎瓷片的作用是 。
③III中,发生的反应为:Cr2O2-7+6Fe2++14 H+==2Cr3++6Fe3+7H2O
由此可知,该水样的化学需氧量COD= (用含c、V1、V2的表达式表示)。
30.(15分)某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题。(有关实验药品为:市售食用白醋样品500mL、0.1000mol / L NaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液。)
Ⅰ.实验步骤:
⑴用滴定管吸取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液。
⑵用酸式滴定管取待测食醋溶液20.00mL于 中。
⑶盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数。
⑷滴定,并记录NaOH的终读数。重复滴定2-3次。
Ⅱ.实验记录及数据处理
滴定次数
实验数据
1
2
3
4
V(样品)/mL
20.00
20.00
20.00
20.00
V(NaOH)/mL(初读数)
0.00
0.200
0.10
0.00
V(NaOH)/mL(终读数)
14.98
15.20
15.12
15.95
V(NaOH)/mL(消耗)
14.98
15.00
15.02
15.95
回答下面的问题
①步骤(2)使用到的仪器名称为:
②下列可用于测定溶液pH且精确度最高的是 ( )
A酸碱指示剂 B pH计 C精密pH试纸 D广泛pH试纸
③若用标准盐酸溶液滴定NaOH溶液时,由滴定前仰视读数,滴定结束时俯视读数,这样使求得的NaOH的物质的量浓度 ( )
A.偏低 B.偏高 C.偏低或偏高或不能确定 D.不受影响
④在酸碱中和滴定法测定食醋的总酸量的实验中根据上面的实验数据
则c(样品)/ moL·L-1= ;样品总酸量g / 100mL= 。
12.(16分)亚氯酸钠()是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知①的溶解度随温度升高而增大,适当条件下可结晶析出。
②纯易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③溶液是指固体溶于水制得体积为的溶液。
(1)溶液的物质的量浓度为 mol/L。
若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
A、将氧化成,增强酸性 B、稀释以防止爆炸
C、将还原成
(3)吸收塔内发生反应的化学方程式 。吸收塔的温度不能超过,其目的是 。
(4)在碱性溶液中比较稳定,所以吸收塔中应维持稍过量,判断是否过量的简单实验方法是 。
(5)从滤液中得到粗晶体的实验操作依次是 (选填序号)。
A、蒸馏 B、蒸发 C、灼烧 D、过滤 E、冷却结晶
要得到更纯的晶体必须进行的操作是 (填操作名称)
13.(16分)抗甲流感药物达菲(Tamiflu)是以莽草酸(A)为原料,经过十步反应合成制得。莽草酸可以从常用的烹调香料“八角”中提取。达菲及A(莽草酸)、B的结构简式如下:
已知:
化合物A、B、C、D存在下图所示的转化关系:
回答下列问题:
(1)写出达菲中含氧官能团的名称: ;
(2)写出A→C的反应类型: ;
(3)写出B→E的化学方程式: ;
(4)写出D的结构简式: ;
(5)已知B有多种同分异构体,写出一种符合下列性质的B的同分异构体的结构简式
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。
(6)设计A生成C的目的 。
14.(17分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”,下同);使用催化剂则平衡 移动,反应的△H_____________(填“增大” “减小” 或“不变”)。
(2)已知:O2 (g)=O2+(g)+e- H1= 1175.7 kJ·mol-1
PtF6(g)+ e-PtF6-(g) H2= —771.1 kJ·mol-1
O2+PtF6- (s)=O2+ (g)+ PtF6-(g) H3= 482.2 kJ·mol-1
则反应O2(g)+ PtF6(g)= O2+PtF6- (s) 的H=_____________。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
(4)7℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)N2O4(g)的平衡常数K。
15. (15分) 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
溶解
吸收塔
NaClO3
配料
ClO2发生器
H2O
稀H2SO4
160g/L
NaOH
SO2和空
气混合气
H2O2
过滤
滤液
NaClO2•3H2O
3
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
⑴ 160 g/L NaOH溶液的物质的量浓度为 。
⑵ 发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;c.将NaClO3氧化成ClO2
⑶ 吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
⑷ 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
⑸ 吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
⑹ 从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)
16.(18分)某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实验。
(1)用下图A所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当
时(填实验现象),说明“铁与水蒸气”能够进行反应。写出铁与水蒸气反应的化学方程式 。A
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算出铁粉的转化率。
① 收集并测量气体体积应选上图M,N中的 装置
② 称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度约为0.088g/L,最好选用 规格的量筒(选填字母序号)
A.100ml B.200ml C.500ml D.1000ml
(3)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解,过滤。向滤液中滴加KSCN溶液,观察溶液的颜色。在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满)。
现象
结论与解释
可能①
可能②
17.(16分) 超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2, 化学方程式如下:
2NO+2CO2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s)
0
1
2
3
4
5
c(NO)
(mol/L)
1.0×10- 3
4.50×10- 4
2.50×10- 4
1.50×10- 4
1.0×10- 4
1.0×10- 4
c(CO)
(mol/L)
3.6×10- 3
3.05×10- 3
2.85×10- 3
2.75×10- 3
2.7×10- 3
2.7×10- 3
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率υ(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验
编号
T(℃)
NO初始浓度
(mol/L)
CO初始浓度
(mol/L)
催化剂的比表面积(m2/g)
Ⅰ
280
1.20×10-3
5.80×10-3
82
Ⅱ
124
Ⅲ
350
124
①请在上表空格中填入剩余的实验条件数据。(3分)
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。(4分)
18.(15分)A~J均为有机化合物,它们之间的转化如下图所示:
实验表明:
① D既能发生银镜反应,又能与金属钠反应放出氢气:
② 核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③ G能使溴的四氯化碳溶液褪色;
④ 1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题:
(1) A的结构简式为____________,由A生成B的反应类型是__________反应;(4分)
(2) D的结构简式为_____________;(2分)
(3) 由E生成F的化学方程式为_______________ _________________________ ,E中的官能团有_____________(填名称),与E具有相同官能团的E的同分异构体还有________________ (任写两个,不考虑立体结构);(6分)
(4) G的结构简式为________________;(1分)
(5) 由I生成J的化学方程式________________________________________。(2分)
答案
1.(15分) (1)4 ,VIIA (2分)
(2)酸化可抑制Cl2 、Br2与水反应(3分)
(3)Br2+SO2+2H2O=4H++2Br-+SO42-(2分)
(4)温度过高,产生大量水蒸气,溴蒸气中水蒸气增加;温度过低,溴不能完全蒸出,吸收率低。(3分)
(5)分液漏斗(2分)
(6)“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低。(3分)
2.(17分)
Ⅰ.Na2CO3 +CuSO4 +H2O=Cu(OH)2↓+Na2SO4+CO2↑(2分);
Ⅱ.(1)A→C→B(2分)(2)无水硫酸铜(2分)(3)装置B中澄清石灰水变浑浊(2分)
Ⅲ.(1)吸收空气中的水蒸气和CO2(2分),开始时通入处理过的空气可以将装置中原有含水蒸气和CO2的空气排出;结束时通入处理过的空气可以将装置中滞留的水蒸气和CO2排出。(4分) (2)(1-49n/9m)x 100%(3分)
3.(15分)
(1)H2S与CO2的混合气体(2分);SO2 和CO2的混合气体(2分)
(2)(8分)
实验方案
可能的现象和相应的结论
在试管气体发生装置中加入适量的固体样品和稀盐酸(2分),组装好后将产生体依次通过盛有稀品红溶液、浓溴水、稀溴水和澄清石灰水的试管洗气装置(2分)
若品红褪色,浓溴水不变黄色浑浊,稀溴水不褪色,澄清石灰水变浑浊,(1分)该气体含有SO2、CO2的混合气体(1分)
若品红不褪色,浓溴水褪色(或颜色变浅)且变黄色浑浊,澄清石灰水变浑浊,(1分),该气体为H2S、CO2的混合气体(1分)
(其它类似合理方法、现象和结论同样分步骤给分。提示:SO2与H2S不共存;选洗气瓶浪费药品且多产生废物,选试管洗气装置节约试剂;选稀品红溶液易观察褪色现象;先通过浓溴水一方面可观察H2S被氧化生成S沉淀现象,另一方面可尽量吸收氧化SO2,以防SO2进入后一步澄清石灰水溶解CaCO3而干扰观察;在石灰水前面加装稀溴水洗气装置是为了便于观察SO2是否在上一步吸收完全)
(3) 取题中实验③后所得溶液滴入BaCl2溶液,若有沉淀出现说明生成了Na2SO4;若无沉淀,则说明没有生成Na2SO4(3分)。
4、
5.(16分)(1)①(2分)Cu+2H2SO4(浓) CuSO4 + SO2↑+2H2O
②(2分)Na2S2O3在酸性溶液中不能稳定存在
(2分)打开K2,关闭K1
③(2分)漏斗、玻璃棒、烧杯
④(2分)NaOH
(2分)在C中的反应停止后,吸收A中产生的多余SO2 ,防止空气污染
(2)①(2分)加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变
②(2分)90.2 %
6.(12分)(1)2KHCO3 K2CO3+H2O +CO2 ↑
(2)CO2(g)+ 3H2(g)= CH3OH(g)+ H2O(g) ΔH=-49.47kJ/mol
(3)CH3OH + 8OH- - 6e- = CO32-+ 6H2O ; 1.2
(4) ① 0.225 mol/(L·min); ② 减小
7.(14分)(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)连通烧瓶和分液漏斗,平衡压强,使分液漏斗中液体顺利流下;防止G中溶液倒吸到E中
(3)饱和食盐水
(4)2Fe2++Cl2 2Fe3++2Cl- ;溶液变蓝
(5) ① 探究c(Cl-) 的影响;探究c(H+) 的影响 ② c(H+) 大小
8.(12分)(1)CaSO4+2NH3+CO2+ H2O→CaCO3+ (NH4)2SO4(2分)
(2)CO2 (2分) NH3 (2分)
(3)b c d (2分)
(4)从CaSO4向CaCO3转化中并存着两个沉淀溶解平衡,
CaSO4(s) Ca2+(aq)+SO42-(aq)
+
CO32- (aq) CaCO3(s) (1分)
因为CaCO3的溶解度比CaSO4的溶解度更小,随着Na2CO3溶液的加入,CO32-浓度增大,平衡向CaSO4溶解和CaCO3沉淀生成的方向移动,使CaSO4转化成CaCO3。(1分)
(5)17.28 (2分)
9.(14分)(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分)
(2)品红溶液褪色;(2分) 除去空气中的水和二氧化碳。(2分)
(3)除去CO2中的SO2;(2分)酸性KMnO4溶液颜色变浅。(2分)
(4)在C与D之间增加盛有浓硫酸的洗气瓶 (画图也行)意思对即可。(2分)
(5) (2分)
10.(12分) (1)①液态(1分) 蒸馏(1分)
△
②TiCl4+(x+2)H2O TiO2·xH2O↓+4HCl
③b(2分)
(2)①极性共价键(1)
②氧化性(1分)
(3)①25%(2分)
②将残留在装置中的CO2气体排出,被NaOH溶液吸收,减少误差(2分)
11.(16分)(1)①OH-+CO2 HCO3- (2分)
②HCO3-会促进Al3+的水解,生成更多的Al(OH)3,净水效果增强(2分)
③CH4(2分) 否(2分)
④4Cl2+2CN-+4H2O 10Cl-+2CO2+N2+8H+(2分)
(2)①酸式滴定管(或移液管)(2分)
②防止暴沸(2分)
③8000(15-cV2)/V1(2分)
12.(15分)
⑴ 4mol/L(2分)
⑵ b(1分)
⑶ 2NaOH+2ClO2+H2O2 =2 NaClO2+2H2O+O2(2分);防止H2O2分解(2分)
⑷ 连续测定吸收塔内溶液的pH(3分)
⑸ a (1分)
⑹ b、e、d(2分),重结晶(2分)
13.(18分)
(1)肥皂泡破裂,有爆鸣声(2分) 3Fe + 4H2O Fe3O4 + 4H2↑(2分)
(2) ①N (2分) ②B(2分)
(3)
现象
结论与解释
可能①
溶液变为红色(1分)
反应后的固体混合物中含有+3价的Fe。(1分)
因为Fe3+ 遇到KSCN溶液时变成血红色。(2分)
可能②
溶液仍然为浅绿色
(1分)
反应后的固体混合物中可能含有+3价的Fe,也可能不含+3价的Fe。(3分)因为如果铁粉有剩余,剩余铁粉会与Fe3+ 反应,将溶液中Fe3+ 完全还原为Fe2+。(2分)
14.(16分)
(1)<(2分) (2)1.88×10-4 mol·L-1·s-1(2分)
(3)5000 (3分) (4)C、D(2分)
(5)①Ⅱ:280、1.20×10-3、5.80×10-3(2分)
Ⅲ:1.20×10-3、5.80×10-3(1分)
②如下图:(4分)
15.(15分)
(1)BrCH2CH=CHCH2Br (2分) 取代(或水解)(2分)
(2)(2分)
(3)
(2分) 羧基、羟基(2分)
(2分,任些两个)
(4)(1分) (5)(2分)
30.(15分每空3分)
①锥形瓶
②B
③A
④0.75 4.5
31.(每空2分)(1)4 溶液的密度 (2)B (3)2ClO2+2NaOH+H2O2=2NaClO2+O2+H2O 防止H2O2受热分解 (4)连续测定溶液的pH (5) B、 E、 D 重结晶
32.(1)醚键 肽键 酯基(3分)(2)酯化(或取代)(2分)
(3)(3分)
(4)(3分)
(5)(任写一种)(3分)
(6)保护羟基,防止被氧化(2分)
33.(1)向左;不变(各2分)(2)—77.6 kJ·mol-1(3分)(3)Cu(OH)2(3分);2NH3·H2O+Cu2+=Cu(OH)2↓+2 NH4+;(3分)(4)根据题意知平衡时: c(N2O4 )=0.0120mol·L-1 ,c(NO2)=0.0300mol·L-1 K= c(N2O4 )/c2(NO2) =0.0120/0.0300×0.0300 =13.3(4分)
书是我们时代的生命——别林斯基
书籍是巨大的力量——列宁
书是人类进步的阶梯———高尔基
书籍是人类知识的总统——莎士比亚
书籍是人类思想的宝库——乌申斯基
书籍——举世之宝——梭罗
好的书籍是最贵重的珍宝——别林斯基
书是唯一不死的东西——丘特
书籍使人们成为宇宙的主人——巴甫连柯
书中横卧着整个过去的灵魂——卡莱尔
人的影响短暂而微弱,书的影响则广泛而深远——普希金
人离开了书,如同离开空气一样不能生活——科洛廖夫
书不仅是生活,而且是现在、过去和未来文化生活的源泉 ——库法耶夫
书籍把我们引入最美好的社会,使我们认识各个时代的伟大智者———史美尔斯
书籍便是这种改造灵魂的工具。人类所需要的,是富有启发性的养料。而阅读,则正是这种养料———雨果