- 629.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
绝密★启用前
2015 年普通高等学校招生全国统一考试(新课标 II)
理科综合能力测试
化学部分
第 I 卷
7.食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是( )
A.硅胶可用作食品干燥剂
B.P2O5 不可用作食品干燥剂
C.六水合氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
8.某羧酸酯的分子式为 C18H26O5,1mol 该酯完全水解可得到 1mol 羧酸和 2mol 乙醇,该羧
酸的分子式为( )
A.C14H18O5 B.C14H16O4 C.C14H22O5 D.C14H10O5[来源:学科网]
9.原子序数依次增大的元素 a、b、c、d,它们的最外层电子数分别为 1、6、7、1。a-的电
子层结构与氦相同,b 和 c 的次外层有 8 个电子,c-和 d+的电子层结构相同。下列叙述
错误的是( )
A.元素的非金属性次序为 c>b>a
B.a 和其他 3 种元素均能形成共价化合物
C.d 和其他 3 种元素均能形成离子化合物
D.元素 a 、b、c 各自最高和最低化合价的代数和分别为 0、4、6
10.NA 代表阿伏加德罗常数的值。下列叙述正确的是( )
A.60g 丙醇中存在的共价键总数为 10NA
B.1L 0.1mol·L-1 的 NaHCO3 溶液中 HCO3-和 CO32-离子数之和为 0.1NA
C.钠在空气中燃烧可生成多种氧化物。23g 钠充分燃烧时转移电子数为 1NA
D.235g 核素 U 发生裂变反应: U+ n Sr+ U+10 n,净产生的中子
( n)数为 10NA
11.分子式为 C5H1 0O2 并能与饱和 NaHCO3 溶液反应放出气体的有机物有(不含立体异构)
( )
A.3 种 B.4 种 C.5 种 D.6 种
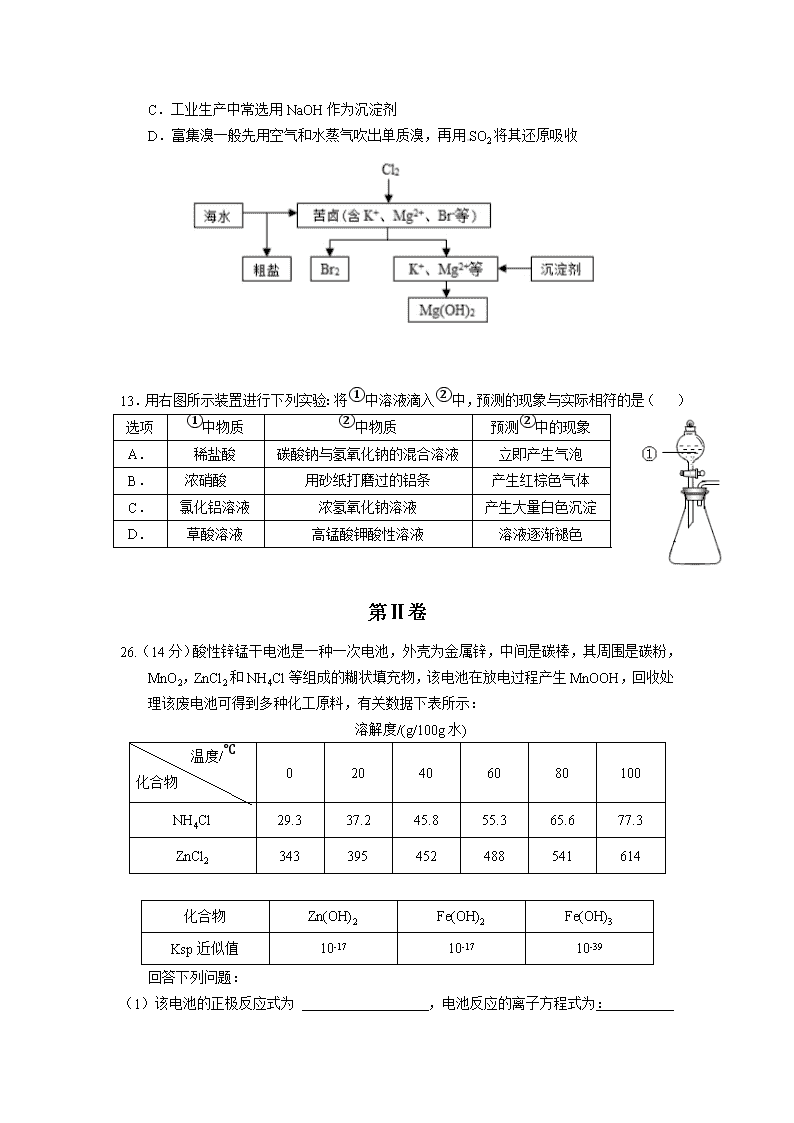
12.海水开发利用的部分过程如图所示。下列说法错误的是( )
A.向苦卤中通入 Cl2 是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
235
92
235
92
1
0
90
38
136
54
1
0
1
0
C.工业生产中常选用 NaOH 作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用 SO2 将其还原吸收
13.用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
选项 ①中物质 ②中物质 预测②中的现象
A. 稀盐酸 碳酸钠与氢氧化钠的混合溶液 立即产生气泡
B. 浓硝酸[来 用砂纸打磨过的铝条 产生红棕色气体
C. 氯化铝溶液 浓氢氧化钠溶液 产生大量白色沉淀
D. 草酸溶液 高锰酸钾酸性溶液 溶液逐渐褪色
第Ⅱ卷
26.(14 分)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,
MnO2,ZnCl2 和 NH4Cl 等组成的糊状填充物,该电池在放电过程产生 MnOOH,回收处
理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g 水)
温度/℃
化合物 0 20 40 60 80 100
NH4Cl 29.3 37.2 45.8 55.3 65.6 77.3
ZnCl2 343 395 452 488 541 614
化合物 Zn(OH)2 Fe(OH)2 Fe(OH)3
Ksp 近似值 10-17 10-17 10-39
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为 0.5A,电池工作五分钟,理论上消耗 Zn g。(已经 F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2 和 NH4Cl,二者可通过
分离回收;滤渣的主要成分是 MnO2、______和 ,欲从中得到较纯的 MnO2,最
简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备 ZnSO4·7H2O 的过程中 ,需去除少量杂质铁,其方法是:加稀硫
酸和 H2O2 溶解,铁变为 ,加碱调节至 pH 为 时,铁刚好完全沉
淀(离子浓度小于 1×10-5mol/L 时,即可认为该离子沉淀完全);继续加碱调节至 pH
为_____时,锌开始沉淀(假定 Zn2+浓度为 0.1mol/L)。若上述过程不加 H2O2 后果
是 ,原因是 。
27.(14 分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为 CO、CO2
和 H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
③C O2(g)+H2(g) CO(g)+H2O(g) △H3[来源:学科网 ZXXK]
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 H—H C—O
C
O
H—O C—H
E/(kJ.mol-1) 436 343 1076 465 413
由 此 计 算 △H1 = kJ · mol-1 , 已 知 △H2 = -58kJ · mol-1 , 则 △H3 =
kJ·mol-1。
(2)反应①的化学平衡常数 K 的表达式为 ;图 1 中能正确反映平衡常数 K
随 温 度 变 化 关 系 的 曲 线 为 ( 填 曲 线 标 记 字 母 ) , 其 判 断 理 由
是 。
(3)合成气的组成 n(H2)/n(CO+CO2)=2.60 时,体系中的 CO 平衡转化率(α)与温度和压
强的关系如图 2 所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因
是 。图 2 中的压强由大到小为 ,其判断
理由是 。
28.(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列
问題:
(1)工业上可用 KC1O3 与 Na2SO3 在 H2SO4 存在下制得 ClO2,该反应氧化剂与还原剂物质
的量之比为 。
(2)实验室用 NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备 ClO2:
①电解时发生反应的化学方程式为 。
②溶液 X 中大量存在的阴离子有__________。
③除去 ClO2 中的 NH3 可选用的试剂是 (填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用右图装置可以测定混合气中 ClO2 的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用 50 mL 水溶解后,再加入 3 mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用 0.1000 mol·L-1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),
指示剂显示终点时共用去 20.00 mL 硫代硫酸钠溶液。在此过程中:
①锥形瓶内 ClO2 与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V 中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中 ClO2 的质量为 g。
(4)用 ClO2 处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物
质最适宜的是_______(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
36.【化学——选修 2:化学与技术】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧
化 法 生 产 苯 酚 和 丙 酮 , 其 反 应 和 工 艺 流 程 示 意 图 如 下 :
[
相关化合物的物理常数
物质 相对分子质量 密度(g/cm-3) 沸点/℃
异丙苯 120[ 0.8640 153
丙酮 58 0.7898 56.5
苯酚 94 1.0722 182
回答下列问题:
(1)在反应器 A 中通入的 X 是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜 C 中加入的 Y 为少置浓硫酸,其作用是______,优点是用量少,缺点是
_______________。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在 50-60℃,温度过高的安全隐
患是 。
(5)中和釜 D 中加入的 Z 最适宜的是 (填编号。已知苯酚是一种弱酸)。
a. Na OH b. CaCO3 c. NaHCO3 d. CaO
(6)蒸馏塔 F 中的馏出物 T 和 P 分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
37.[化学—选修 3:物质结构与性质](15 分)A、B、C、D 为原子序数依次增大的四种元索,
A2-和 B+具有
相同的电子构型;C、 D 为同周期元索,C 核外电子总数是最外层电子数的 3 倍;D 元素最
外层有一个未
成对电子。回答下列问题:
(1) 四种元素中电负性最大的是 ( 填元素符号),其中 C 原子的核外电子排布式为
__________。
(2)单质 A 有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A
和 B 的氢化物所属的晶体类型分别为 和 。
(3)C 和 D 反应 可生成组成比为 1:3 的化合物 E, E 的立体构型为 ,中心原子
的杂化轨道类型为 。
(4)化合物 D2A 的立体构型为 ,中心原子的价层电子对数为 ,单质 D 与湿润
的 Na2CO3 反应可制备 D2A,其化学方程式为 。
(5)A 和 B 能够形成化合物 F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学
式为 :晶胞中 A 原子的配位数为 ;列式计算晶体 F 的密度(g.cm-3) 。
38.[化学一选修 5:有机化学基础](15 分)
聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有
很好的应用前景。 PPG 的一种合成路线如下:
已知:
①烃 A 的相对分子质量为 70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物 B 为单氯代烃:化合物 C 的分子式为 C5H8;
③E、F 为相对分子质量差 14 的同系物,F 是福尔马林的溶质;
④ 。
回答下列问题:
(1)A 的结构简式为 。
(2)由 B 生成 C 的化学方程式为 。
(3)由 E 和 F 生成 G 的反应类型为 ,G 的化学名称为 。
(4) ①由 D 和 H 生成 PPG 的化学方程式为 。
②若 PPG 平均相对分子质量为 10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76 d.122
(5)D 的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和 NaHCO3 溶液反应产生气体 ②既能发生银镜反应,又 能发生皂化反应
其中核磁共振氢谱显示为 3 组峰,且峰面积比为 6:1:1 的是 (写结构简式):
D 的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是
_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
2015 年普通高等学校招生全国统一考试
理科综合化学答案及评分参考
第 I 卷
选择题
7.C 8.A 9.B 10.C 11.B 12.C 13.D
第 II 卷
26.(14 分)
(1)
(注:式中 可写为 , 等, 可写为 )
(2)0.05
(3)加热浓缩、冷却结晶 碳粉 空气中加热 碳粉转变为 ,
氧化为
(4) 2.7 6 和 分离不开 和 的 相
近
27.(14 分)
(1)—99;+41
(2) (或 )
a;反应①为放热反应,平衡常数数值应随温度升高变小;
(3)减小 升高温度时,反应①为放热反应,平衡向左移动,使得体系中 CO 的量增
大;反应③为吸热反应,平衡向右移动,又使产生 CO 的量增大;总结果,岁温度升高,
使 CO 的转化率降低
相同温度下,由于反应①为气体分数减小的反应,加压有利于提
)(c)(c
)(c
2
2
3
HCO
OHCHK •=
2MnO H e MnOOH+ ++ + =
2
22 2 2MnO Zn H MnOOH Zn+ ++ + = +
2Zn + ( )2
3 4Zn NH + ( )3 22Zn NH Cl H +
4NH +
MnOOH 2CO MnOOH
2MnO
3Fe + 2Zn + 2Fe + ( )2Fe OH ( )2Zn OH 3PK
( )
( ) ( )3
2
2·P
p CH OHK p CO p H
=
3 2 1p p p> >
升 CO 的转化率;而反应③为气体分子数不变的反应,产生 CO 的量不受压强影响。
故增大压强时,有利于 CO 的转化率升高
28.(15 分)
(1) 2:1
(2)①NH4Cl+2HCl 3H2↑+NCl3
②Cl—、OH—
③c
(3)①2ClO2+10I-+8H+=5I2+4H2O+2Cl-
②吸收残余的二氧化氯气体(避免碘的逸出)
③淀粉溶液;
溶液由蓝色变为无色,且半分钟内溶液颜色不再改变
① 0.02700
(1)d
36.(15 分)
(1) (或空气)
(2)A C
(3)催化剂(提高反应速率) 腐蚀设备
(4 )放热 可能会导致(过氧化物)爆炸
(5)c
(6)丙酮 苯酚 丙酮的沸点低于苯酚
(7)原子利用率高
37.(15 分)
(1)O 1s22s22p63s23p3(或[Ne] 3s23p3)
(2)O3 O3 相对分子质量较大,范德华力大
分子晶体 离子晶体
(3)三角锥形 sp3
(4)V 形 4 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl
(或 2Cl2+Na2CO3=Cl2O+CO2+2NaCl)
电解
2O
(5)Na2O 8 3
12337 /g27.2mol1002.6)cm10566.0(
/g624 cmmol =—— ×××
×
相关文档
- 高考真题——历史江苏卷Word版含答2021-05-1313页
- 高考古诗鉴赏万能答题模式2021-05-135页
- 三维设计广东文人教版2014高考数学2021-05-134页
- 近5年高考数学理科试卷全国卷1分类2021-05-136页
- 高考英语一轮巩固达标练Unit3Lifei2021-05-137页
- 2010年普通高等学校招生全国统一考2021-05-1315页
- 有关光合作用图像的高考题整理2021-05-1347页
- 2014高考英语真题短文改错2015带解2021-05-1318页
- 物理高考试题——理综全国卷2物理2021-05-1313页
- 高考生物试题及答案上海卷2021-05-1319页