- 930.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
2008 年高考化学试题汇编
实验题
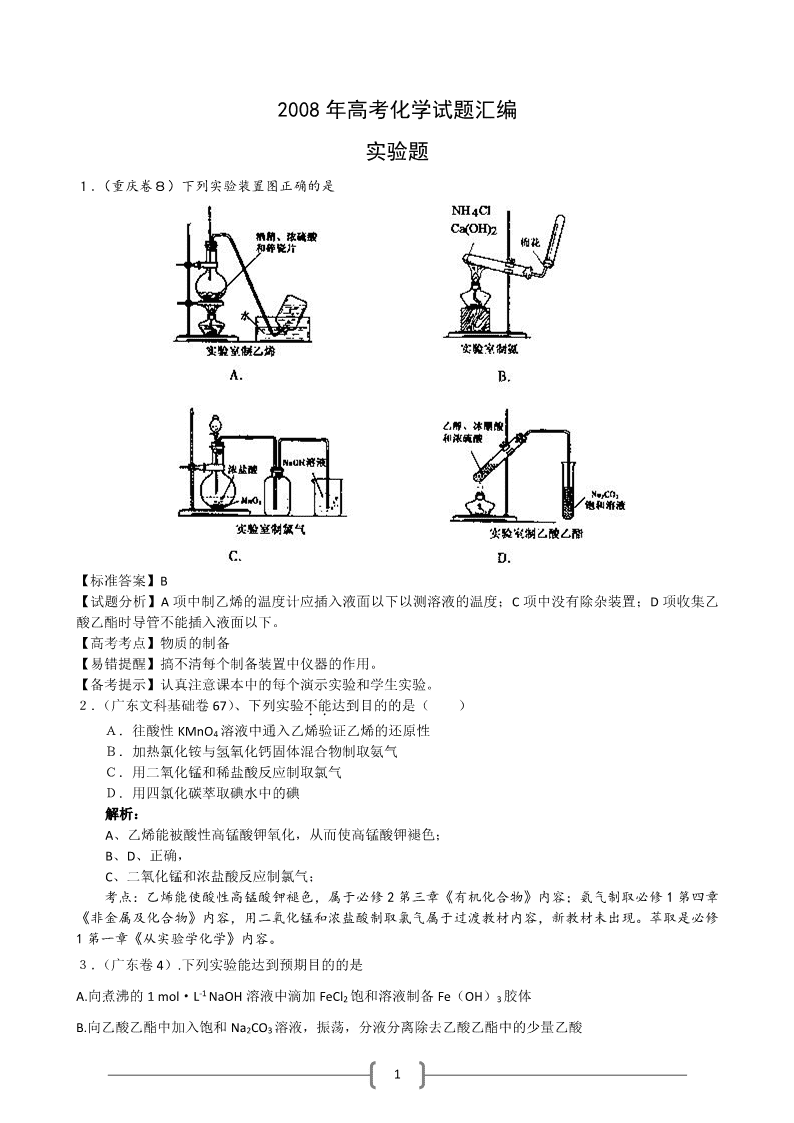
1.(重庆卷8)下列实验装置图正确的是
【标准答案】B
【试题分析】A 项中制乙烯的温度计应插入液面以下以测溶液的温度;C 项中没有除杂装置;D 项收集乙
酸乙酯时导管不能插入液面以下。
【高考考点】物质的制备
【易错提醒】搞不清每个制备装置中仪器的作用。
【备考提示】认真注意课本中的每个演示实验和学生实验。
2.(广东文科基础卷 67)、下列实验不能..达到目的的是( )
A.往酸性 KMnO4 溶液中通入乙烯验证乙烯的还原性
B.加热氯化铵与氢氧化钙固体混合物制取氨气
C.用二氧化锰和稀盐酸反应制取氯气
D.用四氯化碳萃取碘水中的碘
解析:
A、乙烯能被酸性高锰酸钾氧化,从而使高锰酸钾褪色;
B、D、正确,
C、二氧化锰和浓盐酸反应制氯气;
考点:乙烯能使酸性高锰酸钾褪色,属于必修 2 第三章《有机化合物》内容;氨气制取必修 1 第四章
《非金属及化合物》内容,用二氧化锰和浓盐酸制取氯气属于过渡教材内容,新教材未出现。萃取是必修
1 第一章《从实验学化学》内容。
3.(广东卷 4).下列实验能达到预期目的的是
A.向煮沸的 1 mol·L-1 NaOH 溶液中滴加 FeCl2 饱和溶液制备 Fe(OH)3 胶体
B.向乙酸乙酯中加入饱和 Na2CO3 溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
2
C.称取 19.0 g SnCl2,用 100 mL 蒸馏水溶解,配制 1.0 mol·L-1 SnCl2 溶液
解析:配制 FeCl3 胶体无需用 NaOH 溶液,否则会生成 Fe(OH)3 沉淀,A 错。SnCl2 易发生水解,应该先
将固体 SnCl2 溶于浓盐酸,再加水稀释配制,C 错。检验葡萄糖,应用新制的氢氧化铜溶液,加热检验,而
不是用氢氧化铜粉末,D 错。答案:B
4.(天津卷 13).下列实验方法合理的是
A、 可用水鉴别已烷、四氯化碳、乙醇三种无色液体
B、油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C、可用澄清石灰水鉴别 Na2CO3 溶液和 NaHCO3 溶液
D、为准确测定盐酸与 NaOH 溶液反应的中和热,所用酸和碱的物质的量相等
【解析】三种物质和水混合后,己烷在水的上层,四氯化碳在水的下层,乙醇不分层,所以可以用水鉴别
三者,故 A 项正确;油脂皂化后应用盐析的方法,是高级脂肪酸钠和甘油分离,所以 B 错;Na2CO3 和 NaHCO3
和 Ca(OH)2 反应,均可产生 CaCO3 沉淀,故 C 项错误;为了使反应充分进行,应使一方过量,而不是使二
者物质的量相等,所以 D 错。答案:A
5.(海南卷 2)、PH 试测定溶液 pH 的正确操作是:
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比
色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸
上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
解析:这是一道PH试测定的常规题,主要考查学生的实验基本操作。
6.(江苏卷)6. 下列装置或操作能达到实验目的的是
解析:A中收集氨气装置无棉花,(棉花的目的是防止气体对流,在计短的时间内收集满氨气);B 中右边
烧杯中电解质溶液应收硫酸铜,C 是实验中常见检查气密性的装置,C 对;收集比空气重的气体应该是长
进短出故 D 错。答案:C
7.(江苏卷)9.以下实验或操作不能达到目的的是
A.用溴水鉴别苯、乙醇、四氯化碳
B.准确称取 0.4000g 的 NaOH 固体配成 1000mL 浓度为 0.01000 mol·L-1 的溶液
C.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
3
D.用激光笔检验淀粉溶液的丁达尔现象
解析:苯与溴水分层且苯在上层,乙醇与溴水互溶,四氯化碳与溴水分层且四氯化碳在下层,可以鉴别,
A 可以达到目的;天平的准确度只有 0.1 克,所以不能称取 0.4000g 的 NaOH 固体,故 B 不能达到目的;苯
酚与溴水虽然能反应生成不溶于水的三溴苯酚白色沉淀,但三溴苯酚又溶于苯中,所以 C 不能达到目的,
淀粉是胶体可用丁达尔现象检验,故 D 能达到目的。答案:B.C
8.(北京卷 9)、下列各组物质的无色溶液,不用其它试剂即可鉴别的是
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 ④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③ C.①③④ D.①②④
点拨:只用一种试剂进行鉴别,常规题型。
9.(广东理科基础 21).下列实验能达到目的的是
A.在容量瓶中加一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B.用稀硫酸和锌粒反应制氢气时加入少许硫酸铜以加快反应速率
C.用玻璃棒搅拌漏斗中的液体以加快过滤的速度
D.加入盐酸以除去硫酸钠中的少量碳酸钠杂质
解析:浓度的配置不能直接在容量瓶中配置 A 错,用稀硫酸和锌粒反应制氢气时加入少许硫酸铜时形成了
铜锌原电池,锌为负极从而加快了反应速率 B 对,过滤时应在烧杯中搅拌,故 C 错,用盐酸以除去硫
酸钠中的少量碳酸钠杂质时引入了新的杂质氯化钠故 D 错。答案:B
10.(广东理科基础 31).从绿色化学的理念出发,下列实验不宜..用图 7 所示装 置 进 行 的
是
A.不同浓度的硝酸与铜反应
B.稀硫酸与纯碱或小苏打反应
C.铝与氢氧化钠溶液或盐酸反应
D.H2O2 在不同催化剂作用下分解
解析:图 7 所示装置没有尾气吸收的装置,所以凡是有污染的气体都不行,故 B、C、
D 都没有污染的气体,只有 A 有氮氧化合物产生,所以 A 不行。答案 A
11.(广东理科基础 32).用石灰水、小苏打、淀粉和食醋等不能..完成的实验是
A.碘盐中碘的检验 B.暖瓶中水垢的除去
C.食盐和纯碱的鉴别 D.鸡蛋壳主要成分的检验
解析:碘盐中含的是碘元素,故不能检验碘盐中的碘,故 A 不能..完成此实验;B、C、D 都可以。答案 A
12.(广东理科基础 35).下列有关 Cl、N、S 等非金属元素化合物的说法正确的是
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用 NaOH 溶液处理 NO2 和 HCl 废气
D.Al2(SO4)3 可除去碱性废水及酸性废水中的悬浮颗粒
解析:漂白粉的主要成分为次氯酸钙,故 A 错;实验室不能用浓硫酸干燥氨气,因为它们会发生反应生成
硫酸铵,故 B 错;NO2 和 HCl 都是酸性气体,所以可用 NaOH 中和,故 C 对;Al2(SO4)3 不能除去碱性废水及
酸性废水中的悬浮颗粒,故 D 错。答案 C
13.(四川卷 26.)某固体混合物可能含有 MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3 和 CuSO4。将该混
合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的
物质在相应位置填“无”):
4
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
肯定存在的物质 肯定不存在的物质 理由
(2)取溶液进行焰色反应,火焰呈黄色;
肯定存在的物质 肯定不存在的物质 理由
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
肯定存在的物质 肯定不存在的物质 理由
(4)通过上述实验仍无法确定的物质是______________。
【解析】本题主要考查离子的检验和共存。
(1)混合物放入水中得到无色溶液,肯定无 CuSO4,因为 CuSO4 溶液是蓝色的。因为 BaCO3、BaSO4、
MgCO3 等都是不溶于水的白色沉淀,所以无法确定存在哪些物质。
(2)焰色反应呈黄色,说明存在钠盐,即混合物中肯定含有 Na2SO4。不能确定哪种物质肯定不存在。
(3)在(2)中通过焰色反应,确定混合物中含有 Na2SO4,则混合物中一定不含 Ba(NO3)2 溶液,否则
和 Na2SO4 生成 BaSO4,不溶于盐酸;另外混合物中也一定不含 AgNO3 溶液,否则加入盐酸生成白色 AgCl
沉淀。白色沉淀溶于盐酸,并放出气体,则一定为 MgCO3。
(4)通过上述试验仍无法确定是否含有 Al2(SO4)3。
【答案】(l)
(2)
(3)
MgCO3 Ba(NO3)2 AgNO3 MgCO3 沉淀溶于盐酸,有气体放出;如有
Ba(NO3)2 ,生成的 BaSO4 沉淀不溶于盐酸;如有
AgNO3,生成的沉淀在盐酸中不消失。
(4)Al2(SO4)3
【知识点归纳】无机物鉴别颜色方面的突破口:
1、红色世界
(1)基态:Fe2O3 (红褐色)、Fe (OH)3 (红 棕色)、[Fe (SCN)]2+ (血红色)、Cu (紫红色)、Cu2O (砖
红色)、NO2 (红棕色)、P(红磷、暗红色)、Br2 (深红棕色)、红色石蕊试纸、 品红溶液。
(2)激发态:充氦气的灯光呈粉红色,充氖气的灯光呈红色,钙元素的焰色呈砖红色。
(3)化学变化:
无 CuSO4 溶液无色,而 CuSO4 溶液为蓝色
Na2SO4 无 钠的焰色反应呈黄色
5
①紫色石蕊在酸性溶液(pH<5.0)中变红,
②润湿的蓝色石蕊试纸遇酸性(CO2、SO2 、H2S 、HCl)变红,
③酚酞在碱性溶液中呈浅红色(8.210),
④甲基橙在酸性溶液(pH<3.1)中呈红色,
⑤甲基红在酸性溶液(pH<4.4)中呈红色,
⑥pH 试纸(黄色)遇酸性溶液(pH<2)变红,
⑦已经被二氧化硫褪色的品红溶液在加热时会出现红色,
⑧C(NaHSO4)>0.001mol/L 时遇甲基橙变红。
2、橙色世界
(1)基态:浓溴水 、甲基橙试剂、Br2 (CCl4)呈橙红色。
(2)化学变化:甲基橙在酸性溶液(3.14.4)溶液中呈黄色,
②久置的浓硝酸因溶有自身分解产生的二氧化氮而变黄
4、绿色世界
(1)基态:F2 (浅黄绿色)、Cl2 (黄绿色)、Cu 2(OH)2CO3 (绿色)CuCl2(浓溶液呈绿色)、FeSO4 (浅
绿色)
(2)激发态:铜元素的焰色呈绿色
(3)化学变化:Fe (OH)2 (白色)—— 灰绿色——Fe (OH)3(红棕色)
5、青色世界
(1)基态:铁粉、银粉及大多数金属粉末、石墨、CuO 、 CuS 、Cu2S FeO 、 Fe3O4 、 MnO2
(2)化学变化:
①蔗糖遇浓硫酸被炭化变黑,
②润湿的白色醋酸铅试纸遇 H2S 变黑,
③硫磺粉与白色的水银反应生成黑红色的 HgS,
④H2S 通入 Pb(NO3)2 、 AgNO3 、 CuSO4 溶液产生不溶于水也不溶于稀盐酸和稀硫酸的黑色沉淀。
6、蓝色世界
(1)基态:CuSO4 (溶液)、 CuSO4 •5H2O (晶体)、液氧、臭氧
(2)化学变化:
①紫色石蕊在碱性溶液(pH>8)中变蓝,
②润湿的红色石蕊试纸遇碱性气体变蓝,
③无水 CuSO4 (白色粉末)遇水变蓝,
④H2、H2S 、 CH4 、C2H5OH 燃烧火焰呈淡兰色,CO 燃烧火焰呈蓝色,
6
⑤S8 在空气中燃烧呈淡蓝色火焰,在纯氧中燃烧呈现明亮的蓝紫色火焰,
⑥淀粉遇 I2 (aq)变蓝,
⑦Cl2 、 Br2 、 NO2 、O3 遇湿润的淀粉碘化钾试纸变蓝
7、紫色世界
(1)基态:KMnO4 (H+)、紫色石蕊、碘单质呈紫黑色
(2)激发态:充氩气的灯光呈紫蓝色,钾元素的焰色呈紫色(透过蓝色钴玻璃观察)
(3)化学变化:
①I2 升华生紫烟,
②NH4I 受热生紫烟,
③紫色石蕊在(5.0