- 394.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
30 物质的检验、分离和提纯
时间:4分钟 分值:100分
一、选择题(共0分,每小题分)
1.能鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液的试剂是( )
A.HNO3 B.OH
C.BaCl2 D.NaClO
[答案]A
[解析]本题考查物质的鉴别。HNO3氧化I-生成棕色的碘,与Na2CO3产生无色的CO2气体,与NaAlO2反应先生成白色沉淀然后溶解,现象均不同。
2.有一无色透明溶液,可能含有下列离子:Al3+、Fe2+、Ba2+、NO、SO、Cl-、HCO,取该溶液做如下实验,则对该溶液的相关判断正确的是( )
实验步骤
实验现象
(1)取少量该溶液,加铜片和浓H2SO4加热
有无色气体产生,气体遇空气可以变成红棕色
(2)取少量该溶液,加BaCl2溶液
有白色沉淀产生
(3)取(2)中上层清液,加AgNO3溶液
有稳定的白色沉淀生成,且不溶于HNO3
(4)取少量该溶液,加NaOH溶液
有白色沉淀生成,当NaOH过量时沉淀溶解
A一定含有NO、SO和Cl-
B.一定含有Al3+,可能含有Ba2+
C.一定含有NO、SO,可能含有HCO
D.一定不含Fe2+、Ba2+和HCO
[答案]D
[解析]由实验步骤(1)知原溶液中一定含有NO;由实验步骤(2)知原溶液中一定含有SO,则一定不含Ba2+;由实验步骤(3)知原溶液中可能含有Cl-
;由实验步骤(4)知原溶液中一定含有Al3+,则一定不含HCO;溶液无色透明,则一定不含Fe2+。故答案选D。
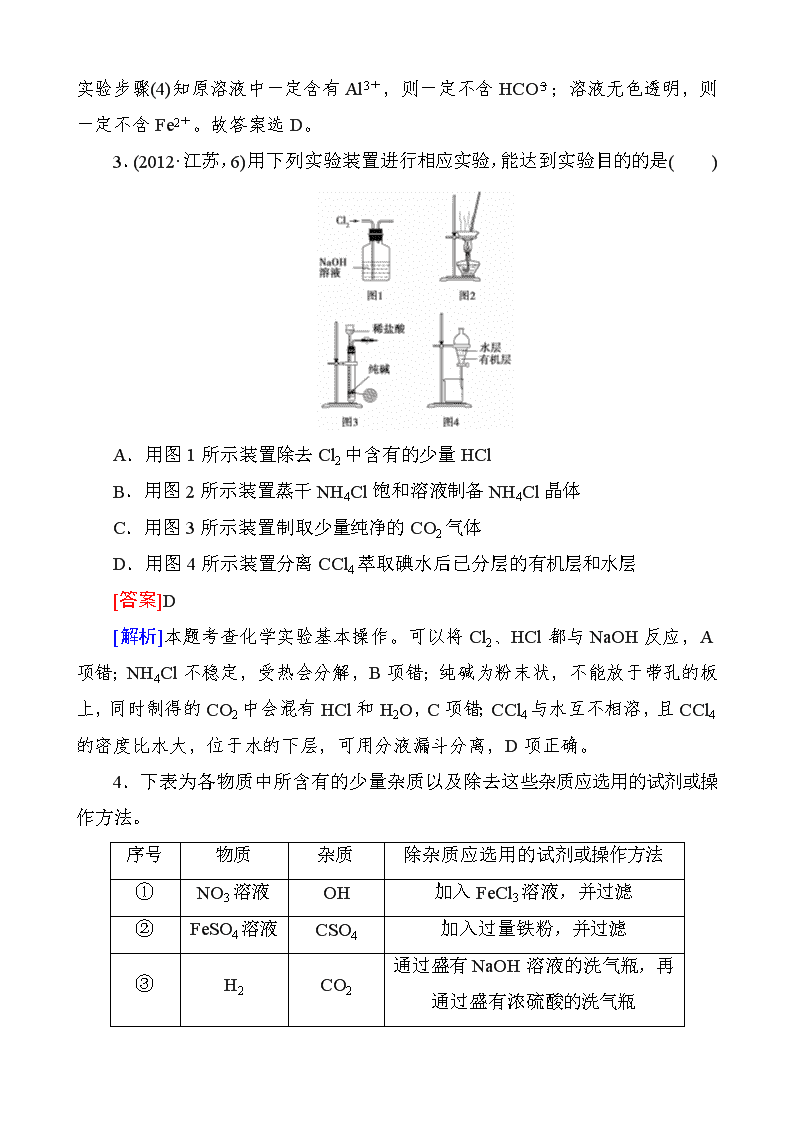
3.(2012·江苏,6)用下列实验装置进行相应实验,能达到实验目的的是( )
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
[答案]D
[解析]本题考查化学实验基本操作。可以将Cl2、HCl都与NaOH反应,A项错;NH4Cl不稳定,受热会分解,B项错;纯碱为粉末状,不能放于带孔的板上,同时制得的CO2中会混有HCl和H2O,C项错;CCl4与水互不相溶,且CCl4的密度比水大,位于水的下层,可用分液漏斗分离,D项正确。
4.下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法。
序号
物质
杂质
除杂质应选用的试剂或操作方法
①
NO3溶液
OH
加入FeCl3溶液,并过滤
②
FeSO4溶液
CSO4
加入过量铁粉,并过滤
③
H2
CO2
通过盛有NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶
④
NaNO3
CaCO3
溶解、过滤、蒸发
正确的一组为( )
A.①②③④ B.③④
C.②③④ D.①②③
[答案]C
[解析]第①组,加入氯化铁会引入杂质Cl-,故不正确;第②组,加入铁粉置换出铜,通过过滤而除去铜及过量的铁粉,故正确;第③组,利用氢氧化钠溶液吸收二氧化碳气体,再用浓硫酸干燥氢气,故正确;第④组,利用碳酸钙不溶于水,溶解后过滤,再蒸发即可,故选C。
.下列除去杂质的方法正确的是( )
A.除去CO2中混有的HCl:用饱和碳酸钠溶液洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去C粉中混有的CO:加适量稀硝酸后,过滤、洗涤
[答案]C
[解析]除去CO2中混有的HCl,应用饱和碳酸氢钠溶液洗气,A错;除去BaCO3固体中混有的BaSO4时,加盐酸会将BaCO3固体反应掉,剩下BaSO4固体,B错;除去FeCl2溶液中混有的FeCl3时,应加入过量铁粉,过滤,C对;除去C粉中混有的CO时,加稀HNO3会将C粉也反应掉,应加适量稀盐酸,过滤、洗涤,D错。
6.某同学为检验溶液中是否含有常见的几种无机离子,进行了如下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
A.原溶液中一定含有SO
B.原溶液中一定含有NH
C.原溶液中一定含有Cl-
D.原溶液中一定含有Fe3+
[答案]B
[解析]原溶液中加入硝酸钡和盐酸生成白色沉淀,原溶液中可能存在SO、SO或Ag+,A项错误;加硝酸银溶液产生白色沉淀,可能是由加入的盐酸引起的,C项错误;因检验过程中产生的气体能使湿润的红色石蕊试纸变蓝,说明原溶液中一定含有NH,B项正确;加入SCN溶液得到红色溶液,Fe3+可能是由原溶液中的Fe2+被H+、NO氧化而来的,故原溶液中不一定含有Fe3+,D项错误。
7.下列除杂质的操作中不正确的是( )
A.铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤
B.FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤
C.Na2CO3固体中混有少量NaHCO3:加入过量NaOH溶液
D.氯气中混有少量氯化氢气体:将混合气体通过盛饱和食盐水的洗气瓶
[答案]C
[解析]Na2CO3固体中混有NaHCO3,应该用加热的方法除去。
8.为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH、Fe2+、SO和H2O,下列实验叙述中不正确的是( )
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴SCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+
C.取少量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO
D.取少量硫酸亚铁铵晶体放入试管中,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中是否含有NH
[答案]D
[解析]应取少量样品于试管中,加入浓NaOH溶液,并适当加热,若产生的气体能使湿润的红色石蕊试纸变蓝,即产生NH3,则证明硫酸亚铁铵中含有NH。
9.下列分离或提纯物质的方法错误的是( )
A.用渗析的方法精制氢氧化铁胶体
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
D.用盐析的方法分离、提纯蛋白质
[答案]C
[解析]硫酸钡与碳酸钡均难溶于水,故不可用溶解、过滤的方法进行提纯。
10.(2012·安徽,10)仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是( )
选项
实验目的
玻璃仪器
A
分离乙醇和乙酸乙酯的混合物
分液漏斗、烧杯
B
用pH=1的盐酸配制100 L pH=2的盐酸
100 L容量瓶、烧杯、玻璃棒、胶头滴管
C
用溴水、淀粉-I溶液比较Br2与
试管、胶头滴管
I2的氧化性强弱
D
用NH4Cl固体和Ca(OH)2固体制备并收集NH3
酒精灯、烧杯、导管、集气瓶
[答案]C
[解析]本题考查了物质的分离、溶液的配制、仪器的选用,同时考查考生对简单实验的设计能力。乙醇和乙酸乙酯都是有机溶剂,可相互溶解,靠分液漏斗和烧杯不能分离,应加入饱和碳酸钠溶液振荡后静置分液,得到乙酸乙酯和乙醇的水溶液,而要从乙醇水溶液中再分离出乙 醇,需进行蒸馏操作,需用到蒸馏烧瓶、冷凝管等玻璃仪器;B项缺乏取酸的仪器量筒(或酸式滴定管);C项利用溴置换出碘,通过碘遇淀粉变蓝色的特性检验出生成的碘,可证明溴的氧化性强于碘;实验室中制氨气是利用NH4Cl和Ca(OH)2在大试管中加热来制取,此项缺乏大试管。
点评:用液体配制一定物质的量浓度的溶液时要用到量筒取液体,用固体配制溶液时用到托盘天平(带砝码)。
二、非选择题(共0分)
11.(12分)可用于分离或提纯物质的方法有:
A.分馏 B.盐析 C.过滤 D.重结晶
E.升华 F.渗析 G.电解 H.加热分解
I.蒸馏 J.灼热氧化
如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
(1)从石油中分离出汽油和煤油等成分________;
(2)除去淀粉溶液中的少量碘化钠________;
(3)从油脂皂化反应后的混合液中分离出高级脂肪酸钠________;
(4)除去粗铜中锌、银等金属________;
()除去水中的Na+、SO、Cl-等杂质________;
(6)除去NO3晶体中混有的少量NaCl________。
[答案](1)A (2)F (3)B (4)G ()I (6)D
[解析]本题考查实验的基本操作和基本实验方法。
12.(20分)(2012·山东,30)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)如右图所示,过滤操作中的一处错误是______________。
(3)判断流程中沉淀是否洗净所用的试剂是_____________。
高温焙烧时,用于盛放固体的仪器名称是___________________。
(4)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是__________。
F中试剂的作用是_______________________________,
用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为________。
[答案](1)B (2)漏斗末端没有紧靠烧杯内壁 (3)氨水 坩埚 (4)除去氯气中HCl 防止水蒸气进入E 碱石灰
[解析]本题考查化学实验,装置图识别,基本操作等知识。(1)Mg2+、Al3+同时生成沉淀,则先加入氨水。(2)过滤时漏斗末端没有紧靠烧杯内壁。(3)检验沉淀是否洗净可向洗涤液中加入氨水,观察是否有沉淀产生。高温焙烧在坩埚中进行。(4)装置B中饱和NaCl溶液用于除去氯气中HCl,F盛装浓硫酸,防止水蒸气进入E。用干燥管盛装碱石灰可以起到F和G的作用。
13.(18分)某钠盐溶液可能含有阴离子NO,CO,SO,SO,Cl-,Br-,I-。为了鉴定这些离子,分别取少量溶液进行以下实验:
①测得混合溶液呈碱性;
②加盐酸后,生成无色无味的气体。该气体能使饱和石灰水变浑浊;
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量的AgNO3溶液,溶液中析出白色沉淀。
(1)分析上述个实验,写出每一实验鉴定离子的结论与理由。
实验①__________________________________________;
实验②________________________________________;
实验③___________________________________________;
实验④__________________________________________;
实验⑤____________________________________________。
(2)上述个实验不能确定是否存在的离子是________。
[答案](1)CO和SO可能存在,因它们水解均可使溶液呈碱性
CO肯定存在,因为产生的气体是CO2;SO不存在,因为没有刺激性气味的气体产生
Br-、I-不存在,因为没有溴和碘的颜色出现
SO存在,因为BaSO4不溶于盐酸
Cl-存在,因与Ag+形成不溶于稀HNO3的白色沉淀
(2)NO
[解析]实验①混合液呈碱性,则可能存在CO和SO,因为两者都水解;
实验②放出无色无味气体,说明只有CO,而无SO;
实验③加入氯水和CCl4振荡后,CCl4层未变色,说明没有Br-和I-;
实验④加入BaCl2溶液生成的沉淀加入足量盐酸,沉淀不能完全溶解,说明还有SO;
实验⑤可证明有Cl-。
解答第(2)题可根据(1)中结果推知惟一没有确定是否存在的离子是NO。