- 3.18 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
实验习题选摘
1.(6分)下列有关实验的叙述,正确的是(填序号)(少一个扣一分,多一个倒扣一分,扣完为止) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H) 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
答案、(6分)(BCDGJK)(少一个扣一分,多一个倒扣一分,扣完为止)
2、(8分)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
(1)石蕊试纸(检验气体): 。
(2)容量瓶: 。
(3)酸式滴定管: 。
(4)集气瓶(收集氯化氢): 。
答案、(8分,每空2分)
(1)把试纸用蒸馏水湿润 (2)检查容量瓶是否漏水
(3)用已给酸液润洗滴定管2~3次 (4)干燥集气瓶
3(5分).下列有关实验的说法正确的是_________。
A.配制100g10%的硫酸铜溶液时,称取10g硫酸铜晶体溶解于90g水中
B.鉴别溴乙烷:先加NaOH溶液,微热,在加稀HNO3酸化后,再加AgNO3溶液
C.制乙烯时,温度计应插入反应混合液中
D.用3mL乙醇、2mLH2SO4、2mL冰醋酸制乙酸乙酯,为增大反应速率,现改用6mL乙醇、4mLH2SO4、4mL冰醋酸
E.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热至沸腾,产生黑色沉淀,原因可能是NaOH量太少
答案. BCE(共5分,错选得0分,漏选得2分).
4、(4分)下列有关化学实验的操作或说法中,正确的是(填写字母代号)
A、实验室制取肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂
B、进行中和热测定实验时,需要测出反应前盐酸与NaOH溶液的各自温度及反应后溶液的最高温度
C、检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置到充分沉淀后,取上层清液于试管中,滴加KSCN溶液2~3滴即可
D、制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸发滤液即可得到硫酸亚铁晶体
E、进行纤维素水解实验时,把一小团脱脂棉放入试管中,滴入少量90%的浓硫酸搅拌,使脱脂棉变成糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的
Cu (OH)2加热至沸腾即可
答案。BC
5.(6分)下列操作或说法合理的是
A.用10毫升的量筒量取4.80毫升的浓硫酸
B.金属钠着火,用泡沫灭火器扑灭
C.用胶头滴管向试管滴液体时,滴管尖端与试管内壁一般不应接触
D.用盐酸可以清洗长期存放过石灰水的试剂瓶
E. 配制FeCl3溶液时,向溶液中加入少量Fe和稀硫酸
F.用已知浓度的酸滴定未知浓度的碱时,碱式滴定管用蒸馏水洗后,未用待测液润洗会导致测量的浓度偏低
答案。C、D、F(每个2分,选错一个扣两分,不负分)
6.(8分)化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
(1)下列关于实验的叙述正确的有 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
C.测量溶液的pH时,应先将pH试纸润湿
D.用溴水除去乙烯中混有的二氧化硫气体
E.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
F.附着于试管内壁上的硫,可用热碱液洗涤
G.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
H.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
(2)下列实验没有错误的是 。
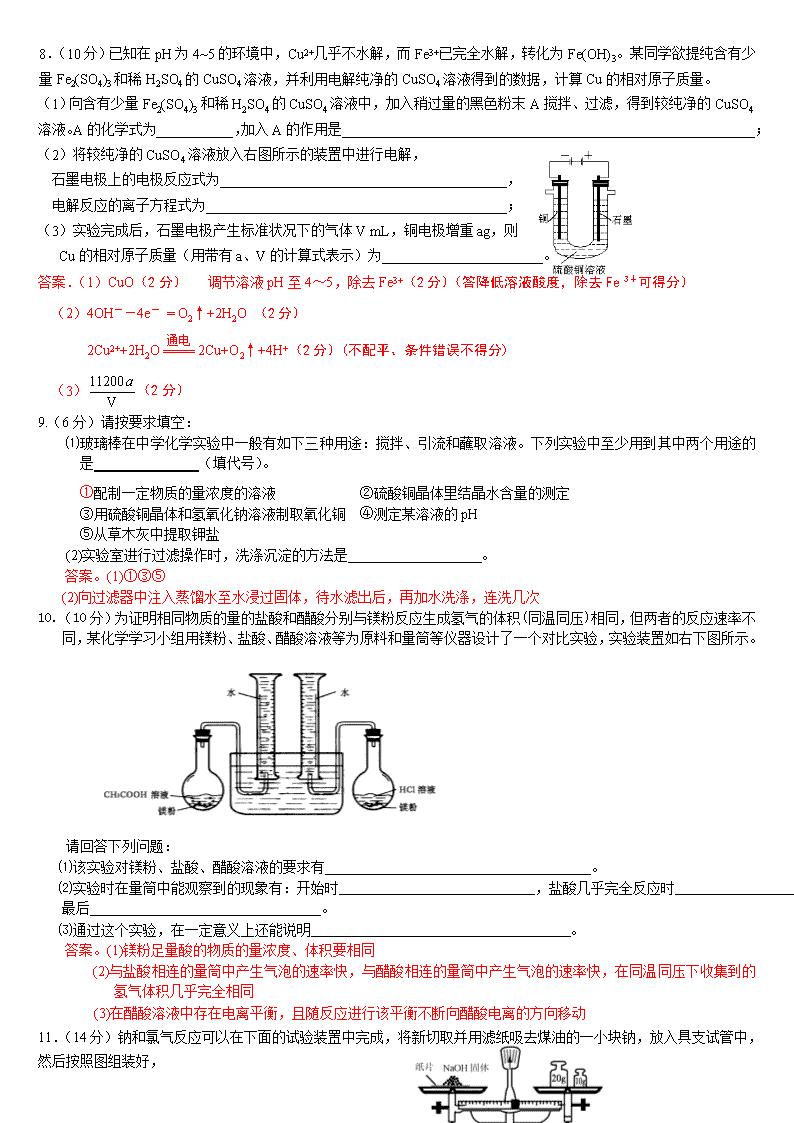
(3)下图为常见仪器的部分结构(有的仪器被放大)
A图中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为NmL,仰视时读数为MmL,若M>N,则所使用的仪器是 (填字母标号)。
答案.(8分) (1)A E F H (4分,选对1个得1分)
(2)D (2分) (3)28.0 (1分) C (1分)
7.(6分)很多实验中都要用到温度计和玻璃棒,请按要求填空:
⑴下列实验均需使用温度计,请将下列实验中的温度计按测定温度的对象不同进行分类,填入表格中:
①制取乙烯 ②制取硝基苯 ③测定中和热 ④石油分馏
用途
测定反应液温度
测定气体温度
测定环境温度
实验代号
⑵玻璃棒在实验中一般有如下三种用途:搅拌、引流和蘸取溶液,下列实验中至少用到其中两个用途的是______________________(填代号)。
①配制一定物质的量浓度的溶液 ②硫酸铜晶体结晶水含量的测定 ③用硫酸铜氢氧化钠制取氧化铜 ④从制取氧气的剩余固体中提取KCl ⑤测定溶液的pH⑥浓盐酸与浓氨水相遇发烟
答案.⑴①③、④、② ⑵①③④
8.(10分)已知在pH为4~5的环境中,Cu2+几乎不水解,而Fe3+已完全水解,转化为Fe(OH)3。某同学欲提纯含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液,并利用电解纯净的CuSO4溶液得到的数据,计算Cu的相对原子质量。
(1)向含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的CuSO4溶液。A的化学式为___________,加入A的作用是___________________________________________________________;
(2)将较纯净的CuSO4溶液放入右图所示的装置中进行电解,
石墨电极上的电极反应式为_________________________________________,
电解反应的离子方程式为___________________________________________;
(3)实验完成后,石墨电极产生标准状况下的气体V mL,铜电极增重ag,则
Cu的相对原子质量(用带有a、V的计算式表示)为_______________________。
答案.(1)CuO(2分) 调节溶液pH至4~5,除去Fe3+(2分)(答降低溶液酸度,除去Fe 3+可得分)
(2)4OH--4e- = O2↑+2H2O (2分)
2Cu2++2H2O2Cu+O2↑+4H+(2分)(不配平、条件错误不得分)
(3)(2分)
9.(6分)请按要求填空:
⑴玻璃棒在中学化学实验中一般有如下三种用途:搅拌、引流和蘸取溶液。下列实验中至少用到其中两个用途的是_______________(填代号)。
①配制一定物质的量浓度的溶液 ②硫酸铜晶体里结晶水含量的测定
③用硫酸铜晶体和氢氧化钠溶液制取氧化铜 ④测定某溶液的pH
⑤从草木灰中提取钾盐
(2)实验室进行过滤操作时,洗涤沉淀的方法是 。
答案。(1)①③⑤
(2)向过滤器中注入蒸馏水至水浸过固体,待水滤出后,再加水洗涤,连洗几次
10.(10分)为证明相同物质的量的盐酸和醋酸分别与镁粉反应生成氢气的体积(同温同压)相同,但两者的反应速率不同,某化学学习小组用镁粉、盐酸、醋酸溶液等为原料和量筒等仪器设计了一个对比实验,实验装置如右下图所示。
请回答下列问题:
⑴该实验对镁粉、盐酸、醋酸溶液的要求有 。
⑵实验时在量筒中能观察到的现象有:开始时 ,盐酸几乎完全反应时 ,最后 。
⑶通过这个实验,在一定意义上还能说明 。
答案。(1)镁粉足量酸的物质的量浓度、体积要相同
(2)与盐酸相连的量筒中产生气泡的速率快,与醋酸相连的量筒中产生气泡的速率快,在同温同压下收集到的氢气体积几乎完全相同
(3)在醋酸溶液中存在电离平衡,且随反应进行该平衡不断向醋酸电离的方向移动
11.(14分)钠和氯气反应可以在下面的试验装置中完成,将新切取并用滤纸吸去煤油的一小块钠,放入具支试管中,然后按照图组装好,
加热金属钠,到钠熔化成光亮的球状时,立即
通入氯气,并停止加热,此时可看到钠剧烈燃
烧并生成大量白烟,片刻,试管内壁各处都附着
一层白色固体。请完成下面问题:
⑴停止加热,反应仍能继续进行,说明该反应是 反应。(填放热或吸热)
⑵有时熔融的钠跟氯气接触时会产生黑烟,这是因为 。
⑶具支试管的支管应通到10%的NaOH溶液中,防止 。
⑷钠刚熔化时就要通入氯气,如果熔化前通氯气或熔化后还不通氯气都会影响实验效果,为什么 。
⑸通入氯气的量不要太多以免 但也不能太少,以免 。
(6)有同学想证明白色固体就是NaCl,应补充什么实验来说明
。
答案、(14分)(1)放热 (2分)
(2)钠的表面煤油没有除尽,煤油中的碳氢化合物跟氯气反应,游离出了碳 (2分)
(3)过多的氯气逸散到空气中造成环境污染 (2分)
(4)熔化前通,钠的表面会生成一层氯化钠,熔化后还不通,钠表面会蒙上一层氧化物薄膜。(2分)
(5)逸出污染空气 ,NaOH溶液倒吸(每空2分,共4分)
(6)向试管中加少量蒸馏水,溶解后,分成两份,一份进行焰色反应,看到火焰呈黄色证明有Na+存在,另一份加几滴AgNO3溶液,出现大量白色沉淀,再加稀硝酸,沉淀不溶解证明Cl—,说明白色固体是NaCl (2分,每检出一个离子1分)
12.(10分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步聚1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步聚2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步聚3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、___________等玻璃仪器。
(2)步聚2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:______________________________________;
(3)步聚2中,判断加入BaCl2已过量的方法是:
________________________________________________;
(4)步聚2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是:
________________________________________________;
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是___________________、_____________________。
答案.(10分)(1)玻璃棒 漏斗 (2分)
(2)NaOH→BaCl2→Na2CO3 (2分)
(3)取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量 (2分)
(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度 (2分)
(5)未用玻璃棒引流;未采用150 mL容量瓶。 (2分)
13.(12分)Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足:
_____________________________________________________________________
Ⅱ.课外活动小组甲,自行设计了下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去。请回答下列问题:
(1)实验前,首先检查装置的气密性,然后分别向试管A中加入乙醇,C中加入水;
(2)实验时,先加热B装置中的玻璃管,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为______________________________________________________;
②通入空气的速度过快或过慢都不利于反应的进行,控制气体流速的实验操作现象是:________________________________________________________;
Ⅲ.课外活动小组乙,在研究了课外活动小组甲的方案后,认为该方案中有不足和不安全的地方。
(3)课外活动小组乙对甲的方案提出改进意见:
①将A装置浸在70~80℃的水浴中,目的是____________________________;
②装置B、C之间接上D装置,请你在上面方框中,画出D的装置图。
(4)如果在装置B、C之间不增加D装置,提出你对实验改进的意见:____________。
答案.(12分)Ⅰ.操作麻烦、乙醇转化率低 (1分)
Ⅱ.(2)①放热 (1分)
2CH3CH2OH+O22CH3CHO+2H2O (2分)
②观察甲中单位时间内的气泡数 (2分)
Ⅲ.(3)①使生成乙醇蒸汽的速率加快 (2分)
②见下图(左) (2分)
(4)将试管丁浸在冰水中,产物不用水吸收而是直接冷却 (2分)
14.(10分)在装修居室时,如使用不合格的建筑、装潢材料,易造成“室内空气污染”,影响人们身体健康,造成室内空气污染的有毒物质主要有甲醛、苯、氨、氡等。学好化学有助于我们设法减少居室内的空气污染,消除空气中的有害物质对人体可能产生的影响。回答下列问题:
(1)我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg/m3。小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
①请你帮助小陈同学选择装置中试剂瓶内的药品:_____(填序号);
a.银氨溶液 b.酸性高锰酸钾溶液 c.新制得氢氧化铜悬浊液
根据你的选择,为使实验现象明显,你认为对所选择试剂的浓度有什么要求__________________________________________________________________;
②在检查好装置气密性和选择好试剂瓶内的药品后,请你帮助小陈同学完成该实验的操作:________________________________________________________;
③若试剂瓶内溶液的体积和浓度已知,实验时还需测定的数据有:
_______________________________、________________________________;
(2)请你提出减少室内空气污染的措施:____________________________________;
答案.(10分)(1)①b (2分)
空气中甲醛含量很小,所选试剂的浓度宜小不宜大 (2分)
②慢慢用注射器抽气,反复若干次直至试剂瓶内溶液颜色刚好褪去 (2分)
③注射器的容积、抽气的次数 (2分)
(2)经常打开门窗,保持室内空气流通 (2分)
15. (11 分)为了从含有 FeCl3、FeC12、CuC12 的废液中回收Cu,某研究性学习小组的同
们设计了两种方案:
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。 在所得滤渣中加入足量的盐酸,
充分反后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化牲由强到弱的顺序
为:_____________________过滤操作时,需要用到的玻璃仪器是:______________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的
先后顺序全部写出)_______________________________________________________
另一电极所发生的电极反应为_____________________________
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,
主要表现为: ____________________________________________________
答案、方案1:Fe3+>Cu2+>H+>Fe2+ 漏斗、烧杯、玻璃棒
方案2: 阴 2Fe3++2e-=2Fe2+; Cu2++2e-=Cu ;
2H++2e-=H2↑; 2Cl--2e-=Cl2↑
①有污染性气体Cl2 产生 ② 使用了电解装置,成本较高;等。
16. (11 分)某校化学兴趣小组为测定混合物各组分的质量比,实验过程中所加试剂和
操作涉骤如下表所示(各步操作中,反应均完全)。
试回答下列问题:
(1)实验Ⅰ中D 的成分是___________称量后_________(填“能”或“不能”)通过计算得到
A中各组分的质量比.
(2)实验II 填写的内容中明显错误的是________, 其原因________________________
(3)对实验Ⅲ进行设计,并将相应内容填入Ⅲ中对应的空格内,最终能得出A中各组分的质量比为:(用含字母的表达式表示)____________________________
答案. ⑴BaCl2、NaCl
⑵D D中不仅含有NaCl,还有Na2CO3
⑶过量NaOH溶液(等合理答案) Mg(OH)2 Na2SO4 和 NaOH A 、C
(A-(120C/58)):(120C/58)
17、(1)下列实验操作或对实验事实的叙述中存在错误的是__ ____(填序号)
A、用50 mL酸式滴定管准确量取25.00 mL 酸性KMnO4溶液,放入锥形瓶中待用
B、在测定硫酸铜晶体的结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C、中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D、实验室中进行的下列实验需水浴加热:①乙酸乙酯的制备②葡萄糖的银镜反应
E、配制1 mol•L-1的NaOH溶液时,下列操作会造成所配浓度偏低:①溶解后烧杯未多次洗涤 ②定容时仰视刻度线 ③容量瓶中原有少许蒸馏水
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
G、容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水
H、不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4
I、可以用分液漏斗分离下列三组液态混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇
J、实验室保存少量液溴和白磷常用水封
(2)某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体。
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有 。
②制得Al2(SO4)3与K2SO4物质的量之比小于 。
(3)“磨砂”是增加玻璃仪器密封性的一种处理工艺 ,可使仪器不漏液或不漏气。在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂” 处理的有 (填序号)。
(4)碱式氯化铜 (不溶于水的绿色结晶)是一种农药,化学式为:CuCl2·3Cu(OH)2·xH2 O。为验证其组成并确定X值,某学生设计了以下几步实验
①取a g碱式氯化铜的晶体制成粉末。
②将晶体加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。
③另取a g碱式氯化铜的晶体,溶于足量硝酸中,得到溶液。
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体,称量为c g。
若以上操作均正确,试回答下列问题:
A.将晶体制成粉末,所用的主要化学仪器是 (填仪器名称)。以上四步中,用到玻璃棒的步骤有 (填序号)
B.步骤②灼烧后得到的固体应为: 。
C.步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量
答案、(1) BCDEGHI
(2)①硫酸溶液、氢氧化钾溶液
②1︰4
(3)①⑧(2分)
(4)A.研钵(1分)②③④(3分)
B.CuO (2分)
C.过滤(1分) 洗涤(1分)
18.(6分)⑴可以验证镁、铝的金属性强弱的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
⑵现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
答案.⑴bc (3分)
⑵分别取适量MgCl2溶液、AlCl3溶液于两支试管中,分别向两支试管中加入适量NaOH溶液或氨水,将所得沉淀分别等分为两份,分别向一份Mg(OH)2、Al(OH)3中加入适量NaOH溶液,Mg(OH)2不溶解,Al(OH)3溶解;再分别向另一份Mg(OH)2、Al(OH)3中加入适量盐酸,全部溶解,说明Mg的金属性比Al强。(3分)
19.(16分)电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
⑴甲中反应的离子方程式为 ,
乙中反应的离子方程式为 。
⑵乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是 ,丁在实验中的作用是 ,装有碱石灰的干燥管的作用是 。
⑶戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能的原因 。请提出一个能提高准确度的建议(要有可操作性,且操作简单) 。
答案.⑴CN-+ClO-CNO-+Cl- 2CNO-+2H+ +3ClO-N2↑+2CO2↑+3Cl-+H2O
⑵除去HCl气体 去除Cl2 防止空气中CO2进入戊中影响测定准确度
⑶ 82% ①装置乙、丙、丁中可能滞留有CO2;②CO2产生的速度较快未与戊中的澄清石灰水充分反应 ;③Cl2、HCl在丙、丁中未吸收完全。(三点中任意答两点即可,每答对一点给1分,共2分)
建议一:不将甲中溶液一次全部加入乙中,改为分次加入,控制CO2的产生速度;
建议二:乙中瓶塞改为三孔塞,增加的那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多的与Ca(OH)2反应。
建议三:将戊中澄清石灰水改为浓度较大的NaOH溶液,反应结束后向戊中加入足量CaCl2后测沉淀质量。等等(三点中任意答一点即可) (每空2分,共16分)
20.(1)以下实验不能获得成功的是
A.将无水乙醇和浓H2SO4共热到140℃制乙烯
B.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
C.将Cu和浓HNO3反应,用排水法收集NO2 气体
D.用已知浓度的碱来滴定未知浓度的酸时,滴定前用待测液洗锥形瓶
E.要证明淀粉已水解,向淀粉溶液中加入稀硫酸,水浴加热一段时间后加入银氨溶液,使其
发生银镜反应
(2)(8分)①某同学用下图所示装置制备SO2 并验证其性质,试管内有一小片铜片和浓硫酸,试管内发生反应的化学方程式为 ;导管中品红试纸的作用是 ;导管口蘸有碳酸钠溶液的棉花的作用是 ;相关的化学方程式是
②实验室中现有下列实验用品:氢硫酸、NaOH溶液、KMnO4溶液、脱脂棉、镊子、pH试纸、玻璃棒
请设计实验验证SO2的还原性,简述实验操作步骤和现象
。
答案.(共11分)
(1)(4分,选对2个得1分,选对3个得2分,错选不得分)ACDE;
(2)(8分)①Cu + 2H2SO4(浓)CuSO4+SO2↑+ 2H2O;(2分)
验证SO2的漂白性(1分); 吸收多余的SO2防止污染大气(1分);
SO2+Na2CO3 = Na2SO3 + CO2 (2分);
②用镊子夹取脱脂棉蘸取KMnO4溶液,然后将棉团代替碳酸钠溶液的棉团(1分),过一段时间观察棉团紫色消失或变浅,则证明SO2具有还原性(1分)。
21.(10分) 乙二酸(HOOC-COOH)俗称草酸,在生产和科学实验中有广泛的用途。
(1)测定某未知浓度的KMnO4溶液,可用草酸作还原剂,估计需用0.50mol/L的草酸溶液90mL。则用草酸晶体(H2C2O4·2H2O)配制溶液时,所用的定量玻璃仪器是
(注明仪器规格);如果在定容时视线偏高,则所测得KMnO4溶液的浓度将
(填“偏大”、“偏小”或“不变”)。滴定时的反应原理可简单表示为:
H2C2O4+ MnO4- → CO2↑+ Mn2+
则滴定终点时的颜色变化为: 。
(2)乙二酸其主要物理常数如下:
名称
分子式
颜色、状态
溶解性(g)
熔点(℃)
分解温度
乙二酸
H2C2O4
无色固体
8.6(20℃)
182.0
175℃
二水合乙二酸
H2C2O4·2H2O
无色晶体
——
101.1
――
右图是教材上的一个实验装置图,观察装置判断
进行该实验的目的是 ,
根据上述材料提供的信息,请指出该实验装置的
不合理之处,说明理由。
。
答案.(1)100mL容量瓶 (2分) 偏小 (2分)
由红色变无色 (2分)
(2)验证乙二酸分解是否有二氧化碳生成 (2分)
试管口应向上 因为乙二酸晶体在分解前就已熔化成液态 (2分)
22.(12分) 利用如图所示的装置和其他必要的仪器用品,完成下列实验。
(1)证明氨气具有还原性。已知2NH3+3CuO===N2+3Cu+3H2O。
① 碱石灰的作用是 稀硫酸的作用是 。
② 浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③ 证明NH3 具有还原性的实验现象是
。
(2)用吸收了足量氨气的硫酸溶液可以制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O===(NH4)2Fe(SO4)2•6H2O。
在烧杯中的溶液中加入稀H2SO4调节溶液至酸性;加入适量的硫酸亚铁浓溶液后,搅拌。为分离出硫酸亚铁铵晶体,还需要进行的实验操作是:
。
答案.(1)① 吸收水蒸气(2分) 吸收氨气,防止污染(2分)
② NaOH吸收溶液中水分放热,使溶液温度升高,氢氧根离子浓度增大,都有利于氨气的逸出(共3分)
③ 黑色粉末变为红色,有无色液滴产生(2分)
(2)加热浓缩(1分);冷却结晶(1分);过滤(1分)
23.(13分) 在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物
是
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号
及实验中观察到的现象。
同学正确
选用试剂
实验现象
第一种方法
第二种方法
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子
是 若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,
你认为是否可行? (填可行或不可行)
理由是:
答案.(13分)
(1)Br2 (2分);Fe3+ (2分)
(2)
乙 (1分) 同学正确
选用试剂
实验现象
第一种方法
C(1分)
有机层无色(1分)
第二种方法
D(1分)
溶液变红(1分)
(3)Fe2+(2分);不可以(1分),因为Br2和Fe3+都能把I—氧化成I2(1分)
24.(13分)某同学用如图1所示的装置来探究SO2的性质及有关实验。
(1)实验前应先检验装置的气密性,方法是
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出该反应的化学方程式
。
(3)分别将SO2气体通入气体下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是 ,继续通入过量的SO2气体,现象是 。
②SO2通入紫红色KMnO4溶液,现象是 ,写出反应的离子方程式 。
③SO2慢慢通入(可以气割气泡通入)澄清石灰水中,现象 。
④SO2通入少量的澄清石灰水中,没有明显现象,产生此现象的原因是
。
(4)若同学制取的SO2气体中混有CO2气体,请你设计
实验证明混合气体中既有SO2气体,又有CO2气体。
可以选择图2洗气装置设计实验。洗气装置里的溶液是:
A浓硫酸、B氢氧化钠溶液、C硫酸铜溶液、D品红溶液、
E澄清石灰水、F高锰酸钾溶液、G碳酸氢钠溶液。
上述装置的连接顺序是(用字母表示,所给装置可以重复使用,有些装置也可以不用)
。
答案.(13分)
(1)用双手(或热毛巾)握住B,C 中有气泡产生,移开双手,C中导管形成一段水柱,说明不漏气。(2分)
(2)Na2SO3+H2SO4====Na2SO4+SO2↑+H2O(2分)
(3)①紫色溶液变为红色 红色不褪去(或溶液颜色无变化)(2分)
②紫红色褪去 (3分)
③首先有白色沉淀生成,然后白色沉淀消失(1分)
④SO2与氢氧化钙反应,生成亚硫酸钙沉淀,过量的SO2又与亚硫酸钙反应,生成能溶于水的亚硫酸氢钙。(1分)
(4)D、F、D、E或D、F、F、E(其它顺序合理也给分)(2分)
25.(10分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分
Ba(OH)2
Ca(OH)2
80
20
3.89
101
S/g
t/℃
离并提纯碳酸钡的实验步骤如下,请根据要求填空(右图为
Ba(OH)2和Ca(OH)2的溶解度曲线):
⑴ 高温灼烧碳酸钡和碳酸钙的混合物,直至分解完全。所需仪
器除坩埚、泥三角、玻璃棒、三脚架外还有 ;
⑵ 将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的
热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作
是 ;
⑶ 将“⑵”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
⑷ 向制得的Ba(OH)2溶液中滴加 (填一种试剂名称),再通入二氧化 碳。当观察到 时,即可停止通二氧化碳。
⑸ 滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。
答案.⑴ 坩埚钳、酒精喷灯 ⑵ 趁热过滤 ⑶ 冷却结晶 ⑷酚酞 红色刚好消失
(本题共10分,每空2分)
26.(12分)某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出如下的问题,进行探究。请你协助该小组的同学完成下列研究。
【提出问题】
① Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
② 通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③ CuO能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
⑴ 解决问题①需用到的药品有CuSO4溶液、 (填试剂),同时进行进行相关实验。
⑵ 解决问题②的实验步骤和现象如下:取98gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,A的化学式为 。
⑶ 为解决问题③,设计的实验装置为(夹持及尾气处理装置装置未画出):
NH3
CuO
碱石灰
无水CuSO4
实验中观察到CuO变为红色物质,无水CuSO4变蓝色。同时生成一种无污染的气体。
【实验结论】
⑴ Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是 。
⑵ 根据“实验方案⑵”,得出的+1价Cu和+2价Cu稳定性大小的结论是 ; 。
⑶ CuO能被NH3还原。该反应的化学方程式为 。
【问题讨论】
⑴ 有同学认为NH3与CuO反应中生成的红色物质是Cu,也有同学认为NH3与CuO反应中生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A ;
答案.【实验方案】⑴ HCl溶液、NaOH溶液 ⑵ Cu2O
【实验结论】
⑴ Cu(OH)2既能溶于盐酸,又能溶于NaOH溶液
⑵ 在高于1000℃时,+1价Cu比+2价Cu稳定;在溶液中+2价Cu比+1价Cu稳定
(各1分)
⑶ 3CuO+2NH33Cu+N2+3H2O
【问题讨论】
⑴ 取NH3与CuO反应中生成的红色物质少许,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有A,反之则无 (本题共12分,除标注为1分的外,其余每空2分)
27.(6分)⑴下列实验操作中,错误的是
①用10mL量筒量取6.4mL盐酸;
②切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割;
③配制FeSO4溶液,应先将盐溶解在稀硫酸中,再加水稀释到所需浓度,并加入少量铁屑;
④加热烧杯(瓶)时要垫石棉网,所以在加热前,烧杯(瓶)外壁不必擦干;
⑤不慎接触过多的氨,应及时吸人新鲜的空气和水蒸气,并用大量水冲洗眼睛;
⑥用带橡皮塞的棕色试剂瓶存放浓HNO3。
⑵右图为实验室制H2的装置。若液面刚好不与锌粒接触而又无
酸液可加入,则可以从长颈漏斗中加入适量试剂是
①食盐水 ②苯
③四氯化碳 ④Na2CO3溶液
⑤硫酸铜溶液 ⑥KNO3溶液
答案.(共6分)
⑴②④⑥(3分);⑵①③⑤ (3分) (答对一个给1分,答错1个倒扣1分,本题不得负分。)
28.(16分) 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3 、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3 + CO2 + H2O = NH4HCO3 ; NH4HCO3 + NaCl = NaHCO3↓+ NH4Cl ; 2NaHCO3
Na2CO3 + CO2↑+ H2O
⑴碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填标号)。
A.碳酸氢钠难溶于水 B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
⑵某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 。
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
。
⑶请你再写出一种实验室制取少量碳酸氢钠的方法:
。
答案.(共16分)
⑴ C(2分)
⑵ ①(Ⅰ)饱和碳酸氢钠溶液;(Ⅱ)吸收末反应的NH3(答“防止倒吸”或“吸收CO2”不给分));(Ⅲ)过滤。(每空2分,共6分)
②(Ⅰ)a、 NH3,b、 CO2; (每空1分,共4分)
(Ⅱ)增大气体与溶液接触面积,提高CO2吸收率;(2分)
⑶用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等。其他合理方法均可)(2分)
29.(10分) (10分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。
(1)本实验中生成CO2和SO2的有关反应的化学方程式为:____________________________________;
_______________________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通过SO2不能出现浑浊的原因可能是_________________________________________________________________________。
(3)用图二装置进行实验,以相同速率通入CO2和SO2时,SO2产生浑浊、澄清的现象比CO2快的原因可能是___________________________________________________
______________________________________________________________________。
(4)用图一进行SO2与石灰水反应的实验时,从安全或环境角度考虑,该装置可如何改进?
________________________________________________________________________。
答案。(共10分)
30.(12分).碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代 号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
⑴在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
时间
起始
14min后
30min后
75min后
pH
<2.0
=2.5
<3.5
=3.5
试解释排气管中放出气体的pH变化的原因。如果把排气管加长一倍,排气的pH有无变化?为什么? ,
⑵观察反应器内溶液的颜色(取上面清液观察),在沸腾1h内,溶液逐渐呈黄绿色,以后逐渐转变为淡棕黄色,1.5h后呈棕红色。解释导致颜色变化的原因。
⑶上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这是什么物质?为什么此时会有沉淀析出?
⑷铁的化合物和铝的化合物一样也可作净水药剂,此外,溶液中元素Fe还能与CN-形成特定的络合物。某溶液中同时存在Fe(CN)63-和Fe(CN)64-两种离子,H2O2可使它们相互转化,请用离子方程式表示这种转化。
酸性条件:
碱性条件:
答案。(共12分)
⑴由于盐酸受热蒸发出HCl气体所致,随着反应 的进行,盐酸逐渐与煤矸石中的物质反应而被消耗,因此,排气的pH从小逐渐变大,如果排气管加长一倍,意味着排气被冷却的程度更高,HCl更多被冷凝回流,故排气的pH有所增大。(3分)
⑵煤矸石中的铁的氧化物有Fe2O3和FeO,与酸反应首先生成较多的是二价铁盐,故呈黄绿色;由于Fe2O3逐渐溶出,加之Fe2+被氧化为Fe3+,致使溶液中Fe2+浓度逐渐降低,Fe3+浓度升高,并有部分Fe3+水解,颜色呈所述变化。(3分)
⑶沉淀物是水合硫酸钙(或硫酸钙),由于硫酸钙是微溶的,在稀BAC溶液中达到饱和,浓缩蒸发过程中变为过饱和,故形成细晶状析出。(3分)
⑷2Fe(CN)64-+H2O2+2H+→2Fe(CN)63-+2H2O
2Fe(CN)63-+H2O2+2OH-→2Fe(CN)64-+2H2O+O2↑
31.(10分)回收的废旧锌锰于电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
根据上图所示步骤并参考表格数据,回答下列问题。
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式为________________________________。
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是__________________________。
(3)过滤I所得滤液经氧化后,需加入NaOH溶
液调节pH约为5.1,其目的是______________________________________。
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离于方程式为__________________________________________。
(5)实验室进行过滤操作时.需要用到的玻璃仪器有___________________________。
答案。
32.(12分)某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质(所给装置必须用到并且只能用一次,各装置中的试剂均足量。已知常温下CaCl2能吸收氨气)。
(1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(2)写出氨气催化氧化的化学方程式______________________。
(3)进行实验时,装置A中碱石灰的作用是_____________;D中的现象是____________________。
(4)能证明有硝酸生成的现象是__________________________________________。
(5)实验开始时,下列操作顺序最合理的是______________。
a.先加热A装置中的催化剂.再由导管a通入空气
b.先由导管a通人空气,再加热A装置中的催化剂
c.在由导管a通人空气的同时,加热A装置中的催化剂
答案。
33.李同学在探究铁生锈的条件时,将铁钉浸没在试管里的食盐水中,一段时间后,发现试管底部出现了黑色粉末。李同学对此黑色粉末的组成做了如下几种猜测:①Fe ②Fe2O3 ③Fe3O4 ④FeCl3 ⑤数种物质的混合物。请回答下列问题:
(1)铁钉生锈属于 腐蚀,其正极发生的电极反应为
(2)你认为李同学的上述猜想中,不做实验就可排除的是 (填序号),理由是 ;
你认为黑色粉末还可能是 ,理由是 。
(3)李同学将黑色粉末干燥后,用磁铁靠近,发现粉末能被磁铁吸引,于是得出结论:黑色粉末一定是铁粉。你认为李同学的结论对吗? ,理由是 。如果你认为李同学正确,则不需填写以下内容,如果你认为不对,则请提出可行方案帮助李同学确定黑色粉末的成份。
答案.(1)吸氧腐蚀 O2+4e-+2H20=4OH- ;(2)②、④;Fe2O3为红棕色物质;FeCl3可溶于水;炭粉;铁钉是用生铁作材料制成;(3)不对;四氧化三铁也能被磁铁吸引;取黑色固体少量于一试管中,加入盐酸,如果产生气泡,则说明固体中含有铁,反之则没有;取反应后的溶液少许于另一试管中,加入少量KSCN溶液,如呈血红色,可说明有Fe3O4,反之则不含Fe3O4。
34.(13分)硫代硫酸钠(Na2S2O3 ·5H2O)俗名大苏打、海波,常用于除卤剂和定影剂。Na2S2O3在酸性条件下极不稳定:S2O+2H+=H2O+SO2↑+S↓。以Na2S、Na2SO3和浓盐酸为原料。在60℃—80℃用新制的S与Na2SO3 反应可制取Na2 S2O3;实验装置如下图。(已知H2SO3酸性比H2S强)
回答下列问题:
(1)写出试剂的名称:X ;装置B,D的作用是:
B ,D 。
(2)实验开始时,为使反应有效地进行,下列实验操作的顺序是: (填编号)
①打开A中分液漏斗的活塞,向烧瓶中加入液体;②点燃装置A的酒精灯加热;
③点燃装置C的酒精灯加热,。
(3)反应开始后,装置C锥形瓶中的溶液先变浑浊,出现浑浊现象的原因是: 、
(用化学方程式表示);当溶液变澄清时,停止反应;然后将所得混合液趁热过滤,经加热蒸发、冷却得到硫代硫酸钠晶体。
(4)实验时,也可先在装置C的锥形瓶中加入一定量的X和Y的混合物,然后按第(2)第(3)步制取Na2S2O3。要使原子利用率达到100%,则X+Y的物质的量之比是:
。
答案(共13分)
(1)X:亚硫酸钠 (共2分。写化学式不给分);B:除去SO2气
体中的HCl杂质 ( 2分),D:防止E中液体倒流(或防止倒吸、或安全瓶均可)。(1分)
(2)③①② (2分)
(3)Na2S+ SO2+ H2O=Na2SO3+H2S(2分)、
2H2S+SO2=2H2O+3S↓(或2H2S+H2SO3=3H2O+3S↓。2分)
(4)1:2(2分)
35.乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸。
某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯
的含量。
乙酸乙酯
乙醇
乙酸
沸点
77.1℃
78.5℃
117.9℃
操作步骤如下:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol·L—1NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为40.0mL
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL 2.1mol·L—1NaOH溶液混合均匀后,装上冷凝箱,在水浴上加热回流约1小时,装置如图2所示。待冷却后,用0.50mol·L—1HCl滴定过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答下列问题:
(1)实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
(2)利用实验(I)、(II)测量的数据计算粗产物中乙酸
乙酯的质量分数为 。
(3)实验结束后,同学们对粗产品中乙酸乙酯的含量不高进行讨论。
①有人认为是实验(II)带来的误差。建议将图2中的锥形瓶改为
三颈瓶,装置如图3,在三颈瓶的c、d口装配相关的仪器并进行
恰当的操作,可以提高测定的精确度。你认为在三颈瓶的c、d口
装配相关的仪器或操作是: (填字母);
A.装上温度计,严格控制反应温度
B.实验中经常打开瓶口,用玻璃进行搅拌
C.在反应后期,用事先安装的分液漏斗添加一定量的NaOH溶液
②还有同学认为改进乙酸乙酯的制取装置(图1)才能提高产率。拟出你的一条改进建议 。
答案(共9分)
(1)b(2分)
(2)79.2%(3分)
(3)①AC(正确一个给1分,错选一个扣1分,不出现负分。共2分)
②用圆底烧瓶替代试管并加装温度计控制反应温度或加装水冷凝管,提高冷却效
(其它合理答案也给分。共2分)
36.(8分)检查装置气密性是化学实验中的重要操作之一。试按要求回答下列问题:
(1)下列仪器或装置在使用前一定要检查气密性的是____(填序号,下同)。
A、容量瓶 B、洗气瓶 C、分液漏斗 D、酸(碱)式滴定管
(2)下列关于不进行气密性检查可能导致后果的叙述中,正确的是____。
A、收集不到气体 B、造成环境污染
C、观察到的实验现象有误 D、引发爆炸事故 ·
(3)为检查右图所示简易气体发生装置的气密性,甲、乙两位同学进行了以
下操作和方案设计。
①甲同学认为,只要往漏斗中加水,便可检验其气密性是否良好。经检验他
的方案可行。则甲同学的操作方法、现象和结论是 。
②乙同学设计的方案是:往漏斗中注人一定量的水至浸没长颈漏头下端。
关闭活塞,用手捂住试管中上部,待漏斗中液面上升一定高度,打开活塞让液面回落后,迅速关闭活塞,松开手,见漏斗中液面低于试管中液面且不再升降,说明气密性良好。乙同学设计方案的原理是 。
答案。
37.(14分)某工业铁红中混有一种黑色的铁的氧化物杂质,为了解杂质的成分及测定铁红的纯度,化学兴趣小组的同学进行了实验探究。请你参与过程分析与交流。
[查阅资料]
①铁的常见氧化物
氧化亚铁(FeO)黑色固体,ω(Fe)=77.8%; 氧化铁(Fe2O3)红色固体,俗称铁红,
ω(Fe)=70.0%;四氧化三铁(Fe3O4)黑色固体,俗称磁性氧化铁,ω(Fe)=72.4%。
②草酸(乙二酸H2CO4)在浓H2SO4存在下受热分解的化学方程式为:
[实验准备]
①实验的装置图如下
②药品及试剂
a、草酸 b、工业铁红 c、NaOH溶液 d、澄清石灰水 e、浓H2SO4 f、盐酸
[实验及数据]
取不同质量的样品进行实验,所得实验数据如下:
讨论与分析]
(1)兴趣小组的同学拟以纯净的CO还原铁的氧化物,所设计的实验装置中D、E、F应分别盛放的试剂为 、 、 、(填写序号,下同),其作用依次是
。
上述装置还有不完善之处,你建议改进措施是
(2)由实验数据不难得出,有—组实验数据不可靠,该组数据是
(填序号),该工业粗铁红所含杂质的化学式为 。
(3)该工业铁红中ω(Fe2O3)= 。
答案。
38.现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下图表示:
混合溶液
溶液
沉淀A
溶液
沉淀B
溶液
沉淀C
固体D
过量试剂1
①
过量试剂2
②
过量试剂3
③
适量试剂4
④
(1) 写出上述实验过程中所用试剂的名称:
试剂1___________试剂2_____________试剂4________________
(2)恰当地控制试剂4的加入量的方法是_________________________________
(3)加入过量试剂3的目的是_______________________________
(4)在加入试剂4后,获得固体D的实验操作④是___________(填操作名称)
答案、(1)氯化钡溶液或硝酸钡溶液 硝酸银溶液 硝酸溶液
(2) 测定溶液的pH
(3) 除去溶液中过量的Ba2+、Ag+
(4) 蒸发、冷却、结晶、过滤
39.阿斯匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
+ (CH3CO)2O + CH3COOH
(水杨酸) (乙酸酐) (阿斯匹林)
在生成乙酰水杨酸的同时,水杨酸分子间也能发生缩合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
① 向150mL干燥锥形瓶中加入2g水杨酸、5mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85~90℃条件下反应5~10min。然后冷却,即有乙酰水杨酸晶体析出。
② 减压过虑,用滤液淋洗锥形瓶,直至所有晶体被收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量交溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③
将粗产品置于100mL烧杯中,搅拌并缓慢加入25mL饱和碳酸氢钠溶液,加完后继续搅拌2~3分钟,直到没有二氧化碳气体产生为止。过滤,用5~10mL蒸馏水洗涤沉淀,合并滤液于烧杯中,不断搅拌,慢慢加入15mL4mol/L盐酸,将烧杯置于冷水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
请回答下列问题:
(1) 第①步中,要控制反应温度在85~90℃,应采用_________ 加热方法。用这种加热方法需要的玻璃仪器有__________。
(2) 在第②步中,用冷水洗涤晶体,其目的是___________________________
(3) 第③步中,加入碳酸氢钠的作用是____________________
加入盐酸的作用是________________________
(4) 如何检验产品中是否混有水杨本?___________________________
答案、(1)水浴、酒精灯、烧杯、温度计
(2) 洗涤晶体表面附着的杂质、减少阿斯匹林因溶解而引起的损耗、
(3) 使阿斯匹林转化为可溶性盐,而与不溶性的物质相互分离。
将阿斯匹林的可溶性盐重新转化为阿斯匹林,从而达到提纯的目的
(4) 向水中加入少量产品,然后滴加FeCl3溶液,若有紫色出现,说明产品中有水杨酸;若无紫色出现,说明产品中不含水杨酸
40.(8分)某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
实验操作
实验现象
步骤1
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份
有少量气泡产生,溶液的黄绿色褪去
步骤2
将第一份滤液与稀盐酸混合
产生大量气泡
步骤3
将第二份滤液加热
溶液变浑浊,且有大量无色气体产生
⑴步骤1过滤的目的是__________________________________________。
⑵步骤2、步骤3的实验目的都是 ;为达到该实验目的,还可以采取的方法是 。
⑶请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大: 。
17.⑴除去碳酸钙等不溶性杂质
⑵检验HCO3—离子 另取一份滤液,加入NaOH溶液,观察有无沉淀产生
⑶同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢 (每空2分,共8分)
41.(12分)纳米材料在绝大多数同学眼里都非常神秘。某化学学习小组决定通过查阅有关资料,自己动手实验,制备纳米铁粉。
【实验原理】
⑴用硫酸亚铁、草酸两溶液制备草酸亚铁晶体(溶解度较小)。该反应的化学方程式是 。
⑵焙烧草酸亚铁晶体:FeC2O4·2H2OFe+2CO2↑+2H2O↑
【操作步骤】
⑴草酸亚铁晶体的制备
分别配制1L1mol/L
的FeSO4溶液、草酸溶液
取等体积两溶液混合、过滤、洗涤
所得沉淀
将所得沉淀放入烘箱,在50℃以下烘干
①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、FeSO4、草酸等实验用品,为配制上述两溶液,缺少的仪器有 。
②若配制的FeSO4溶液略呈黄色,可能的原因是 。
5mm
10mm
管内充满草酸亚铁晶体
③检验草酸亚铁晶体是否洗净的方法是 。
⑵纳米铁粉的制备
将一根长度约为12
cm~14cm的玻璃管在酒精喷灯上烧制成如图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
①实验中分解产生CO2所起的作用是 。
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间。你认为烧熔过早、过晚的后果是 。
答案.实验原理 FeSO4+H2C2O4+2H2O= Fe C2O4·2H2O+H2SO4
操作步骤
⑴草酸亚铁晶体的制备
①1L容量瓶、胶头滴管
②样品中可能含有Fe3+、蒸馏水未能事先处理、溶液配制时间较长
③取最后的洗涤液,测定洗涤液的pH,若洗涤液的pH等于7,说明已经洗涤干净
⑵纳米铁粉的制备
①驱赶装置中空气,防止红热的铁被氧化
②过早过晚都将导致所得纳米铁粉纯度不够(过早未能完全分解、过晚造成铁被氧化)
(每空2分,共12分)
42.(8分)文献资料显示,草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等。
某化学兴趣小组拟测定草木灰中钾盐的含量及钾盐中K2CO3的含量。
【测定草木灰中钾盐含量】
(1)该实验的主要步骤顺序为:称量.→ → → → →冷却→再称量(填字母序号)
A. 溶解 B.过滤 C、洗涤、烘干 D、蒸发
(2)称量前,在调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向 (填左、右)旋动。某学生称量时,在天平右盘加上规定质量的砝码后,在左盘的小烧杯中加入样品,此时指针稍偏右边,该学生的操作应为 。
(3)实验中A、B、C、D三步操作均使用了玻璃棒,操作B中玻璃棒的作用是 ,操作D用玻璃棒不断搅动的原因 。
【测定钾盐中K2CO3含量】
(4)取上述操作中所得的钾盐,配成稀溶液,加入CaCl2溶液使CO32-生成沉淀,过滤得到碳酸钙沉淀后,用蒸馏水多次洗涤,烘干、称量、计算。检验沉淀是否完全的方法是 ,检验沉淀是否洗净的方法是 。
答案.(8分)
(1)ABDC(2分)(颠倒不得分)
(2)左(1分), 继续往左盘小烧杯中慢慢加少量样品,使指针指向标尺中间,直至天平平衡(1分)
(3)引流(1分) 防止液体局部过热,液滴溅出(1分)
(4)沉淀后静置,向上层清液中加入CaCl2溶液,观察是否有沉淀生成,若无沉淀生成,则说明沉淀完全,反之则沉淀不完全。(1分)取最后一次洗涤液少许,滴入数滴K2CO3溶液(或AgNO3溶液等也可),若无沉淀产生,即沉淀洗涤干净。(1分)
43.(14分)硫酸铜是一种应用极其广泛的化工原料。制备硫酸铜是无机化学实验教学中一个重要的实验。由于铜不能与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
(1)图1中,A仪器的名称为 ,烧瓶中发生的离子反应方程式为 。
(2)图2是图1的改进装置,改进的目的是 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,反应完全后,向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。a、CaO b、CuCO3 c、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6g。请回答下列问题:
③该反应的离子反应方程式为 。
④控制温度在50℃和60℃加热的原因为 ,晶体采用酒精淋洗的优点是 。
⑤上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 。
答案(共14分)
(1)分液漏斗(1分)。Cu+4H++2NO3—=Cu2++2NO2↑+2H2O(或NO的方程式也可)(2分)。
(2)安全瓶(防止倒吸等)(1分)
(3)①坩埚(1分) ②b(1分) ③Cu+H2O2+2H+=Cu2++2H2O(2分)
④防止双氧水分解(1分),酒精与水互溶且极易挥发,减少晶体溶解(1分),第二组(2分)
理由:第一组中的方案1需要加热,消耗能源,方案2所得产品含有铁元素杂质。而第二组方案几乎不产生有害气体,且所得产品纯度较高。(2分)
44、(11分)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3 SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为
。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 。
实验Ⅱ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ。实验Ⅰ、Ⅱ产生的现象完全相同。由上述实验得出的结论是 。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② .
答案、(11分)实验Ⅰ:氢氧化铁胶体(或胶体)(1分);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生(2分);Fe3++3SCN-=Fe(SCN)3(1分);Ba2++SO42-=BaSO4↓(1分)。实验Ⅱ:Fe3+与SO32-同时发生氧化还原反应和双水解反应(2分)2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑(2分)
①SO32-有较强的还原性,CO32-没有还原性(1分);
②SO32-水解能力较CO32-小(1分)。
45、(13分)某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计了下图所示装置进行有关实验:
(1)先关闭活塞a,将6.4g铜片和12mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:
, ;
②B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。
③实验结束后,装置C中的溶液中可能含有的溶质有 ;
(2)事实表明,上述反应全部结束后,硫酸仍有剩余。为定量测定剩余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定剩余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请你写出其中的一种
;
②乙学生设计的方案是:将反应后的溶液冷却后全部移入100mL容量瓶中并加蒸馏水定容,取20ml于锥形瓶中,用酚酞作指示剂,用标准氢氧化钠溶液进行滴定,再求出余酸的物质的量的浓度。你认为乙学生设计的实验方案能否准确求得余酸的物质的量的浓度
(填“能”或“否”),理由是 。
答案、(13分)①Cu + 2H2SO4(浓)CuSO4 + SO2↑+ 2H2O, (2分)
2Cu+2H2SO4+O2=2CuSO4+2H2O (2分) ②B装置中导气管长进短出 (2分)
③Na2SO3、Na2SO4、NaOH (2分)
(2)①在通入O2之前,用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(2分)
②否 (1分) 用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,Cu2+的蓝色会干扰滴定终点的正确判断(2分)