- 817.92 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017年高考真题化学平衡汇编
(2017.全国 I 卷 28)
(3) H2S 与 CO2 在高温下发生反应:H2S(g)+CO2(g)COS(g) +H2O(g)。在 610 k 时,将 0.10 mol CO2 与 0.40 mol H2S 充入 2.5 L 的空钢瓶中,反应平衡后水的物质的量分数为 0.02。
①H2S 的平衡转化率a1 =_______%,反应平衡常数 K=________。
②在 620 K 重复试验,平衡后水的物质的量分数为 0.03,H2S 的转化率a2 _____a1,该反应的D H_____0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使 H2S 转化率增大的是________(填标号)
A.H2S B.CO2 C.COS D.N2
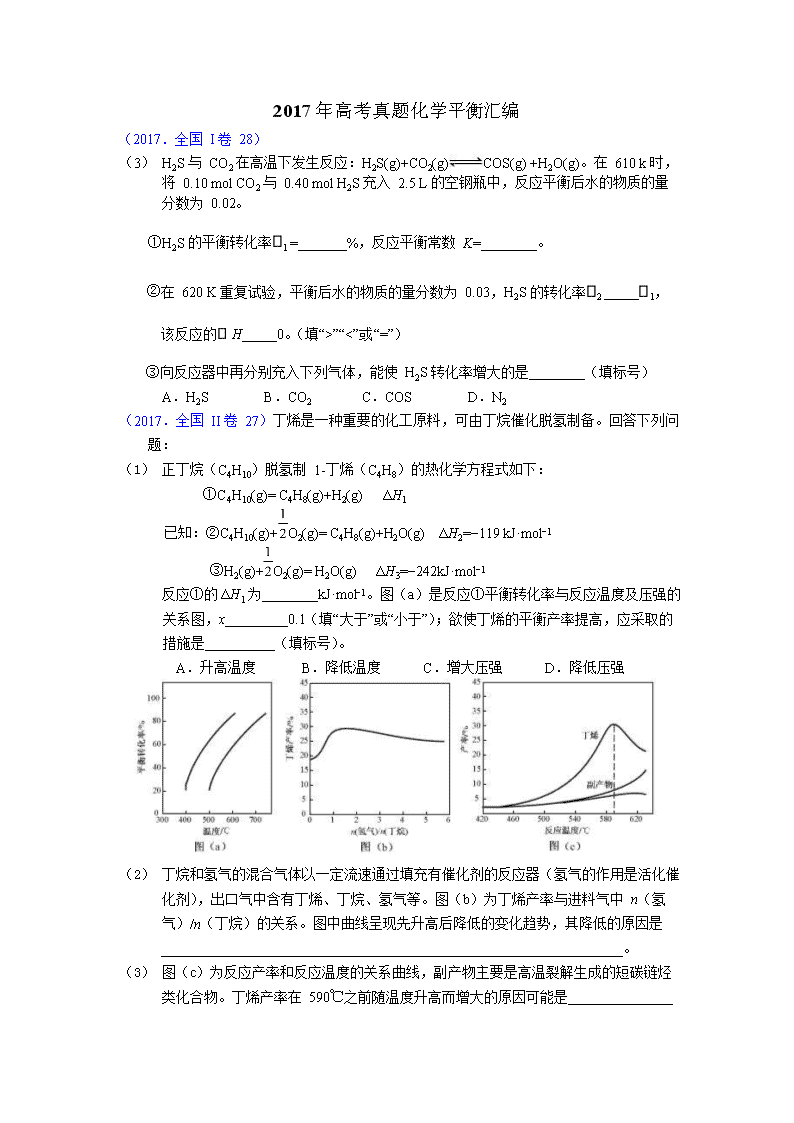
(2017.全国 II 卷 27)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1) 正丁烷(C4H10)脱氢制 1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+O2(g)= C4H8(g)+H2O(g) ΔH2=−119 kJ·mol−1
③H2(g)+O2(g)= H2O(g) ΔH3=−242kJ·mol−1
反应①的ΔH1 为________kJ·mol−1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(2) 丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中 n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是
__________________________________________________________________。
(3) 图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在 590℃之前随温度升高而增大的原因可能是_______________
_________________________________、______________________________________;
590℃之后,丁烯产率快速降低的主要原因可能是____________________________。(2017.全国 III 卷 28)
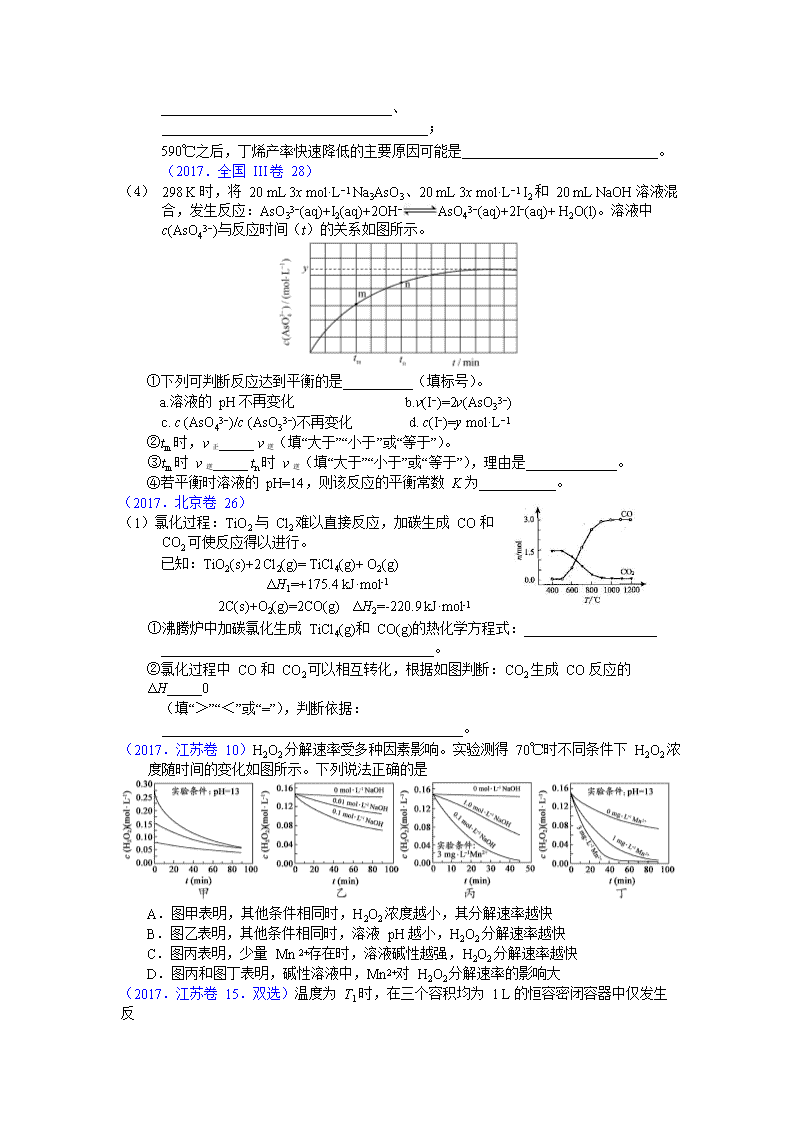
(1) 298 K 时,将 20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2 和 20 mL NaOH 溶液混合,发生反应:AsO33−(aq)+I2(aq)+2OH−AsO43−(aq)+2I−(aq)+ H2O(l)。溶液中 c(AsO43−)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的 pH 不再变化 b.v(I−)=2v(AsO33−)
c. c (AsO43−)/c (AsO33−)不再变化 d. c(I−)=y mol·L−1
②tm 时,v 正_____ v 逆(填“大于”“小于”或“等于”)。
③tm 时 v 逆_____ tn 时 v 逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的 pH=14,则该反应的平衡常数 K 为___________。
(2017.北京卷 26)
(1)氯化过程:TiO2 与 Cl2 难以直接反应,加碳生成 CO 和 CO2 可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g)
ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
①沸腾炉中加碳氯化生成 TiCl4(g)和 CO(g)的热化学方程式:___________________
_______________________________________。
②氯化过程中 CO 和 CO2 可以相互转化,根据如图判断:CO2 生成 CO 反应的ΔH_____0
(填“>”“<”或“=”),判断依据:___________________________________________。
(2017.江苏卷 10)H2O2 分解速率受多种因素影响。实验测得 70℃时不同条件下 H2O2 浓度随时间的变化如图所示。下列说法正确的是
A.图甲表明,其他条件相同时,H2O2 浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液 pH 越小,H2O2 分解速率越快
C.图丙表明,少量 Mn 2+存在时,溶液碱性越强,H2O2 分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对 H2O2 分解速率的影响大
(2017.江苏卷 15.双选)温度为 T1 时,在三个容积均为 1 L 的恒容密闭容器中仅发生反
应:2NO2(g) 2NO(g)+O2 (g) (正反应吸热)。实验测得:v 正= v(NO2)消耗=k 正c2(NO2), v 逆=v(NO)消耗=2v(O2)消耗=k 逆c2(NO)·c(O2),k 正、k 逆为速率常数,受温度影响。下列说法
正确的是
A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
c(O2) 比容器Ⅰ中的大
B.达平衡时,容器Ⅱ中
c(NO2)
C.达平衡时,容器Ⅲ中 NO 的体积分数小于 50%
D.当温度改变为 T2 时,若 k 正=k 逆,则 T2> T1
(2017.天津卷 6)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230℃
时,该反应的平衡常数 K=2×10−5。已知:Ni(CO)4 的沸点为 42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与 CO 反应转化成气态 Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至 230℃制得高纯镍。
下列判断正确的是_________。
A.增加 c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在 30℃和 50℃两者之间选择反应温度,选 50℃
C.第二阶段,Ni(CO)4 分解率较低
D.该反应达到平衡时,v 生成[Ni(CO)4]=4v 生成(CO)
(2017.天津卷 10)H2S 和 SO2 会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S 的除去
方法 1:生物脱 H2S 的原理为:
H2S+Fe2(SO4)3 S↓+2FeSO4+H2SO4
硫杆菌
4FeSO4+ O2+2H2SO4 2Fe2(SO4)3 +2H2O
(1) 硫杆菌存在时,FeSO4 被氧化的速率是无菌时的 5×105 倍,该菌的作用是
______________。
(2) 由图 3 和图 4 判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法 2:在一定条件下,用 H2O2 氧化 H2S
(1) 随着参加反应的 n(H2O2)/n(H2S)变化,氧化产物不同。当 n(H2O2)/n(H2S)=4 时,氧化产物的分子式为__________。
(2017.海南卷 11.双选)已知反应 CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.升高温度,K 减小 B.减小压强,n(CO2)增加
C.更换高效催化剂,α(CO)增大 D.充入一定量的氮气,n(H2)不变
(2017.4.浙江卷 12)已知:X(g)+2Y(g)3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列说法不正确的是
A.0.1 mol X 和 0.2 mol Y 充分反应生成 Z 的物质的量一定小于 0.3 mol
B.达到化学平衡状态时,X、Y、Z 的浓度不再发生变化
C.达到化学平衡状态时,反应放出的总热量可达 a kJ D.升高反应温度,逆反应速率增大,正反应速率减小(2017.4.浙江卷 21)对水样中溶质 M 的分解速率影响因素进行研究。在相同温度下,M 的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
时间
水样
0
5
10
15
20
25
Ⅰ
(
pH
=
2)
0.40
0.28
0.19
0.13
0.10
0.09
Ⅱ
(
pH
=
4)
0.40
0.31
0.24
0.20
0.18
0.16
Ⅲ
(
pH
=
4)
0.20
0.15
0.12
0.09
0.07
0.05
Ⅳ
pH
(
=
4
,含
Cu
2+
)
0.20
0.09
0.05
0.03
0.01
0
下列说法不正确的是
A.在 0~20 min 内,Ⅰ中 M 的分解速率为 0.015 mol·Lˉ1·minˉ1
B.水样酸性越强,M 的分解速率越快
C.在 0~25 min 内,Ⅲ中 M 的分解百分率比Ⅱ大
D.由于 Cu2+存在,Ⅳ中 M 的分解速率比Ⅰ快
(2017.4.浙江卷 30)
(2)在常压、Ru/TiO2 催化下,CO2 和 H2 混和气体(体积比 1∶4,总物质的量 a mol)进行反应,测得 CO2 转化率、CH4 和 CO 选择性随温度变化情况分别如图 1 和图 2 所示(选择性:转化的 CO2 中生成 CH4 或 CO 的百分比)。
反应Ⅰ CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH4 反应Ⅱ CO2(g)+H2(g) CO(g)+H2O(g) ΔH5
①下列说法不正确的是________
A.ΔH 4 小于零
B.温度可影响产物的选择性
C.CO2 平衡转化率随温度升高先增大后减少
D.其他条件不变,将 CO2 和 H2 的初始体积比改变为 1∶3,可提高 CO2 平衡转化率
②350℃时,反应Ⅰ在 t1 时刻达到平衡,平衡时容器体积为 V L,该温度下反应Ⅰ的平衡常数为________(用 a、V 表示)
③350℃下 CH4 物质的量随时间的变化曲线如图 3 所示。画出 400℃下 0~t1 时刻 CH4 物质的量随时间的变化曲线。