- 813.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高中化学易错点剖析与高考题逆袭(13)——水溶液中的离子平衡的图像题
【易错点剖析】:
阅读图像题需抓住关键问题:“一纵横,二增减,三辅助,四节点”。
“一纵横”就是面对图像,首先要弄清横纵坐标的含义及其对应的关系,一般横坐标是条件变化,纵坐标是变化的结果,一定要通过横纵坐标读出题中所对应的化学反应过程。
“二增减”是指弄清随横坐标递增,纵坐标的值是递增或是递减的,进一步分析其中的对应关系。一般来说,若曲线是单调递增(或递减)的,只涉及一个反应,若曲线是先增后减、或先减后增,必然涉及多个反应。
“三辅助”指通过画出辅助线来确定某点横纵坐标值的大小关系。
lgvv0
1 2 3 4
13
12
11
10
9
8
MOH
b
MOH
a
PH
﹒
﹒
“四节点”指根据图像进行计算时,要特别曲线中一些关键节点包含的信息。如曲线的起点、终点、转折点、交叉点等。
【例1】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg(V/V0)的变化如图所示,下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg(V/V0)=2时,若两溶液同时升高温度,则c(M+)/c(R+) 增大
答案D。
解析:看起点PH值,得知MOH强碱ROH是弱碱,A正确;弱碱加水稀释浓度越小电离度越大,B正确;无限稀释后忽略溶质,只剩水中c(OH-)自然相等,C正确;MOH是强碱完全电离,升温时c(M+)不变,ROH是弱碱,升温电离程度加大,c(R+)增大,c(M+)/c(R+)变小,D错误。
【例2】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断,下列说法正确的是( )
A.当y(NaOH)=20 mL时,溶液中离子浓度大小关系:
c(Na+)>c(HA一)>c(H+)>c(A2-)>c(OH—)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加入水的过程中,pH可能增大也可能减小
答案A。
解析:y(NaOH)=20 mL时,恰好完全生成NaHA,画图中20 mL处辅助线,得出c(A2-)> c(H2A),可知HA一电离程度大于水解程度,溶液显酸性,A正确,同时知B、C、D错误;
【例3】25℃时,某浓度的碳酸中含碳微粒的物质的量浓度的对数值与溶液的pH的关系如下图所示。下列说法正确的是( )
A. lgKa1(H2CO3)=6.38
B. C点对应溶液的pH=8.36
C. 溶液的pH=8时,c(HCO3-)>c(OH-)>c(CO32-)
D. 25℃时,反应CO32-+H2CO3=2HCO3-的平衡常数对数值1gK=-6.96
答案B。
解析:充分利用图像中的节点。Ka1(H2CO3)= c(H+)·c(HCO3-) / c(H2CO3) =10-6.38, lgKa1(H2CO3)=-6.38,A错误;C点对应c(CO32-)= c(H2CO3),Ka2(H2CO3)= c(H+)·c(CO32-) / c(HCO3-)=10-10.34,通过Ka1·Ka2= c2(H+)=10-16.72,求得c(H+)=10-8.36,pH=8.36,B正确;在PH=8处c(OH-)=10-6,看图像知c(CO32-)>10-6,C错;CO32-+H2CO3=2HCO3-的平衡常数K=c2(HCO3-)/c(CO32-)·c(H2CO3)=[c(H+)·c(HCO3-)/c(H2CO3)]·[c(HCO3-)/c(CO32-)·c(H+)]=Ka1/Ka2 =10-6.38/10-10.34 =103.96,1gK=3.96,D错。
【例4】常温下,向1LpH=10的NaOH溶液中持续通入CO2。通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如下图所示。下列叙述不正确的是( )
A.a点溶液中:水电离出的c(H+)=1×10-10mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(Na+)>c(CO32-)>c(HCO3-)
D.d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-)
答案选B。
解析:图像中水电离出的OH-离子浓度变化是先增后减的分段情况,可推知溶液中一定有多种物质同时对水电离产生影响。只要抓住水电离程度最大时的转折点,就不难推知:c处恰好完全生成Na2CO3,a点是NaOH溶液;b点是NaOH与Na2CO3混合溶液;d点是NaHCO3与过量CO2(或碳酸)的混合溶液。
【逆袭高考题】:
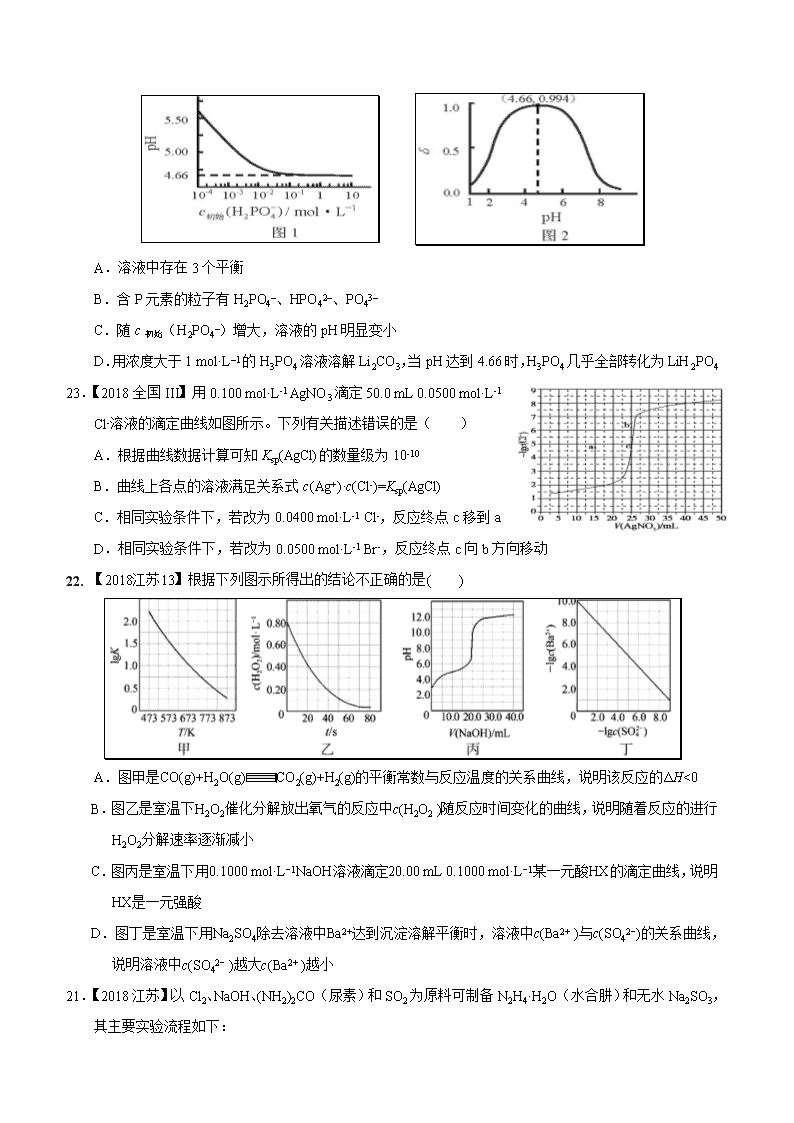
24.【2018年天津6】LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数随pH的变化如图2所示 []。下列有关LiH2PO4溶液的叙述正确的是( )
A.溶液中存在3个平衡
B.含P元素的粒子有H2PO4–、HPO42–、PO43–
C.随c初始(H2PO4–)增大,溶液的pH明显变小
D.用浓度大于1 mol·L–1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
23.【2018全国III】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
22. 【2018江苏13】根据下列图示所得出的结论不正确的是( )
A.图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小
21.【2018江苏】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、、随pH的分布如题19图−2所示,Na2SO3的溶解度曲线如题19图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
20.【2017全国I 13】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
A.K SP(H2X)的数量级为10-6
B.曲线N表示pH与的变化关系
C.NaHX溶液中
D.当混合溶液呈中性时,
19.【2017全国II 12】改变0.1 mol·L-1 二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(x)随pH的变化如图所示[已知]。下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg [K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
18. 【2017江苏20】(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。
①以酚酞为指示剂(变色范围pH 8.0-10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_____________________。
②H3AsO4第一步电离方程式H3AsO4H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1 )。
17.【2016江苏14】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A.pH=2.5的溶液中:c(H2C2O4)+ c(C2O42-)> c(HC2O4-)
B.c(Na+)=0.100 mol·L-1的溶液中:
c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C.c(HC2O4-)= c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D.pH=7.0的溶液中:c(Na+)>2 c(C2O42-)
16.【2016天津6】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:
c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
15.【2016全国I12】298K时,在20.0mL 0.10mol L−1氨水中滴入0.10 mol L−1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol L−1氨水的电离度为1.32%,下列有关叙述正确的是( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
14.【2015•山东13】室温下向10mL 0.1 mol•L﹣1NaOH溶液中加入0.1mol•L﹣1的一元酸HA溶液pH的变化曲线如图所示.下列说法正确的是( )
A.a点所示溶液中c(Na+)>c(A﹣)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A﹣)+c(HA)
D.b点所示溶液中c(A﹣)>c(HA)
13.【2015•浙江12】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
A.在pH=9.0时,c(NH4+)>c(HCO)>c(NH2COOˉ)>c(CO32-)
B.不同pH的溶液中存在关系:
c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入,不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
12.【2015•广东11】一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10﹣13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
11.【2015海南11】下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是( )
10.【2015福建23】(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如右图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开 始沉淀。[已知:Ksp(MnS)=2.8×10-13]
9.【2014浙江】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:Cl2(g) Cl2(aq),K1=10-1.2;Cl2(aq)+ H2O HClO + H+ +Cl,K2=10-3.4;HClO H+ + ClO-,Ka=?。其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )
A.Cl2(g)+ H2O 2H+ + ClO- + Cl- K=10-10.9
B.在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
8.【2014广东12】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A.HA是强酸
B.该混合液pH=7
C.图中x表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)+c(OH-)
7.【2014海南11】室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
A.II表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C.V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-)
D.V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)>
6.【2013山东13】某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=―lg[OH―])与pH的变化关系如图所示,则下列说法正确的是( )
A.M点所示溶液的导电能力强于Q点
B.N点 所示溶液中c(CH3COO―)>c(Na+)
C.M点和N点所示溶液中H2O的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
5.【2013浙江12】25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。下列说法正确的是( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)=+c(Z-)+c(OH-)
4.【2012江苏15】25 ℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是( )
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
3.【2011安徽13】室温下,将1.000 mol/L盐酸滴入20.00 mL1.000 mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法正确的是( )
A.a点由水电离出的c(H+)==1.0×10—14mol/L
B.b点:c(NH4+)+c(NH3·H2O)==c(Cl—)
C.c点:c(Cl—)==c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
2.【2010江苏12】常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 00 mol·L-1 CH3COOH溶液滴定曲线如图所示。下列说法正确的是( )
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
1.【2010浙江26】已知: ①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8X10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5X10-10 ②25℃时,2.0X10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到 c(HF)、c(F-)与溶液pH的变化关系,如下图(左)所示
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图上图(右)所示:反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是_____________________,反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈______________,列式并说明得出该常数的理由___________。
答案:
24.D 23.C 22.C
21. (3)①测量溶液的pH,若pH约为4,停止通SO2
②边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤
20.D 19.D
18. (2)①OH- + H3AsO3H2AsO3- + H2O ②2.2
17.BD 16.C 15.D 14.D 13.C 12.C 11.B
10. (2) ①0.043;②5
9.C 8.D 7.B 6. C 5. B 4. BC 3.C 2. D
1.(1)HSCN的酸性比CH3COOH强,其溶液中的c(H+)较大,故其溶液与NaHCO3溶液的反应速率较快;<
(2)3.5×10-4;