- 381.88 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
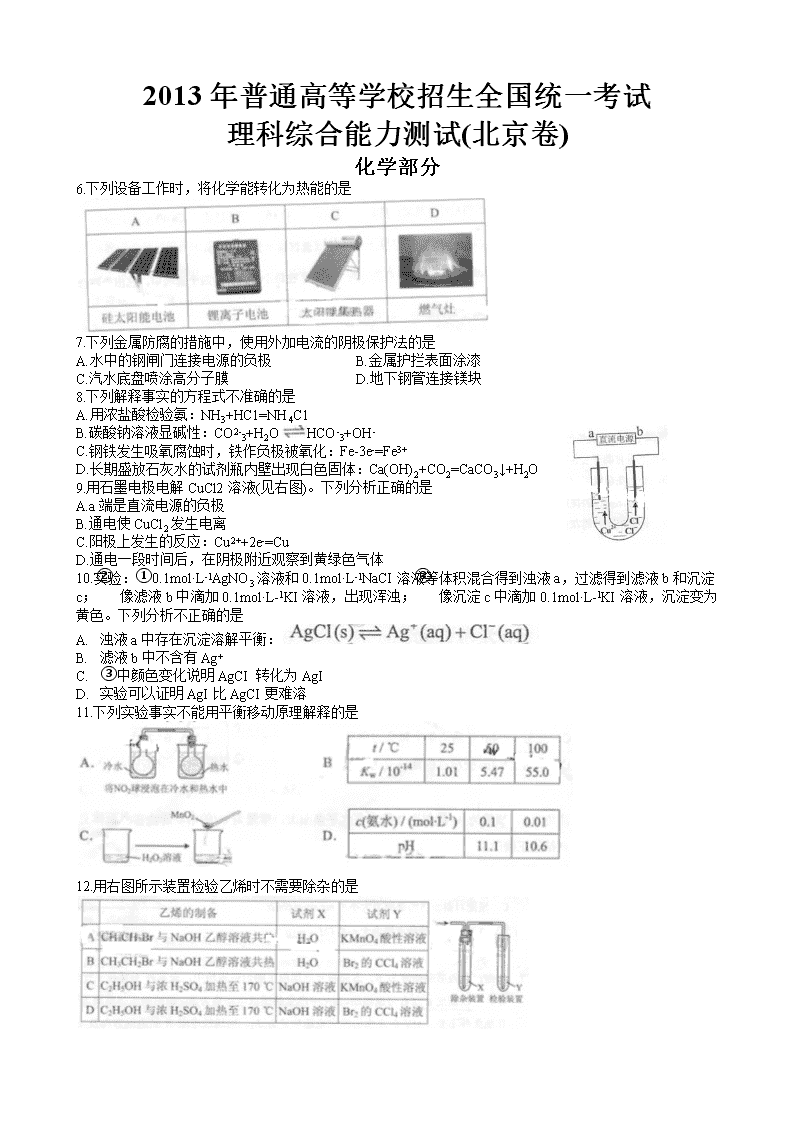
2013年普通高等学校招生全国统一考试
理科综合能力测试(北京卷)
化学部分
6.下列设备工作时,将化学能转化为热能的是
7.下列金属防腐的措施中,使用外加电流的阴极保护法的是
A.水中的钢闸门连接电源的负极 B.金属护拦表面涂漆
C.汽水底盘喷涂高分子膜 D.地下钢管连接镁块
8.下列解释事实的方程式不准确的是
A.用浓盐酸检验氨:NH3+HC1=NH4C1
B.碳酸钠溶液显碱性:CO2-3+H2OHCO-3+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
9.用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-=Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
10.实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCI溶液等体积混合得到浊液a,过滤得到滤液b和沉淀c;② 像滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 像沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A. 浊液a中存在沉淀溶解平衡:
B. 滤液b中不含有Ag+
C. ③中颜色变化说明AgCI 转化为AgI
D. 实验可以证明AgI比AgCI更难溶
11.下列实验事实不能用平衡移动原理解释的是
12.用右图所示装置检验乙烯时不需要除杂的是
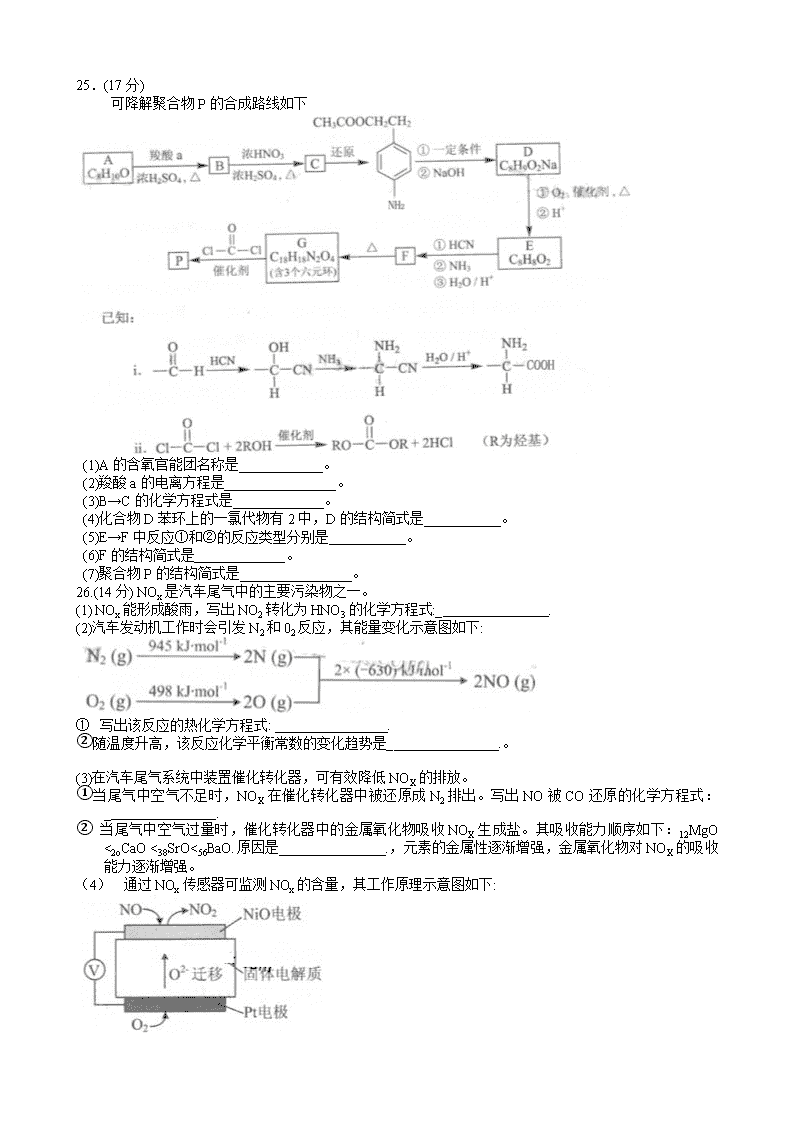
25.(17分)
可降解聚合物P的合成路线如下
(1)A的含氧官能团名称是____________。
(2)羧酸a的电离方程是________________。
(3)B→C的化学方程式是_____________。
(4)化合物D苯环上的一氯代物有2中,D的结构简式是___________。
(5)E→F中反应①和②的反应类型分别是___________。
(6)F的结构简式是_____________。
(7)聚合物P的结构简式是________________。
26.(14分) NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
① 写出该反应的热化学方程式: _ .
②随温度升高,该反应化学平衡常数的变化趋势是_ .。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ .
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO.原因是 .,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4) 通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: .
27.(12分)
用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ。向铝灰中加入过量稀H2SO4,过滤:
Ⅱ。向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ。加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ。加入MnSO4至紫红色消失,过滤;
Ⅴ。浓缩、结晶、分离,得到产品。
(1) H2S04溶解A1203的离子方程式是
(2) KMnO4 - 氧化Fe2+的离子方程式补充完整:
(3)已知:
生成氢氧化物沉淀的pH
Al(OH)3
Fe(OH)2
Fe(OH)3
开始沉淀时
3.4
6.3
1.5
完全沉淀时
4.7
8.3
2.8
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的:
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2,
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 .
② Ⅳ 中加入MnS04的目的是
28.(15分)
某学生对SO2与漂粉精的反应进行实验探究:
操作
现象
取4g漂粉精固体,加入100mL水
部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的pH
pH试纸先变蓝(约为12),后褪色
i. 液面上方出现白雾;
ii. 稍后,出现浑浊,溶液变为黄绿色;
iii. 稍后,产生大量白色沉淀,黄绿色褪去
(1)C12和Ca(OH)2制取漂粉精的化学方程是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HC1小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
②由实验a、b不能判断白雾中含有HCl,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
参考答案:
6、D 7、A 8、C 9、A 10、B 11、C 12、B
25、(1)羟基
(2)CH3COOHCH3COO-+H+
(3) +HNO3
(4)
(5)加成反应 取代反应
(6)
(7)
26、(1)3NO3+H2O=2HNO3+NO
(2)①N2(g)+O2(g)=2NO(g) △H=+183kJ/mol ②增大
(3)①2NO+2CON2+2CO2
②根据Mg、Ca、Sr、Ba质量数得都为IIA族元素,同主族元素从上到下原子半径逐渐增大
(4)①还原 ②NO-2e-+O2-=NO2
27、(1)Al2O3+6H+=2Al3++3H2O
(2)5 8 H+ 5 4 H2O
(3)pH为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,并使Fe3+转化为Fe(OH)3而除去
(4)①有气泡产生,收集气体,呈黄绿色 ②还原过量的MnO4-转化为MnO2
28、(1)2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
(2)碱性 漂白性
(3)①检验是否含有Cl2,排除Cl2干扰 ②如果白雾中混有SO2,加入AgNO3后仍会有白色沉淀
(4)向漂粉精中逐滴加入硫酸,观察溶液是否变为黄绿色
(5)①CaSO4 ②SO2+Cl2+2H2O=SO42-+2Cl-+4H+