- 1.17 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018届广州市普通高中毕业班综合测试(二)
理科综合——化学
相对原子质量: H 1; Li 7 ; B 11 ; C 12 ; N 14 ; O 16 ; P 31; Fe56 ; Ge 73
第I卷
一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.(2018广州二测)化学与生活密切相关。 下列对化学事实的解释错误的是
选项
事实
解释
A
粮食酿酒
发生淀粉→葡萄糖→乙醇的化学变化过程
B
汽车排气管上加装“催化转化器”
使NO和CO 转化为CO2和N2
C
水中的钢闸门连接电源的负极
利用牺牲阳极的阴极保护法对钢闸门进行防腐
D
纯碱溶液清洗油污
油脂在碱性条件下水解生成甘油和高级脂肪酸钠
C
8.(2018广州二测)NA为阿伏加德罗常数的值。 下列说法正确的是
A. 25℃时, pH=1 的 CH3COOH 溶液中含有 H+的数目为 0.1NA
B. 0.1mol H2(g)和 0.2mol I2(g)于密闭容器中充分反应后,其分子总数为 0.3NA
C. 0.1mol CH3OH 分子中含有 C-H 键的数目为 0.4NA
D. 1.1g 的 11B 中含有的中子数 0.5NA
B
9.(2018广州二测)下列关于化合物的说法正确的是
A.Ⅰ、Ⅱ、Ⅲ、Ⅳ的沸点依次升高
B.Ⅰ、Ⅲ的一氯代物均只有四种
C.Ⅱ、Ⅲ中碳原子可能都处于同一平面
D.Ⅲ、Ⅳ都属于芳香族化合物,互为同系物
A
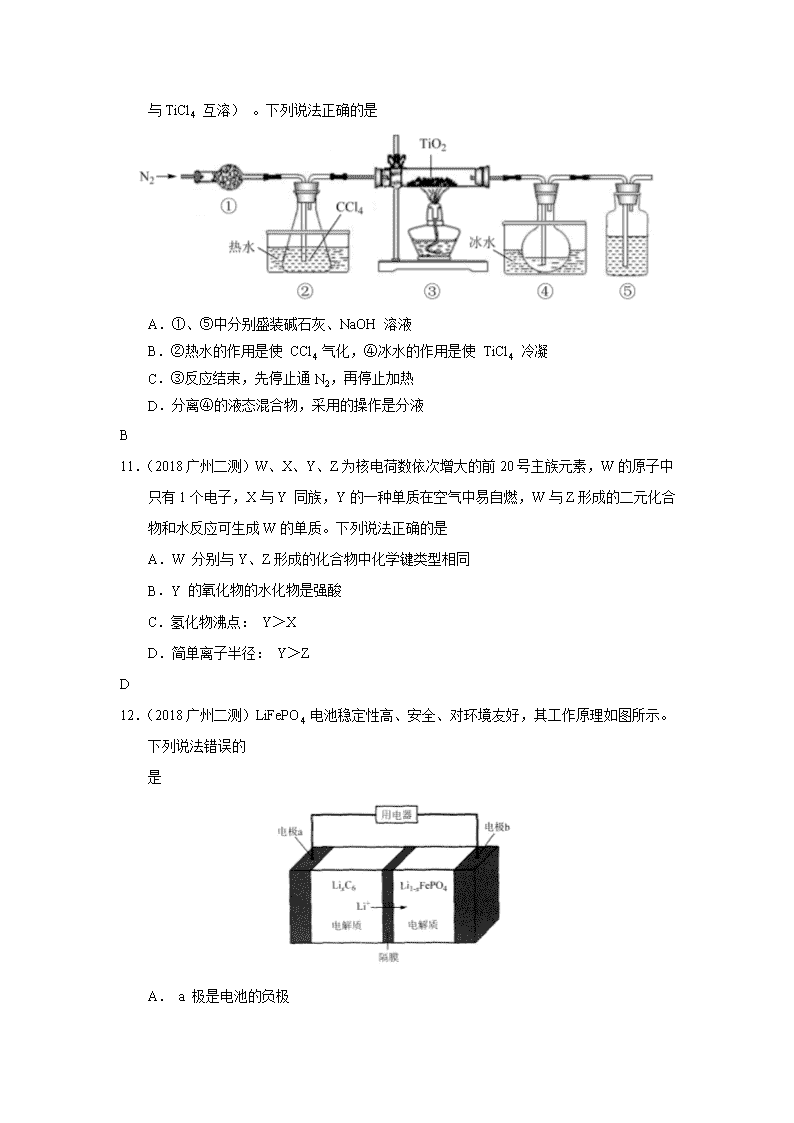
10.(2018广州二测)实验室利用反应 TiO2(s)+CCl4(g) TiCl4(g) +CO2(g), 在无水无氧下制取 TiCl4,实验装置如图所示(CCl4、 TiCl4 的沸点分别为:76℃、136℃,CCl4
与TiCl4 互溶) 。下列说法正确的是
A.①、⑤中分别盛装碱石灰、NaOH 溶液
B.②热水的作用是使 CCl4 气化,④冰水的作用是使 TiCl4 冷凝
C.③反应结束,先停止通N2,再停止加热
D.分离④的液态混合物,采用的操作是分液
B
11.(2018广州二测)W、X、Y、Z为核电荷数依次增大的前20号主族元素,W的原子中只有1个电子,X与Y 同族,Y的一种单质在空气中易自燃,W与Z形成的二元化合物和水反应可生成W的单质。下列说法正确的是
A.W 分别与Y、Z形成的化合物中化学键类型相同
B.Y 的氧化物的水化物是强酸
C.氢化物沸点: Y>X
D.简单离子半径: Y>Z
D
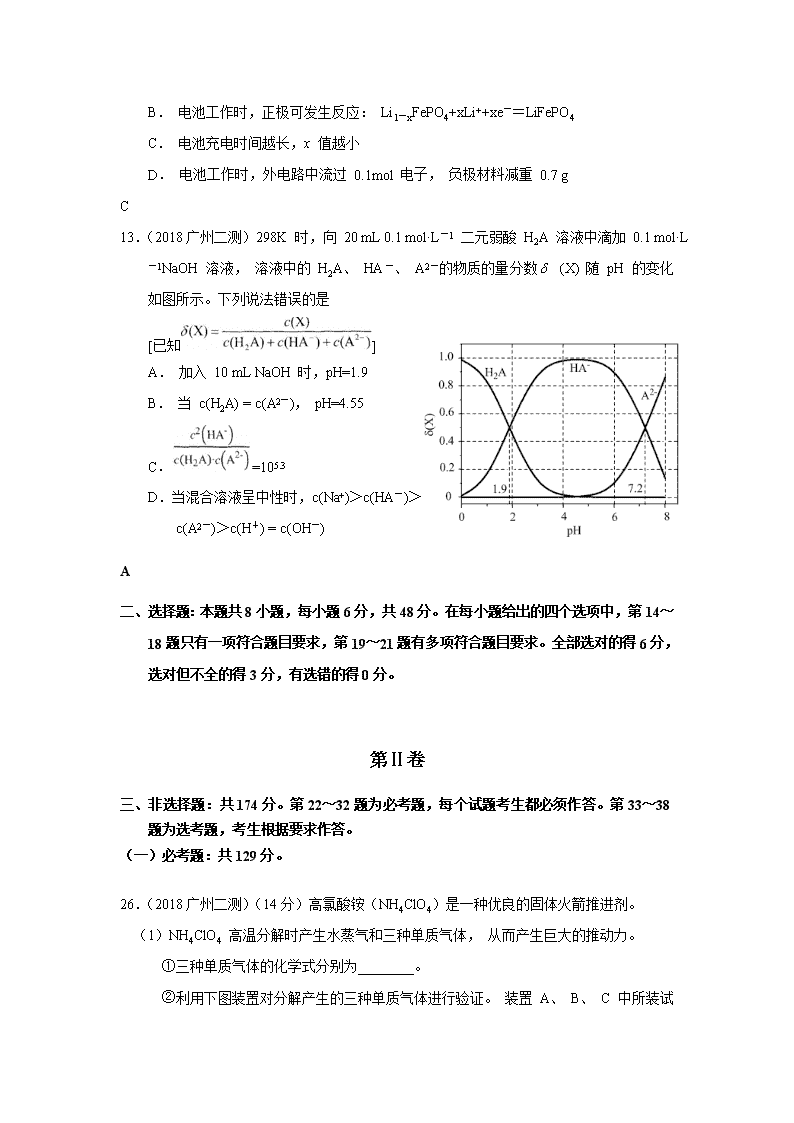
12.(2018广州二测)LiFePO4 电池稳定性高、安全、对环境友好,其工作原理如图所示。下列说法错误的
是
A. a 极是电池的负极
B. 电池工作时,正极可发生反应: Li1-xFePO4+xLi++xe-=LiFePO4
C. 电池充电时间越长,x 值越小
D. 电池工作时,外电路中流过 0.1mol 电子, 负极材料减重 0.7 g
C
13.(2018广州二测)298K 时,向 20 mL 0.1 mol·L-1 二元弱酸 H2A 溶液中滴加 0.1 mol·L-1NaOH 溶液, 溶液中的 H2A、 HA-、 A2-的物质的量分数 (X) 随 pH 的变化如图所示。下列说法错误的是
[已知]
A. 加入 10 mL NaOH 时,pH=1.9
B. 当 c(H2A) = c(A2-), pH=4.55
C.=105.3
D.当混合溶液呈中性时,c(Na+)>c(HA-)>
c(A2-)>c(H+) = c(OH-)
A
二、选择题:本题共8小题,每小题6分,共48分。在每小题给出的四个选项中,第14~18题只有一项符合题目要求,第19~21题有多项符合题目要求。全部选对的得6分,选对但不全的得3分,有选错的得0分。
第Ⅱ卷
三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分。
26.(2018广州二测)(14分)高氯酸铵(NH4ClO4)是一种优良的固体火箭推进剂。
(1)NH4ClO4 高温分解时产生水蒸气和三种单质气体, 从而产生巨大的推动力。
①三种单质气体的化学式分别为________。
②利用下图装置对分解产生的三种单质气体进行验证。 装置 A、 B、 C
中所装试剂依次为________(填标号) 。
a. 湿润的淀粉 KI 试纸 b. 湿润的红色布条 c. NaOH 溶液
d. Na2SO3 溶液 e. CuO f. Cu
(2)NH4ClO4 的质量分数可通过甲醛法测定。
已知: NH4ClO4 与甲醛反应的离子方程式为:4NH4++6HCHO=(CH2)6N4H++3H++6H2O
(CH2)6N4H+ (CH2)6N4+H+ K=7×10-6
实验步骤:
Ⅰ.取 a g NH4ClO4 产品于锥形瓶中,用水溶解,加入40mL甲醛水溶液,充分反应。
Ⅱ.以酚酞作指示剂, 用 c mol·L-1 标准 NaOH 溶液滴定。 记录数据。
Ⅲ.重复步骤Ⅰ、 Ⅱ 2~3 次,处理数据。
①实验室中得到标准 NaOH 溶液的方法是_______。
②步骤Ⅱ发生反应的离子方程式是_______。
③若实验平均消耗 NaOH 溶液的体积为bmL。NH4ClO4 质量分数的计算式为_______。
④实验中使用的甲醛常混有微量甲酸, 会导致测定结果偏____(填“高”或“低”)。 混有甲酸的原因是_______。
27. (2018
广州二测) (14分)已知氧化锌烟尘主要成分为 ZnO, 还含有 PbO、 Ag2O、 CuO、 CdO、 GeO2、
MnO、 FeO等。 从烟尘中回收锗锌的工艺流程如下:
回答下列问题。
(1) 用过量焦炭高温还原 GeO2的化学方程式为_______。
(2) 锌粉的作用有:除去铜、镉等杂质、______。
(3) (NH4)2S2O8中 S的化合价为+6, 则 S2O82-中含过氧键数目为_____。 用(NH4)2S2O8除锰的离子方程式为____________。
(4) “滤液 B” 的主要成份为______。“沉锌” 中反应的化学方程式为____________。
(5) 若“滤液 A” 中 c(Pb2+)=2×10-9mol·L-1, 此时 c(Ag+)=_______mol·L-1。
(已知: Ksp(PbSO4) =2×10-8mol·L-1, Ksp(Ag2SO4) =1×10-5mol·L-1)
28. (2018广州二测)(15 分)CO2加氢制备甲酸(HCOOH) 可用于回收利用CO2。回答下列问题:
(1)已知:C(s)+O2(g) = CO2(g) △H1=-394 kJ·mol-1
C(s)+H2(g) +O2(g) = HCOOH(g) △H2=-363 kJ·mol-1
反应 CO2(g) +H2(g)HCOOH(g)的△H=_____________。
(2) 温度为 T1时, 将等物质的量的 CO2和 H2充入体积为 1L的密闭容器中发生反应:
CO2(g)+ H2 (g)HCOOH(g) K=1
实验测得: v正=k正c(CO2) ·c(H2),v逆=k逆c (HCOOH),k正、k逆为速率常数。
①当 HCOOH 的体积分数为 20%时, CO2的转化率为___________。
②T1时,k正=_____(以 k逆表示)。当温度改变为 T2时, k正=0.9k逆,则T2_____T1(填“>”、“<” 或“=”)。
(3)采用水热法,用NaHCO3代替 CO2作为碳源有利于实现 CO2加氢制备甲酸。向反应器中加入NaHCO3水溶液、 Al粉、Cu粉,在300℃下反应2h, 实验结果如下表。
①实验 III 比 II 碳转化率高的原因是__________________________。
②NaHCO3用量一定时,Al、Cu的用量对碳转化率影响结果如上图。由图可知,对碳转化率影响较大的是________(填“Al” 或“Cu” )的用量。当碳转化率为30%时所采用的实验条件是_________。
(4)采用电还原法也可将CO2 转化为甲酸,用Sn为阴极、Pt为阳极,KHCO3溶液为电解液进行电解。CO2 应通入 区(填“阳极” 或“阴极”), 其电极反应式为_______。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一题计分。
35.(2018广州二测)[化学——选修 3: 物质结构与性质](15 分)
石墨烯(图a)是一种由单层碳原子构成的平面结构新型导电材料,具有大π共轭体系。 石墨烯中部分碳原子被氧化后,其平面结构发生改变,转化为氧化石墨烯(图 b) 。
(1) 图a中,1号C的杂化方式为________, 石墨烯中含有的化学键类型是________; 图 b中键角α___键角β。(填“>” 、 “<” 或“=” )
(2)五氧化二钒/二氧化钛/石墨烯复合材料可用于新型电池,基态钒原子的价电子排布式为_____;同周期元素中最外层电子数与钛相同的有 种; 金属钒和钛熔点较高的是________, 原因是_________。
(3)醋酸铜可合成复合材料石墨烯/Cu, 其制备原料为 CuSO4、 NH3·H2O 和醋酸等。
①写出一种与 SO42-互为等电子体的分子_______。
②二聚醋酸铜的结构示意图如下所示,其化学式为________, Cu2+的配位数为______。
(4)石墨烯可转化为富勒烯(C60)。C60和K能形成新型化合物,其晶胞如图所示,晶胞参数为 a nm。 该化合物中 K原子和 C60分子的个数比为______, 该晶体的密度ρ=_____ g·cm-3。
36.(2018广州二测)[化学——选修 5: 有机化学基础](15 分)
在光的引发下, 烯炔的环加成是合成四元环化合物的有效方法。以下是用醛A合成一种环丁烯类化合物 I的路线图:
已知:
①A生成 B的原子利用率为100%
②
回答以下问题:
(1)A的名称为________。
(2)由 C生成 D和由 F生成 G的反应类型分别为________、________。
(3)D生成 F的化学方程式为________。
(4)I的分子式为________。
(5)在 上述合成路线中,互为同分异构体的化合物是________(填化合物代号)。H 的
同分异X既能与氯化铁溶液发生显色反应,又能发生银镜反应,除苯环外没有其他环的共有________种。
(6)写出用与乙炔为原料制备化合物的合成路线(其他试剂任选)。
_____________________________________________________________。