- 912.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第 1 页 共 20 页
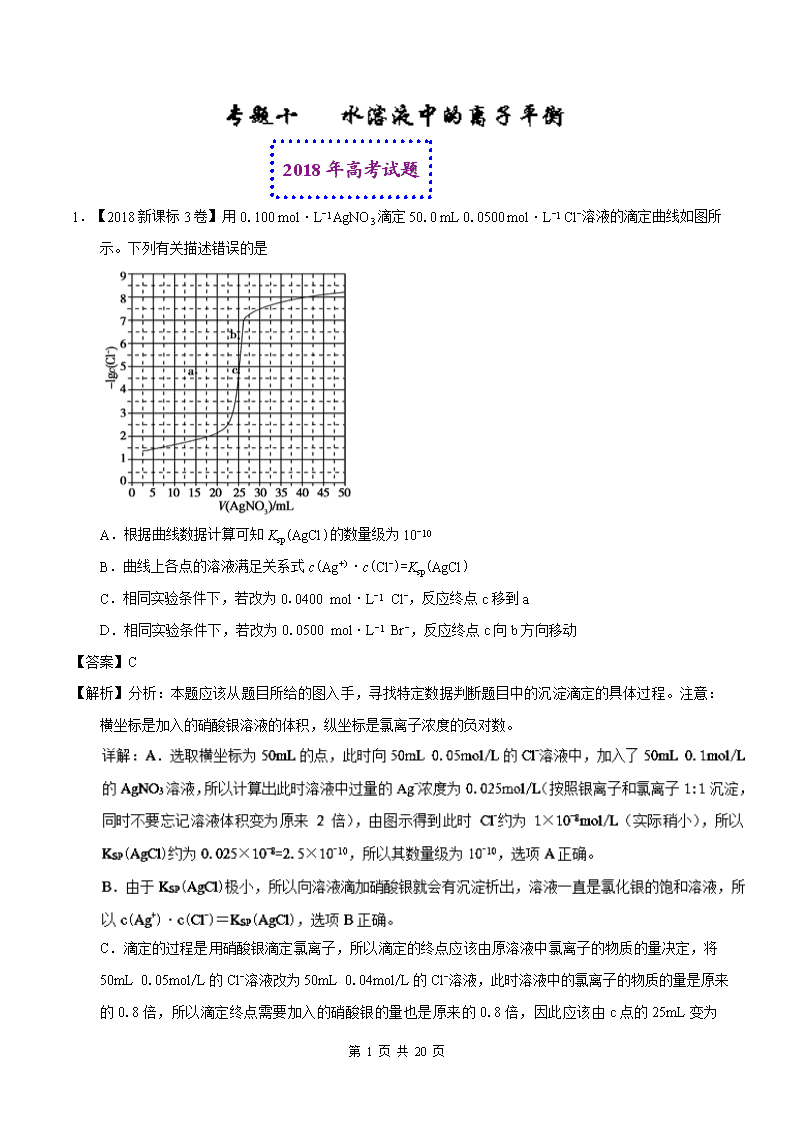
2018 年高考试题
1.【2018 新课标 3 卷】用 0.100 mol·L-1 AgNO3 滴定 50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图
所示。下列有关描述错误的是
A.根据曲线数据计算可知 Ksp(AgCl)的数量级为 10-10
B.曲线上各点的溶液满足关系式 c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为 0.0400 mol·L-1 Cl-,反应终点 c 移到 a
D.相同实验条件下,若改为 0.0500 mol·L-1 Br-,反应终点 c 向 b 方向移动
【答案】C
【解析】分析:本题应该从题目所给的图入手,寻找特定数据判断题目中的沉淀滴定的具体过程。注意:
横坐标是加入的硝酸银溶液的体积,纵坐标是氯离子浓度的负对数。
C.滴定的过程是用硝酸银滴定氯离子,所以滴定的终点应该由原溶液中氯离子的物质的量决定,将
50mL 0.05mol/L 的 Cl-溶液改为 50mL 0.04mol/L 的 Cl-溶液,此时溶液中的氯离子的物质的量是原来
的 0.8 倍,所以滴定终点需要加入的硝酸银的量也是原来的 0.8 倍,因此应该由 c 点的 25mL 变为
第 2 页 共 20 页
25×0.8=20mL,而 a 点对应的是 15mL,选项 C 错误。
点睛:本题虽然选择了一个学生不太熟悉的滴定过程——沉淀滴定,但是其内在原理实际和酸碱中和滴定
是一样的。这种滴定的理论终点都应该是恰好反应的点,酸碱中和滴定是酸碱恰好中和,沉淀滴定就
是恰好沉淀,这样就能判断溶液发生改变的时候,滴定终点如何变化了。
2.【2018 北京卷】测定 0.1 mol·L-1 Na2SO3 溶液先升温再降温过程中的 pH,数据如下。
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
pH 9.66 9.52 9.37 9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的 BaCl2 溶液做对比实验,④产生白色沉淀多。
下列说法不正确...的是
A.Na2SO3 溶液中存在水解平衡: +H2O +OH−
B.④的 pH 与①不同,是由于 浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的 Kw 值相等
【答案】C
【解析】分析:A 项,Na2SO3 属于强碱弱酸盐,SO32-存在水解平衡;B 项,取①④时刻的溶液,加入盐酸
酸化的 BaCl2 溶液做对比实验,④产生白色沉淀多,说明实验过程中部分 Na2SO3 被氧化成 Na2SO4,①
与④温度相同,④与①对比,SO32-浓度减小,溶液中 c(OH-),④的 pH 小于①;C 项,盐类水解为吸
热过程,①→③的过程,升高温度 SO32-水解平衡正向移动,c(SO32-)减小,水解平衡逆向移动;D
项,Kw 只与温度有关。
详 解 : A 项 , Na2SO3 属 于 强 碱 弱 酸 盐 , SO32- 存 在 水 解 平 衡 : SO32-+H2O HSO3
-+OH- 、
HSO3
-+H2O H2SO3+OH-,A 项正确;B 项,取①④时刻的溶液,加入盐酸酸化的 BaCl2 溶液做对比
第 3 页 共 20 页
实验,④产生白色沉淀多,说明实验过程中部分 Na2SO3 被氧化成 Na2SO4,①与④温度相同,④与①对
比,SO32-浓度减小,溶液中 c(OH-),④的 pH 小于①,即④的 pH 与①不同,是由于 SO32-浓度减小
造成的,B 项正确;C 项,盐类水解为吸热过程,①→③的过程,升高温度 SO32-水解平衡正向移动,c
(SO32-)减小,水解平衡逆向移动,温度和浓度对水解平衡移动方向的影响相反,C 项错误;D 项,
Kw 只与温度有关,①与④温度相同,Kw 值相等;答案选 C。
点睛:本题考查盐类水解离子方程式的书写、外界条件对盐类水解平衡的影响、影响水的离子积的因素、
SO32-的还原性。解题时注意从温度和浓度两个角度进行分析。
3.【2018 天津卷】LiH2PO4 是制备电池的重要原料。室温下,LiH2PO4 溶液的 pH 随 c 初始(H2PO4
–)的变
化如图 1 所示,H3PO4 溶液中 H2PO4
–的分布分数δ随 pH 的变化如图 2 所示,[ ]
下列有关 LiH2PO4 溶液的叙述正确的是
A.溶液中存在 3 个平衡
B.含 P 元素的粒子有 H2PO4
–、HPO42–、PO43–
C.随 c 初始(H2PO4
– )增大,溶液的 pH 明显变小
D.用浓度大于 1 mol·L-1的 H3PO4 溶液溶解 Li2CO3,当 pH 达到 4.66 时,H3PO4 几乎全部转化为 LiH2PO4
【答案】D
【解析】分析:本题考查电解质溶液的相关知识。应该从题目的两个图入手,结合磷酸的基本性质进行分
析。
D.由图 2 得到,pH=4.66 的时候,δ=0.994,即溶液中所有含 P 的成分中 H2PO4
–占 99.4%,所以此时
第 4 页 共 20 页
H3PO4 几乎全部转化为 LiH2PO4。选项 D 正确。
点睛:本题中随着 c 初始(H2PO4
–)增大,溶液的 pH 有一定的下降,但是达到一定程度后就基本不变了。主
要是因为 H2PO4
–存在电离和水解,浓度增大电离和水解都会增加,影响会互相抵消。
4.【2018 天津卷】下列叙述正确的是
A.某温度下,一元弱酸 HA 的 Ka 越小,则 NaA 的 Kh(水解常数)越小
B.铁管镀锌层局部破损后,铁管仍不易生锈
C.反应活化能越高,该反应越易进行
D.不能用红外光谱区分 C2H5OH 和 CH3OCH3
【答案】B
【解析】分析:本题是对化学理论进行的综合考查,需要对每一个选项的理论表述进行分析,转化为对应
的化学原理,进行判断。
D.红外光谱是用来检测有机物中的官能团或特定结构的,C2H5OH 和 CH3OCH3 的官能团明显有较大
差异,所以可以用红外光谱区分,选项 D 错误。
点睛:反应的活化能是指普通分子达到活化分子需要提高的能量,则活化能越大,说明反应物分子需要吸
收的能量越高(即,引发反应需要的能量越高),所以活化能越大,反应进行的就越困难。从另一个角
度理解,课本中表述为,活化能越大,反应的速率应该越慢,这样也可以认为活化能越大,反应越困
难。
5.【2018 江苏卷】根据下列图示所得出的结论不正确的是
第 5 页 共 20 页
A.图甲是 CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B.图乙是室温下 H2O2 催化分解放出氧气的反应中 c(H2O2 )随反应时间变化的曲线,说明随着反应的
进行 H2O2 分解速率逐渐减小
C.图丙是室温下用 0.1000 mol·L−1NaOH 溶液滴定 20.00 mL 0.1000 mol·L−1 某一元酸 HX 的滴
定曲线,说明 HX 是一元强酸
D.图丁是室温下用 Na2SO4 除去溶液中 Ba2+达到沉淀溶解平衡时,溶液中 c(Ba2+ )与 c(SO42−)的关系
曲线,说明溶液中 c(SO42− )越大 c(Ba2+ )越小
【答案】C
【解析】分析:A 项,升高温度,lgK 减小,平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反
应,该反应的ΔH 0;B 项,根据图像,随着时间的推移,c(H2O2)变化趋于平缓,随着反应的进行
H2O2 分解速率逐渐减小;C 项,根据图像,没有滴入 NaOH 溶液时,0.1000mol/LHX 溶液的 pH 1,
HX 为一元弱酸;D 项,根据图像可见横坐标越小,纵坐标越大,-lgc(SO42-)越小,-lgc(Ba2+)越
大,说明 c(SO42-)越大 c(Ba2+)越小。
点睛:本题考查图像的分析,侧重考查温度对化学平衡常数的影响、化学反应速率、酸碱中和滴定 pH 曲线
的分析、沉淀溶解平衡曲线的分析,掌握有关的原理,明确图像中纵、横坐标的含义和曲线的变化趋
势是解题的关键。
第 6 页 共 20 页
6.【2018 江苏卷】H2C2O4 为二元弱酸,Ka1 (H2C2O4 ) =5.4×10−2,Ka2 (H2C2O4 ) =5.4×10−5,设 H2C2O4
溶液中 c(总)=c(H2C2O4) +c(HC2O4
−) +c(C2O42−)。室温下用 NaOH 溶液滴定 25.00 mL 0.1000 mol·L
−1H2C2O4 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
A.0.1000 mol·L−1 H2C2O4 溶液:c(H+ ) =0.1000 mol·L−1+c(C2O42− )+c(OH−)−c(H2C2O4 )
B.c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42− ) >c(H+ )
C.pH = 7 的溶液:c(Na+ ) =0.1000 mol·L−1+ c(C2O42−) −c(H2C2O4)
D.c(Na+ ) =2c(总)的溶液:c(OH−) −c(H+) = 2c(H2C2O4) +c(HC2O4
−)
【答案】AD
详解:A 项,H2C2O4 溶液中的电荷守恒为 c(H+)=c(HC2O4
-)+2c(C2O42-)+c(OH-),0.1000 mol·L
−1H2C2O4 溶液中 0.1000mol/L=c(H2C2O4)+ c(HC2O4
-)+ c(C2O42-),两式整理得 c(H+)=0.1000mol/L-c
(H2C2O4)+c(C2O42-)+c(OH-),A 项正确;B 项,c(Na+)=c(总 )时溶液中溶质为 NaHC2O4,
HC2O4
-既存在电离平衡又存在水解平衡,HC2O4
-水解的离子方程式为 HC2O4
-+H2O H2C2O4+OH-,
HC2O4
- 水 解 常 数
第 7 页 共 20 页
Kh= = = = =1.85 10-13
Ka2(H2C2O4),HC2O4
-的电离程度大于水解程度,则 c(C2O42-) c(H2C2O4),B 项错误;C 项,滴
入 NaOH 溶液后,溶液中的电荷守恒为 c(Na+)+c(H+)=c(HC2O4
-)+2c(C2O42-)+c(OH-),室温
pH=7 即 c(H+)=c(OH-),则 c(Na+)=c(HC2O4
-)+2c(C2O42-)=c(总)+c(C2O42-)-c(H2C2O4),
由于溶液体积变大,c(总) 0.1000mol/L,c(Na+) 0.1000mol/L +c(C2O42-)-c(H2C2O4),C
项错误;D 项,c(Na+)=2c(总)时溶液中溶质为 Na2C2O4,溶液中的电荷守恒为 c(Na+)+c(H+)
=c(HC2O4
-)+2c(C2O42-)+c(OH-),物料守恒为 c(Na+)=2[c(H2C2O4) + c(HC2O4
-)+ c(C2O42-)],
两式整理得 c(OH-)-c(H+)=2c(H2C2O4)+c(HC2O4
-),D 项正确;答案选 AD。
点睛:本题考查溶液中粒子浓度的大小关系。确定溶液中粒子浓度大小关系时,先确定溶质的组成,分析
溶液中存在的平衡,弄清主次(如 B 项),巧用电荷守恒、物料守恒和质子守恒(质子守恒一般可由电
荷守恒和物料守恒推出)。注意加入 NaOH 溶液后,由于溶液体积变大,c(总) 0.1000mol/L。
2018 届高考模拟试题
7.【2018 届扬州市三模】向湿法炼锌的电解液中同时加入 Cu 和 CuSO4,可生成 CuCl 沉淀除去 Cl—,降低
对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq) 2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq) CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液 pH 对溶液中残留 c(Cl—)的影响如图所示。下列说法正确的是
A.向电解液中加入稀硫酸,有利于 Cl-的去除
B.溶液 pH 越大,Ksp(CuCl)增大
C.反应达到平衡增大 c(Cu2+),c(Cl—)减小
D. Cu(s)+ Cu2+(aq)+Cl—(aq) CuCl(s)的ΔH=(a+2b) kJ·mol-1
第 8 页 共 20 页
【答案】C
【解析】分析:A.根据图像分析 pH 与氯离子浓度的关系;
B.根据溶度积常数只与温度有关系;
C.根据外界条件对平衡的影响分析;
D.根据盖斯定律计算。
详解:A.根据图像,溶液的 pH 越小,溶液中残留 c(Cl—)越大,因此向电解液中加入稀硫酸,不利于
Cl-的去除,A 错误;
B.Ksp(CuCl)只与温度有关,与溶液 pH 无关,B 错误;
C.根据 Cu(s)+Cu2+(aq) 2Cu+(aq)可知增大 c(Cu2+),平衡正向移动,使得 c(Cu+)增大,促进
Cl—(aq)+Cu+(aq) CuCl(s)右移,c(Cl—)减小,C 正确;
D.已知①Cu(s)+Cu2+(aq) 2Cu+(aq)ΔH1=a kJ·mol-1,②Cl—(aq)+Cu+(aq) CuCl(s)ΔH2=b
kJ·mol-1,根据盖斯定律,将①×1/2+②得反应 Cu(s)+ Cu2+(aq)+Cl—(aq) CuCl(s)的ΔH=
(a/2+b) kJ·mol-1,D 错误;答案选 C。
8.【2018 届厦门外国语学校三模】室温下,某二元碱 X(OH)2 水溶液中相关组分的物质的量分数随溶液 pH
变化的曲线如图所示,下列说法错误的是
A.Kb2 的数量级为 10-8
B.X(OH)NO3 水溶液显碱性
C.等物质的量的 X(NO3)2 和 X(OH)NO3 混合溶液中 c(X2+)>c[X(OH)+]
D.在 X(OH)NO3 水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
【答案】C
【解析】分析:本题是一道图形比较熟悉的题目,不过题目将一般使用的二元酸变为了二元碱,所以在分
析图示时要随时注意考查的是多元碱的分步电离。
第 9 页 共 20 页
D.在 X(OH)NO3 水溶液中,有电荷守恒:c(NO3
-)+c(OH-)= 2c(X2+)+c(H+)+c[X(OH)]+,物料守恒:
c(NO3
-)=c(X2+)+c[X(OH)2]+c[X(OH)]+,将物料守恒带入电荷守恒,将硝酸根离子的浓度消去,得到
该溶液的质子守恒式为:c[X(OH)2]+c(OH-)=c(X2+)+c(H+)。
9.【2018 届莆田市二模 B 卷】向 10mL 1 mol·L-1 的 HCOOH 溶液中不断滴加 1 mol·L-1 的 NaOH 溶液,
并一直保持常温,所加碱的体积与-lg c 水(H+)的关系如图所示。c 水(H+)为溶液中水电离的 c(H+)。下
列说法不正确的是
A.常温下,Ka(HCOOH)的数量级为 10-4
B.a、b 两点 pH 均为 7
C.从 a 点到 b 点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
【答案】B
【解析】分析:A.根据起始时甲酸溶液中水电离出的氢离子为 10-12mol/L 计算;
B.根据 a、b 溶液中的溶质判断;
C.根据酸碱盐对水电离平衡的影响分析;
D.根据影响溶液导电性的因素分析。
第 10 页 共 20 页
D.溶液的导电能力强弱取决于溶液中离子浓度的大小和离子所带电荷的多少,离子浓度越大,离子所
带的电荷越多,溶液的导电性越强。甲酸是弱酸,生成的甲酸钠以及氢氧化钠均是强电解质,所以混
合溶液的导电性逐渐增强,D 正确。答案选 B。
10.【2018 届莆田市二模】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓
度变化的关系如下图所示,下列有关说法错误..的是
A.曲线 M 表示 pH 与 lg 的变化关系
B.a 点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)
C.H2Y 的第二级电离常数 Ka2(H2Y)=10-4.3
D.交点 b 的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
【答案】D
【解析】详解:A.随着 pH 的增大,H2Y 的电离程度逐渐增大,溶液中 逐渐增大, 逐渐减小,
lg 逐渐增大,lg 逐渐减小,因此曲线 M 表示 pH 与 的关系,故 A 正确;
第 11 页 共 20 页
11.【2018 届黄冈中学三模】下列有关电解质溶液的说法正确的是( )
A.10mL0.1mol·L-1Na2CO3 溶液逐滴滴加到 10mL0.1mol·L-1 盐酸中,混合溶液中各离子浓度的大小
关系:c(Na+)>c(Cl-)>c(HCO3
-)>c(CO32-)
B.NH4HCO3 溶液中存在:C(NH4
+)=C(HCO3
-)+C(CO32-)+C(H2CO3)
C.常温下,测得某纯 CaSO3 与水形成的浊液 pH 为 9,已知 Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=
6.0×10-9,忽略 SO32-的第二步水解,则 Ksp(CaSO3)=3.6×10-10
D.若两种盐溶液的浓度相同且 pH(NaX)>pH(NaY),则 c(X-)+c(OH-)<c(Y-)+c(OH-)
【答案】D
【解析】分析:A 中考察碳酸钠溶液滴加到盐酸中生成氯化钠和二氧化碳;B 中主要考察水解的盐溶液中存
在的物料守恒规律,注意铵根离子、碳酸氢根离子均能发生水解;C 中先计算出亚硫酸根离子的水解平
衡常数,再计算出溶液中钙离子和亚硫酸根离子浓度,然后根据 Ksp(CaSO3)进行近似计算;D 根据两
种盐的水解程度不同, 水解能力强的,溶液的碱性强,氢离子浓度小,然后利用电荷守恒规律进行解
析。
第 12 页 共 20 页
12.【2018 届余姚中学模拟】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O)
=1.76×10-5,下列说法正确的是
A.浓度均为 0.1 mol·L-1 的 HCOONa 和 NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者
B.用相同浓度的 NaOH 溶液分别滴定等体积 pH 均为 3 的 HCOOH 和 CH3COOH 溶液至终点,消耗
NaOH 溶液的体积相等
C.0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) =
c(HCOOH) + c(H+)
D.0.2 mol·L-1 CH3COONa 与 0.1 mol·L-1 盐酸等体积混合后的溶液中(pH<7): c(CH3COOH)>
c(Cl- ) > c(CH3COO-)> c(H+)
【答案】A
【解析】A.电离平衡常数越大,其离子水解程度越小,根据电离平衡常数知,其离子水解程度:CH3COO
− >NH4
+>HCOO − , 任 何 电 解 质 溶 液 中 都 存 在 电 荷 守 恒 , 所 以 得 出 c(HCOO − )+c(OH
− )=c(Na+)+c(H+)=0.1mol/L+c(H+)、c(NH4
+)+c(H+)=c(Cl − )+c(OH − )=0.1mol/L+c(OH − ),水解程度
NH4
+>HCOO −,所以前者 c(H+)大于后者 c(OH −),所以浓度均为 0.1 mol⋅L−1 的 HCOONa 和
NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者,故 A 正确;
第 13 页 共 20 页
B.pH 相同的 HCOOH 和 CH3COOH,浓度:c(HCOOH)c(RO32-)>c(H2RO3)
D.当吸收 RO2 的溶液呈中性时,c(Na+)=c(RO32-)+c(HRO3
-)
【答案】C
【解析】a 点 溶液中含有 H2RO31mol,H2RO3+H2O+RO2=2NaHRO3 所以 a 点通入 1/3 mol RO2 后,溶液中
第 15 页 共 20 页
生 成 钠 离 子 2mol , RO32- 为 2/3 mol, 此 时 a 点 溶 液 呈 碱 性 , 说 明 RO32- 离 子 发 生 了 水 解 , 则
2c(Na+)>3c(RO32-),A 错误;b 点导致溶液碱性的因素是 HRO3
-的电离,因此溶液加水后生成的氢离子
浓度逐渐减小,pH 会只能无限接近 7,不会超过 7,B 错误;当通过 5/6 molRO2 时,溶液中生成 5/3mol
NaHRO3 ,剩余 Na2RO3 为 1/6 mol,此时溶液的 pH=6.2 显酸性,说明 HRO3
-以电离为主,故常温下,
NaHRO3 溶液中,c(HRO3
-)>c(RO32-)>c(H2RO3),C 正确;当吸收 RO2 的溶液呈中性时,根据电荷守恒:
c(H+)+c(Na+)=2c(RO32-)+c(HRO3
-)+c(OH-),由于 c(H+)=c(OH-),所以 c(Na+)=2c(RO32-)+c(HRO3
-),
D 错误;正确选项 C。
15.【2018 届重庆一中三模】常温时,配制一组 c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1 的混合溶液,溶
液 中 c(CO32-) 、 c(HCO3
-) 与 pH 的 关 系 如 图 所 示 。 下 列 说 法 中 错 误 的 是 ( 己 知 :
CO32-+H2O HCO3
-+OH- K=2×10-4,1g5=0.7)
A.a 点的溶液中:c(HCO3
-)> c(H2CO3)+c(CO32-)
B.b 点横坐标数值大约为 10.3
C.c 点的溶液中:c(Na+)<2c(CO32-)十 c(HCO3
-)
D.溶液中水的电离程度:a0.05 mol·L-1,溶液中离子浓度大小
c(HCO3
-)>c(H2CO3)+c(CO32-),所以 A 选项是正确的; B.b 点 c(CO32-)=c(HCO3
-)=0.05mol/L, 因
为 CO32-+H2O HCO3
-+OH- , K= =c(OH-)=2×10-4 ,
c(H+)=5 10-11,pH=-lg(5 10-11),所以 B 选项是正确的;
C.c 点溶液中,c(OH-)>c(H+),溶液中存在电荷守恒, c(OH-)+2c(CO32-)+c(HCO3
-)=c(H+)+c(Na+),
c(Na+)>2c(CO32-)+c(HCO3
-)故 C 错误;D.a、b、c 三点溶液中所含 Na2CO3 依次增多,所含 NaHCO3
第 16 页 共 20 页
依次减少,越弱越水解,对水的电离促进越大,即溶液中水的电离程度:aa>b
B.b 点混合液中 c(Na+)>c(CH3COO-)
C.加入 CH3COOH 过程中, 增大
D.25℃时,CH3COOH 的电离平衡常数 Ka=
【答案】D
【解析】分析:1.0L w mol•L-1 CH3COOH 溶液与 0.1mol NaOH 固体混合,混合后溶液的 pH<5,显酸
性,说明醋酸过量,溶液中溶质为 CH3COOH 和 CH3COONa;加醋酸时,酸的量增多,使溶液酸性增
第 18 页 共 20 页
强;加 CH3COONa 时,CH3COONa 本身水解显碱性,相当于加碱,使溶液酸性减弱,最终达到中性。
A.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小;B.b 点溶液 pH<5,
溶液显酸性,溶液中 c(H+)>c(OH-),根据电荷守恒分析;C.醋酸存在电离平衡,其平衡常数表达式
为 Ka= ,溶液中 Kw=c(H+)c(OH−),据此分析;D.pH=7 时,溶液中 c(H+)=c(OH-),
醋酸的电离平衡常数为 Ka= ,根据电荷守恒分析计算。
点睛:本题考查了弱电解质的电离平衡,盐类水解,溶液 pH 的判断,平衡常数的计算等知识,结合图象分
析是解题的关键。本题的易错点为 C,要注意根据电离平衡常数和水的离子积常数表达式分析判断。
18.【2018 届哈尔滨师范大学附属中学第四次模拟】常温下,将 0.1mol/LNaOH 溶液分别滴加到 0.1mol/LHA
溶液和 HB 溶液中,两混合溶液中离子浓度与 pH 的变化关系如图所示,下列说法不正确的是
第 19 页 共 20 页
A.Ka(HB)c(Na+)>c(H+)>c(OH-)
C.常温下,0.1mol/LNaA 溶液的 pH 大于 0.1mol/LNaB 溶液的 pH
D.向 HB 溶液中加入 NaOH 溶液,混合溶液中 c(B-)/c(HB)=10[pH-pKa(HB)](已知:pKa=-lgKa)
【答案】C
点睛:本题主要考查电离平衡常数的应用,根据图中特殊点的信息,再结合平衡常数公式即可计算出平衡
常数,此为难点。
19.【2018 届衡水中学第 20次模拟】某二元弱碱 B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向 10mL 稀 B(OH)2
溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液 POH[POH=-lgc(OH)-]变化的
关系如图,以下说法正确的是
A.交点 a 处对应加入的盐酸溶液的体积为 5mL
B.当加入的盐酸溶液的体积为 10mL 时存在 c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
第 20 页 共 20 页
C.交点 b 处 c(OH)=6.4×10-5
D.当加入的盐酸溶液的体积为 15mL 时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),
【答案】C
20.【2018 届绵阳中学三模】常温下,下列有关溶液的说法正确的是( )
A.pH 相等的①NH4Cl、②NH4Al(SO4)2、③NH4HSO4 溶液:浓度的大小顺序为①>②>③
B.HA 的电离常数 Ka =4.93×10−10,则等浓度的 NaA、HA 混合溶液中:c(Na+) >c(HA) >c(A−)
C.NaHCO3 溶液加水稀释,c(Na+)与 c(HCO3
−)的比值将减小
D.已知在相同条件下酸性 HF >CH3COOH,则物质的量浓度相等的 NaF 与 CH3COOK 溶液中:c(Na+)
– c(F−) >c(K+ ) − c(CH3COO−)
【答案】A
【解析】A.NH4Cl 水解时氯离子不影响铵根离子水解,由于 NH4HSO4 电离时产生 H+使溶液呈酸性,NH4
+
的水解被抑制,因此 NH4HSO4 中 NH4
+的浓度小于 NH4Cl,NH4Al(SO4)2 中铝离子水解抑制铵根离子的
水解,因此 NH4Al(SO4)2 中 NH4
+的浓度大于 NH4Cl,浓度的大小顺序应为:①>②>③,选项 A 正确;
B、NaA 中水解平衡常数 Kb= ,水解平衡常数大于电离平衡常数,c(HA)
−),选项 B 错误;C、NaHCO3 溶液加水稀释,促进碳酸氢根离子水解,钠离子物质的量不变,碳酸氢
根 减小,c(Na+)与 c(HCO3
-)的比值保持增大,选项错误;D、HF 、CH3COOH 都是弱酸,所以 NaF
与 CH3COOK 都是强碱弱酸盐,由于酸性 HF >CH3COOH,水解程度 F-<CH3COO-,水解程度越大剩
余离子浓度越小,故 c(Na+) – c(F−)<c(K+ ) − c(CH3COO−),选项 D 错误。答案选 A。