- 6.35 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考化学:杂化轨道理论(图解)
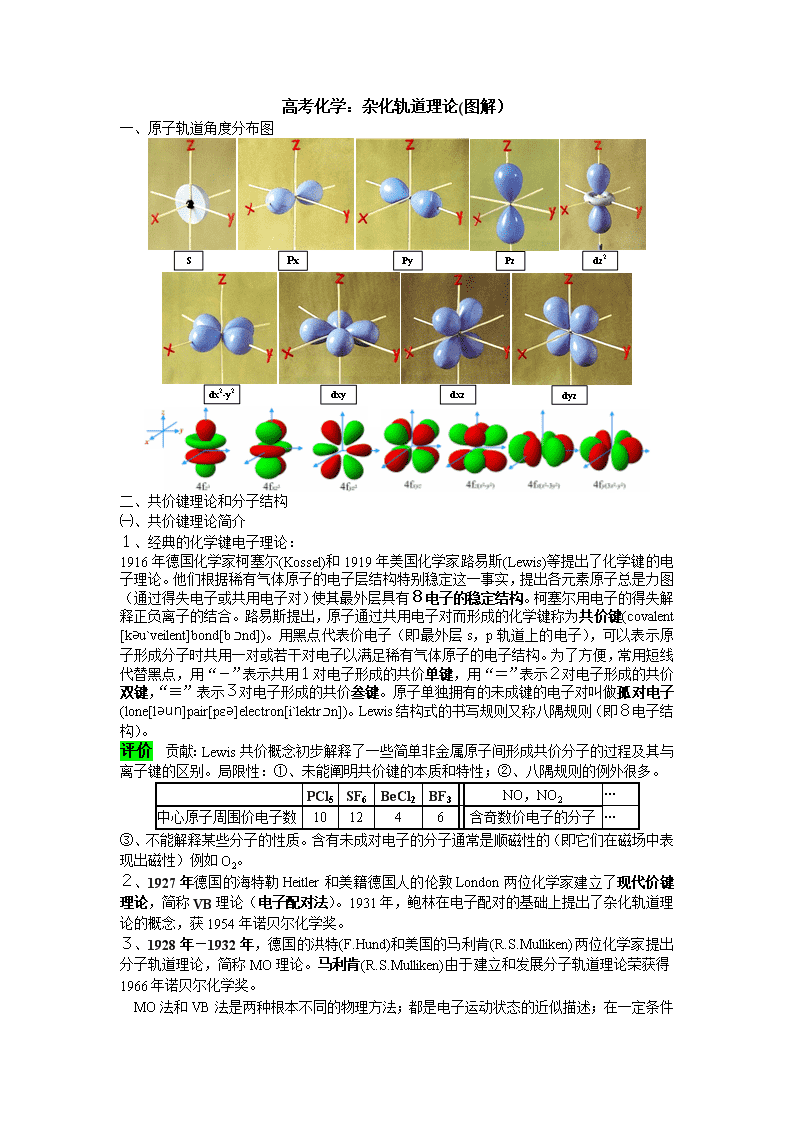
一、原子轨道角度分布图
二、共价键理论和分子结构
㈠、共价键理论简介
1、 经典的化学键电子理论:
1916年德国化学家柯塞尔(Kossel)和1919年美国化学家路易斯(Lewis)等提出了化学键的电子理论。他们根据稀有气体原子的电子层结构特别稳定这一事实,提出各元素原子总是力图(通过得失电子或共用电子对)使其最外层具有8电子的稳定结构。柯塞尔用电子的得失解释正负离子的结合。路易斯提出,原子通过共用电子对而形成的化学键称为共价键(covalent [kǝu`veilent]bond[bכnd])。用黑点代表价电子(即最外层s,p轨道上的电子),可以表示原子形成分子时共用一对或若干对电子以满足稀有气体原子的电子结构。为了方便,常用短线代替黑点,用“-”表示共用1对电子形成的共价单键,用“=”表示2对电子形成的共价双键,“≡”表示3对电子形成的共价叁键。原子单独拥有的未成键的电子对叫做孤对电子(lone[lǝun]pair[pεǝ]electron[i`lektrכn])。Lewis结构式的书写规则又称八隅规则(即8电子结构)。
评价 贡献:Lewis共价概念初步解释了一些简单非金属原子间形成共价分子的过程及其与离子键的区别。局限性:①、未能阐明共价键的本质和特性;②、八隅规则的例外很多。
PCl5
SF6
BeCl2
BF3
NO,NO2
…
中心原子周围价电子数
10
12
4
6
含奇数价电子的分子
…
③、不能解释某些分子的性质。含有未成对电子的分子通常是顺磁性的(即它们在磁场中表现出磁性)例如O2。
2、1927年德国的海特勒Heitler和美籍德国人的伦敦London两位化学家建立了现代价键理论,简称VB理论(电子配对法)。1931年,鲍林在电子配对的基础上提出了杂化轨道理论的概念,获1954年诺贝尔化学奖。
3、1928年-1932年,德国的洪特(F.Hund)和美国的马利肯(R.S.Mulliken)两位化学家提出分子轨道理论,简称MO理论。马利肯(R.S.Mulliken)由于建立和发展分子轨道理论荣获得1966年诺贝尔化学奖。
MO法和VB
法是两种根本不同的物理方法;都是电子运动状态的近似描述;在一定条件下它们具有等价性。
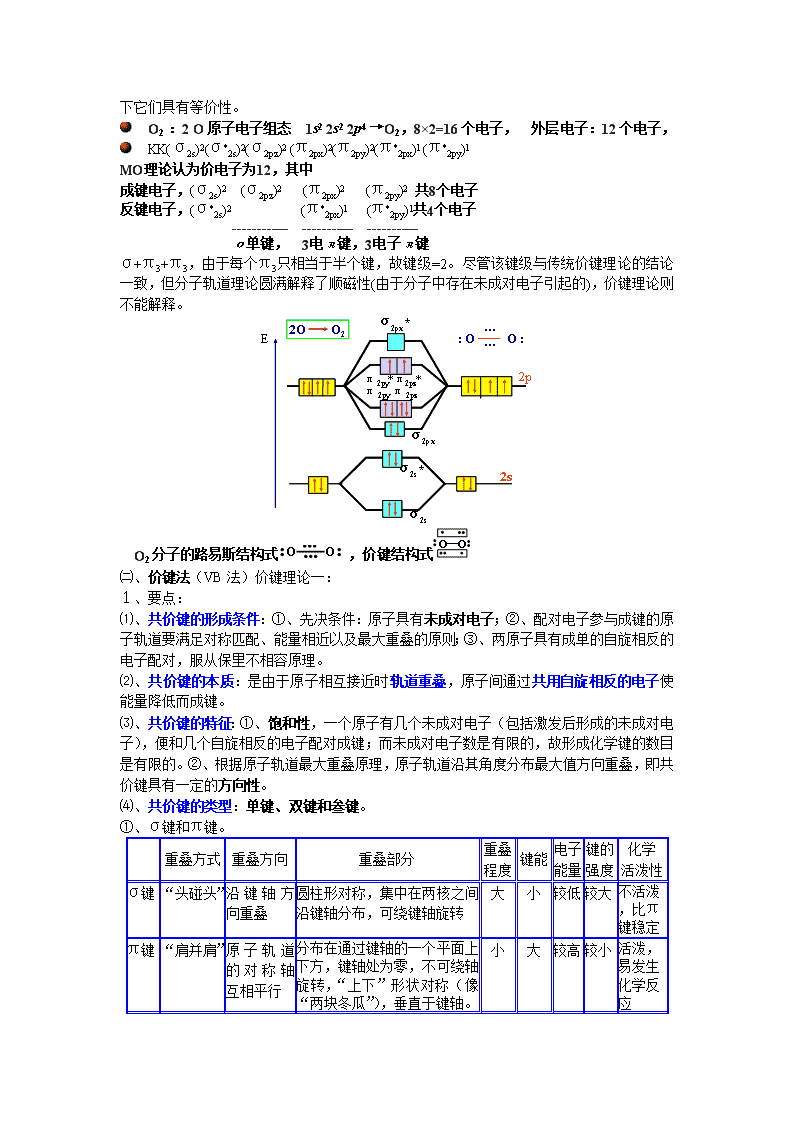
l O2 :2 O原子电子组态 1s2 2s2 2p4 →O2,8×2=16个电子, 外层电子:12个电子,
l KK(σ2s)2(σ*2s)2(σ2pz)2 (π2px)2(π2py)2(π*2px)1 (π*2py)1
MO理论认为价电子为12,其中
成键电子,(σ2s)2 (σ2pz)2 (π2px)2 (π2py)2 共8个电子
反键电子,(σ*2s)2 (π*2px)1 (π*2py)1共4个电子
------------ ----------- -----------
σ单键, 3电π键,3电子π键
σ+π3+π3,由于每个π3只相当于半个键,故键级=2。尽管该键级与传统价键理论的结论一致,但分子轨道理论圆满解释了顺磁性(由于分子中存在未成对电子引起的),价键理论则不能解释。
O2分子的路易斯结构式,价键结构式
㈡、价键法(VB法)价键理论一:
1、要点:
⑴、共价键的形成条件:①、先决条件:原子具有未成对电子;②、配对电子参与成键的原子轨道要满足对称匹配、能量相近以及最大重叠的原则;③、两原子具有成单的自旋相反的电子配对,服从保里不相容原理。
⑵、共价键的本质:是由于原子相互接近时轨道重叠,原子间通过共用自旋相反的电子使能量降低而成键。
⑶、共价键的特征:①、饱和性,一个原子有几个未成对电子(包括激发后形成的未成对电子),便和几个自旋相反的电子配对成键;而未成对电子数是有限的,故形成化学键的数目是有限的。②、根据原子轨道最大重叠原理,原子轨道沿其角度分布最大值方向重叠,即共价键具有一定的方向性。
⑷、共价键的类型:单键、双键和叁键。
①、σ键和π键。
重叠方式
重叠方向
重叠部分
重叠
程度
键能
电子
能量
键的
强度
化学
活泼性
σ键
“头碰头”
沿键轴方向重叠
圆柱形对称,集中在两核之间沿键轴分布,可绕键轴旋转
大
小
较低
较大
不活泼
,比π键稳定
π键
“肩并肩”
原子轨道的对称轴互相平行
分布在通过键轴的一个平面上下方,键轴处为零,不可绕轴旋转,“上下”形状对称(像“两块冬瓜”),垂直于键轴。
小
大
较高
较小
活泼,易发生化学反应
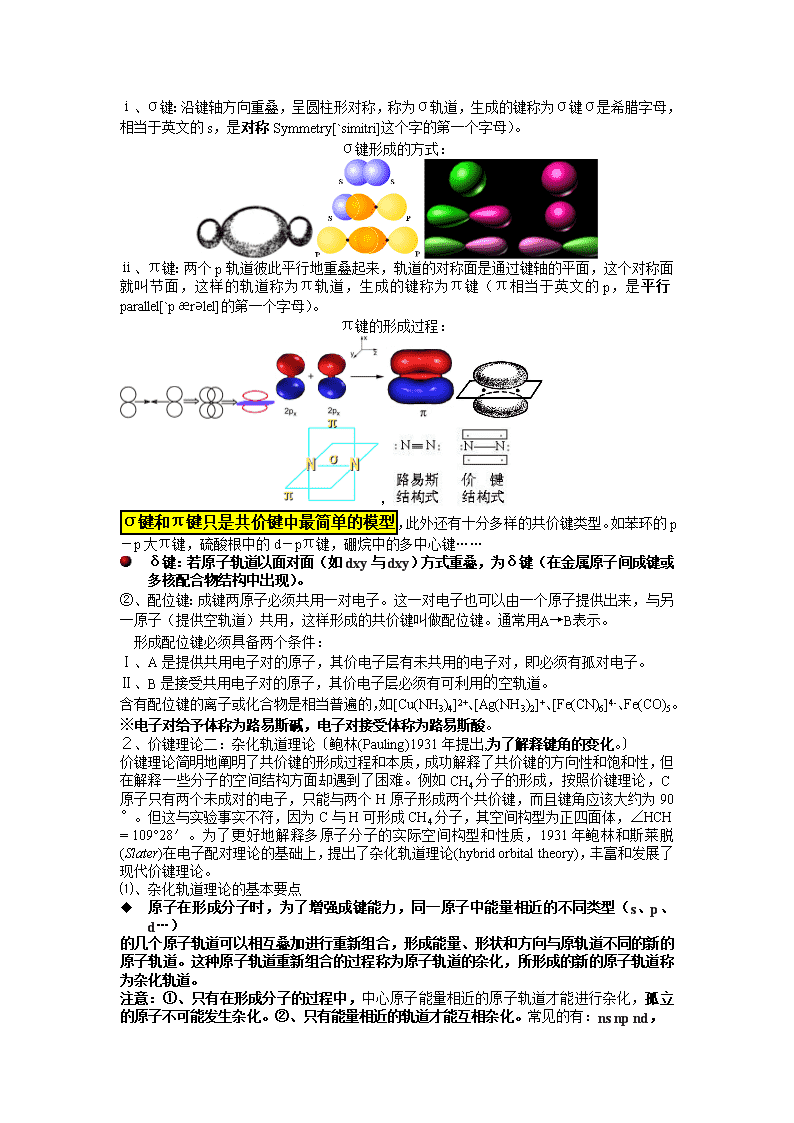
ⅰ、σ键:沿键轴方向重叠,呈圆柱形对称,称为σ轨道,生成的键称为σ键σ是希腊字母,相当于英文的s,是对称Symmetry[`simitri]这个字的第一个字母)。
σ键形成的方式:
ⅱ、π键:两个p轨道彼此平行地重叠起来,轨道的对称面是通过键轴的平面,这个对称面就叫节面,这样的轨道称为π轨道,生成的键称为π键(π相当于英文的p,是平行parallel[`pærǝlel]的第一个字母)。
π键的形成过程:
,
σ键和π键只是共价键中最简单的模型,此外还有十分多样的共价键类型。如苯环的p-p大π键,硫酸根中的d-pπ键,硼烷中的多中心键……
l δ键:若原子轨道以面对面(如dxy与dxy)方式重叠,为δ键(在金属原子间成键或多核配合物结构中出现)。
②、配位键:成键两原子必须共用一对电子。这一对电子也可以由一个原子提供出来,与另一原子(提供空轨道)共用,这样形成的共价键叫做配位键。通常用A→B表示。
形成配位键必须具备两个条件:
Ⅰ、A是提供共用电子对的原子,其价电子层有未共用的电子对,即必须有孤对电子。
Ⅱ、B是接受共用电子对的原子,其价电子层必须有可利用的空轨道。
含有配位键的离子或化合物是相当普遍的,如[Cu(NH3)4]2+、[Ag(NH3)2]+、[Fe(CN)6]4-、Fe(CO)5。
※电子对给予体称为路易斯碱,电子对接受体称为路易斯酸。
2、价键理论二:杂化轨道理论〔鲍林(Pauling)1931年提出,为了解释键角的变化。〕
价键理论简明地阐明了共价键的形成过程和本质,成功解释了共价键的方向性和饱和性,但在解释一些分子的空间结构方面却遇到了困难。例如CH4分子的形成,按照价键理论,C原子只有两个未成对的电子,只能与两个H原子形成两个共价键,而且键角应该大约为90°。但这与实验事实不符,因为C与H可形成CH4分子,其空间构型为正四面体,∠HCH = 109°28′。为了更好地解释多原子分子的实际空间构型和性质,1931年鲍林和斯莱脱(Slater)在电子配对理论的基础上,提出了杂化轨道理论(hybrid orbital theory),丰富和发展了现代价键理论。
⑴、杂化轨道理论的基本要点
u 原子在形成分子时,为了增强成键能力,同一原子中能量相近的不同类型(s、p、d…)
的几个原子轨道可以相互叠加进行重新组合,形成能量、形状和方向与原轨道不同的新的原子轨道。这种原子轨道重新组合的过程称为原子轨道的杂化,所形成的新的原子轨道称为杂化轨道。
注意:①、只有在形成分子的过程中,中心原子能量相近的原子轨道才能进行杂化,孤立的原子不可能发生杂化。②、只有能量相近的轨道才能互相杂化。常见的有:ns np nd,
(n-1)d ns np;③、杂化前后,总能量不变。但杂化轨道在成键时更有利于轨道间的重叠,即杂化轨道的成键能力比未杂化的原子轨道的成键能力增强,形成的化学键的键能大。这是由于杂化后轨道的形状发生了变化,电子云分布集中在某一方向上,成键时轨道重叠程度增大,成键能力增强。④、杂化所形成的杂化轨道的数目等于参加杂化的原子轨道的数目,亦即杂化前后,原子轨道的总数不变。⑤、杂化轨道的空间构型取决于中心原子的杂化类型。不同类型的杂化,杂化轨道的空间取向不同,即一定数目和一定类型的原子轨道间杂化所得到的杂化轨道具有确定的空间几何构型,由此形成的共价键和共价分子相应地具有确定的几何构型。
什么叫杂化?同一原子的能量相近的原有的原子轨道“混杂”起来,重新组合形成新轨道的过程,叫做杂化。
什么叫杂化轨道?新组合的原子轨道叫做杂化轨道。
为什么要杂化?杂化轨道形成的化学键的强度更大,体系的能量更低。
杂化的动力:受周围原子的影响。
为什么杂化后成键,体系的能量降低?杂化轨道在一个方向上更集中,便于轨道最大重叠。
杂化轨道的构型决定了分子的几何构型:杂化轨道有利于形成σ键,但不能形成π键。由于分子的空间几何构型是以σ键为骨架,故杂化轨道的构型就决定了其分子的几何构型。
l 杂化的规律
l 杂化前后轨道数目不变,空间取向改变 ;
l 杂化轨道能与周围原子形成更强的σ键,或安排孤对电子,而不会以空的杂化轨道存在。
l 杂化后轨道伸展方向、形状发生改变,成键能力增强,成键能力大小顺序(p成分越多
成键能力越强)sp