- 791.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学计算
一、化学基本计算方法
1.差值法
当反应前后固体或液体的质量发生变化时或反应前后气体的压强、密度、物质的量、体积等发生变化时可用差量法计算。
[例1] 在天平左右两盘上各放一只同等规格的烧杯,烧杯内均盛有 1.00 mol· L-1的 H2SO4(aq)100.0 mL,调节天平使其处于平衡状态,然后向两只烧杯内分别放入少量的镁粉和铝粉(设镁、铝的质量分别为a g和b g),假定反应后天平仍处于平衡状态,则:
(1)a、b应满足的关系式为 ;
(2)a、b的取值范围为 。
[练习] 将上题中的:“少量镁粉和铝粉”改为:少量镁粉、过量铝粉,其他不变,试求之。
[练习] 已知 NH3 和 Cl2 相遇,发生下列反应:
① 8NH3+3Cl2 ==== N2+6NH4Cl (NH3过量)
②2NH3+3Cl2==== N2+6HCl (Cl2过量)
今向过量的 NH3 中通入少量的 Cl2。若开始时 Cl2、NH3 混和气体中 Cl2 的体积分数为 x,混合气体反应前后的体积分别是 a L 和 y L。则:
(1)x 的取值范围是__________________;
(2)y 与x 的函数关系是__________________。
2.和量法
与差量法相反,为解决问题方便,有时需要将多个反应物(或生成物)合在一起进行计算。
[例2] 在一密闭容器中,放入(NH4)2CO3 和 NaOH 两种固体共 A g 将容器加热到 200℃,经充分反应后排出其中气体,冷却称得剩余固体质量为 B g,求出不同组合范围内的(NH4)2CO3 和 NaOH 的质量填入下表。
A 与 B 关系
m[(NH4)2CO3]
m(NaOH)
[练习] 取 6.60 g NaHCO3 和 Na2O2 的固体混合物,在密闭容器中加热到 250℃,经充分反应后排出气体,冷却后称得固体质量为 5.30 g。计算原混合物中 Na2O2 的质量分数。
3.守恒法
化学上,常用的守恒方法有以下几种:
1.电荷守恒
溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数。即:阳离子物质的量(或浓度)与其所带电荷数乘积的代数和等于阴离子物质的量(或浓度)与其所带电荷数乘积的代数和。
2.电子守恒
化学反应中(或系列化学反应中)氧化剂所得电子总数等于还原剂所失电子总数。
3.原子守恒
系列反应中某原子(或原子团)个数(或物质的量)不变。以此为基础可求出与该原子(或原子团)相关连的某些物质的数量(如质量)。
4.质量守恒
包含两项内容:①质量守恒定律;②化学反应前后某原子(或原子团)的质量不变。
此外,还有物料平衡。
[例3] 现有19.7 g由Fe、FeO、Al、Al2O3组成的混合物,将它完全溶解在540 mL 2.00 mol·L-1的H2SO4溶液中,收集到标准状况下的气体8.96 L。已知混合物中,Fe、FeO、Al、Al2O3的质量分数分别为0.284、0.183、0.274和0.259。欲使溶液中的金属阳离子完全转化为氢氧化物沉淀,至少应加入2.70 mol·L-1的NaOH(aq)体积是________
[练习] A、B、C三种物质各15 g,发生如下反应:
A+B+CD
反应后生成D的质量为30 g。然后在残留物中加入10 g A,反应又继续进行,待反应再次停止,反应物中只剩余C,则下列说法正确的是( )
A.第一次反应停止时,剩余B 9 g
B.第一次反应停止时,剩余C 6 g
C.反应中A和C的质量比是5∶3
D.第二次反应后,C剩余5 g
4.估算法
估算就是不算,估算法是通过推理、猜测得出答案的一种方法。
[例4] 将质量分数为 0.052(5.2%)的 NaOH(aq)1 L(密度为 1.06 g·cm-3)用铂电极电解,当溶液中 NaOH 的质量分数改变了 0.010(1.0%)时停止电解,则此时溶液中应符合的关系是( )
NaOH的质量分数
阳极析出物的质量/g
阴极析出物的质量/g
A
0.062(6.2%)
19
152
B
0.062(6.2%)
152
19
C
0.042(4.2%)
1.2
9.4
D
0.042(4.2%)
9.4
1.2
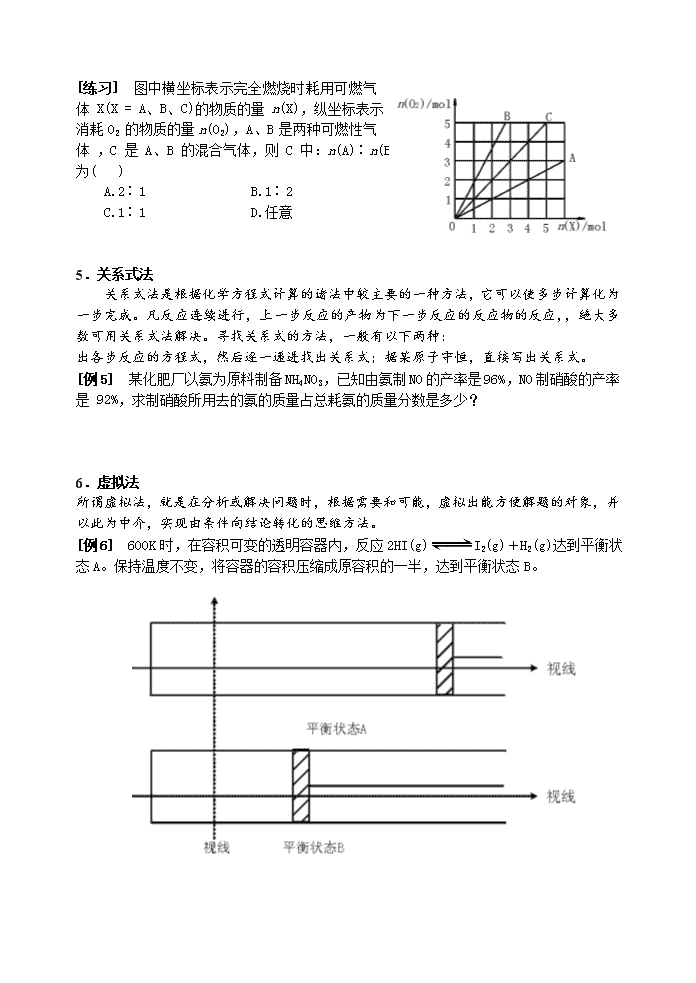
[练习] 图中横坐标表示完全燃烧时耗用可燃气体 X(X = A、B、C)的物质的量 n(X),纵坐标表示消耗 O2 的物质的量 n(O2),A、B 是两种可燃性气体 ,C 是 A、B 的混合气体,则 C 中:n(A)∶n(B)为( )
A.2∶1 B.1∶2
C.1∶1 D.任意
5.关系式法
关系式法是根据化学方程式计算的诸法中较主要的一种方法,它可以使多步计算化为一步完成。凡反应连续进行,上一步反应的产物为下一步反应的反应物的反应,,绝大多数可用关系式法解决。寻找关系式的方法,一般有以下两种:
出各步反应的方程式,然后逐一递进找出关系式;据某原子守恒,直接写出关系式。
[例5] 某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,求制硝酸所用去的氨的质量占总耗氨的质量分数是多少?
6.虚拟法
所谓虚拟法,就是在分析或解决问题时,根据需要和可能,虚拟出能方便解题的对象,并以此为中介,实现由条件向结论转化的思维方法。
[例6] 600 K时,在容积可变的透明容器内,反应2HI(g)I2(g)+H2(g)达到平衡状态A。保持温度不变,将容器的容积压缩成原容积的一半,达到平衡状态B。
图8—1
(1)按图8—1所示的虚线方向观察,能否看出两次平衡容器内颜色深浅的变化?并请说明理由。
答:
(2)按图8—1所示的实线方向观察(活塞无色透明),能否看出两次平衡容器内颜色深浅的变化?并请说明理由。
答:
[练习] 在一定温度和压强下,某容器内存在如下平衡(平衡 A):
2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)
这是工业合成尿素的反应。如果将容器的容积缩小为原来的 1/3,则达到平衡时(平衡 B)下列说法一定正确的是( )
A.气体的平均式量比原来大 B.气体的平均式量比原来小
C.气体的平均式量与原来相等 D.依据题给条件无法确定
7.平均值法
混合物的平均式量、元素的质量分数、生成的某指定物质的量总是介于组分的相应量的最大值M2与最小值M1之间,表达式为M1 < M < M2,已知其中两个量,可以确定另一个量的方法,称为平均值法。
[例7] 有Zn和另一种金属组成的混合物4.5g,与足量的盐酸反应,放出所氢气0.2g,则另一种 种种金属可能是( )
A.Al B. Mg C. Zn D. Cu
8.极值法
就是将复杂的问题假设为处于某一个或某两个极端状态,并站在极端的角度分析问题,求出一个极值,推出未知量的值,或求出两个极值,确定未知量的范围,从而使复杂的问题简单化。其主要应用于:
(1)用极值法确定混合气体的平均相对分子质量;
(2)用极值法确定物质的质量;
(3)用极值法确定物质的成分;
(4)用极值法确定反应中反应物、生成物的取值范围;
(5)用极值法确定杂质的成分。
解题一般思路:
(1)根据题目给定的条件和化学反应原理,确定不确定条件的范围;
(2)计算相应条件下的最大值或最小值;
(3)综合分析得出正确答案
[例8] 将一严重锈蚀部分变成铜绿的铜块研磨成粉末,在空气中充分灼烧成氧化铜,固体质量的变化情况可能是( )
A.增重30% B.增重10% C.不变 D.减轻30%
9.讨论法
[例9] 接触法制排放的尾气中,含有少量的,为防止污染空气,在排放前设法进行综合利用。
(1)某硫酸厂每天排放(换算成标况下体积)尾气中含(体积分数)的。问用氢氧化钠溶液、石灰及氧气处理后,假设元素不损失,理论上可得多少千克石膏()
(2)如果将一定体积的尾气通入的溶液使其反应,经测定所得溶液含溶质。试分析溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠。调节尾气排放的流量,以取得与间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。现设,,分别表示、、的物质的量,且,试写出在不同取值范围时,的值或与、间的关系式,并填写下表:
[练习] 将和置于一个容积可变的容器内进行反应。维持容器内气体的压强不变(101千帕),在120℃下测得反应前后容器内气体的密度分别为和。若的取值不同,则的氧化产物可能有如下三种情况:
(1)全部是,此时的取值范围是 。
(2)全部是S,此时的取值范围是 ,并且 (填小于、大于或等)。
(3)部分是,部分是S,此时的取值范围是 ,反应所生成的
的物质的量为 ,容器内气体的物质的量之和为 。(以含的代数式表示)
10.十字交叉法
十字交叉法在相关混合物的计算中,往往显得非常简捷、准确,如果我们都能熟练使用它,将会充分感受到解题的乐趣,甚至还有愉悦身心的感觉.但在运用这种方法时,也会出现意想不到的问题。
在、120℃时,1LA、B两种烷烃组成的混合气体在足量中充分燃烧后得到同况同压下和,且A分子中比B少2个碳原子。试确定A和B的分子式和体积比?
体验高考
1. [2012·江苏化学卷18](12分)硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100ml溶液A 。②准确量取25.00 ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g 。③准确量取25.00 ml溶液A,加入适量稀硫酸酸化后,用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 ml。H2O2与KMnO4反应的离子方程式如下:
2MnO4―+5H2O2+6H+=4Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(2)上述滴定不加稀硫酸酸化,MnO4―被还原成MnO2,其离子方程式为:
。
(3)通过计算确定样品的组成(写出计算过程)。
2. [2012·江苏化学卷20](14分)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=3Al(l)+AlCl3(g) △H=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式 。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
Mg17Al12+17H2=17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
②在6.0mol·L-1HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为 。
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,
混合物Y均只能部分放出氢气,反应后残留固体物质X-射线衍射谱图如右图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是
(填化学式)。
(3)铝电池性能优越,Al-AgO电池可用作水下
动力电源,其原理如右下图所示。该电池反应
的化学方程式为:
。
3.[2012·海南化学卷16](9分) 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氧化钠辖液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。 (2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通如量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×l04C · mol-1列式计算),最多能产生的氯气体积为 L(标准状况)。
4.[2012·浙江理综化学卷28](14分)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq) 2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
滴定反应 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 =
3K2SO4 + 6MnSO4 +10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
50 °C时 2Na2CO3·3H2O2 (s) 开始分解
请回答下列问题:
(1)图中支管的作用是 。
(2)步骤①的关键是控制温度,其措施有 、
和 。
(3)在滤液X中加入适量NaCl固体或无水乙醇,
均可析出过碳酸钠,原因是 。
(4)步骤③中选用无水乙醇洗涤产品的目的
是 。
(5)下列物质中,会引起过碳酸钠分解的有 。
A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000 g 过碳酸钠于250 mL 锥形瓶中,加50 mL 蒸馏水溶解,再加50 mL 2.0 mol·L-1 H2SO4,用2.000×10-2 mol·L-1 KMnO4 标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
5.[2012·四川理综化学卷28](17分)甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如下实验流程:
制取氧气
装有足量干燥剂的干燥管
装有氧化铜的硬质玻管
盛有足量浓
硫酸的洗气瓶
测定生成氮
气的体积
试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得:反应前氧化铜的质量为、氧化铜反应后剩余固体的质量为、生成氮气在标准状况下的体积。
乙小组测得:洗气前装置D的质量、洗气后装置后D的质量、生成氮气在标准状况下的体积。
请回答下列问题:
(1)写出仪器a的名称: 。
(2)检查A装置气密性的操作是 。
实验装置
实验药品
制备原理
甲小组
A
氢氧化钙、硫酸铵
反应的化学方程式为
①
乙小组
②
浓氨水、氢氧化钠
用化学平衡原理分析氢氧化钠的作用:
③
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为 。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是 。 为此,乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果。该药品的名称是 。